miR-200c靶向程序性死亡蛋白配体1基因抑制结肠癌细胞的侵袭能力
孔晓静
(山东省东明县中医医院内科,山东 东明 274500)
近年来我国结肠癌发病率及病死率呈上升趋势〔1,2〕,肿瘤逃避机体免疫监视是肿瘤发生发展的重要机制,程序性细胞死亡蛋白 (PD)-1与配体(PD-L1)结合后使T细胞受体信号通路多个关键的信号分子去磷酸化,从而抑制免疫应答〔3,4〕,PD-1/PD-L1 抗体药物纳武单抗是目前消化系统肿瘤免疫治疗领域的热点,已有研究报道miRNA 作为表观遗传调控的重要成员,通过调控 PD-1/PD-L1的表达抑制肿瘤细胞的增殖与侵袭〔5,6〕,本研究通过免疫组织化学法检测PD-L1分子在结肠癌组织中的表达状况,并与临床病理特征进行相关性分析,初步探索 miR-200c靶向调控PD-L1基因对结肠癌细胞侵袭能力的影响。
1 材料与方法
1.1研究对象 收集山东省东明县中医医院2016年1月至2017年12月行结肠癌根治术47例患者的癌组织、癌旁组织(距肿瘤边缘大于5 cm)组织标本,47例患者中男32例,女15例,平均年龄(52.6±8.4)岁,升结肠癌17例,横结肠癌5例,降结肠癌13例、乙状结肠癌12例,患者均为初始治疗,术前未接受放化疗治疗,术后病理证实为结肠恶性肿瘤。结肠癌LoVo细胞购自中科院上海细胞库。
1.2主要试剂 10%胎牛血清、DMEM 培养液(美国Gibco公司)、 LipofectamineTM3000脂质体、miR-200c模拟物(上海生工生物工程有限公司合成)、侵袭小室(美国Sigma公司)、双荧光报告基因检测试剂盒(美国Promega公司)、鼠抗PD-L、二氨基联苯胺(DAB)显色试剂盒均购自福州迈新生物技术开发有限公司。
1.3免疫组化法检测结肠癌组织中PD-L1蛋白的表达 取47例结肠癌患者手术标本,常规、脱蜡水化、高温抗原修复、封闭,加入兔抗人PD-L1单克隆抗体、二抗孵育、DAB显色、苏木精复染、封片,结肠癌组织标本的免疫组化切片均由2名资深病理科医生独立双盲观察,细胞内出现棕黄色颗粒者为阳性。
1.4细胞培养与转染 将结肠癌LoVo细胞培养于添加10%胎牛血清的DMEM培基中,37℃、5%CO2的培养箱中孵育培养,通过TargetScan 靶基因预测库预测 miR-200c能与PD-L1 的3′-UTR 结合,取对数生长期结肠癌LoVo细胞,0.25%胰酶消化后将细胞分成3组,转染组转染 miR-200c mimic,阴性对照组转染 miR-NC,空白对照组为正常培养LoVo细胞。将上述3组细胞利用LipofectamineTM3000脂质体转染后,根据Trizol试剂盒说明书提取总RNA,按照Invitrogen试剂盒说明书进行反转录反应、扩增,以β-actin为内参,用Real-time PCR法检测细胞中miR-200c、PD-L1 mRNA的表达,miR-200c、PD-L1的引物序列见表1。
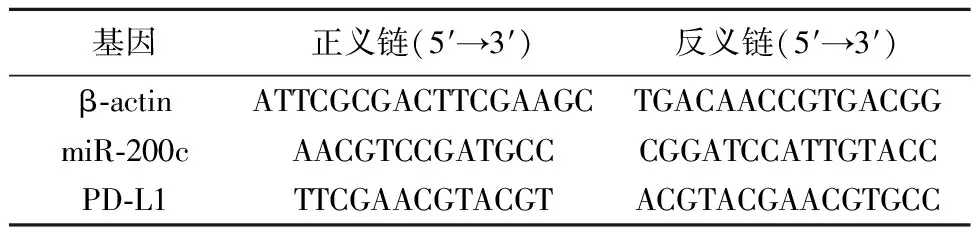
表1 β-actin、miR-200c、PD-L1的引物序列
1.5荧光素酶报告基因检测各组双荧光素酶活性 将含有miR-200c结合位点PD-L1的3′-UTR片段插入pGL-3荧光素酶报告基因载体,构建野生型和突变型的荧光素酶报告载体,分别将miR-200c、miR-NC和pGL-3荧光素酶报告载体共转染结肠癌LoVo细胞,共3组细胞:①miR-200c mimic+pGL-3 PD-L1 3′-UTR-Wt(转染组);②miR-NC mimic+pGL-3 PD-L1 3′-UTR-Wt(阴性对照组);③空白对照组细胞,置于37℃、5%CO2培养箱中继续培养24 h,按照Promega公司双荧光素酶检测方法进行检测。
1.6Transwell法检测细胞侵袭能力 将转染组转染 miR-200c mimic,阴性对照组转染 miR-NC,空白对照组为正常培养LoVo细胞进行转染48 h后,0.25%胰酶消化,接种到Transwell上室后加入DMEM培养基,下室加入500 μl含10%胎牛血清的DMEM培养基,培养箱中培养48 h后,取出 Transwell小室,冲洗、固定、染色后,倒置显微镜下观察计数。
1.7统计方法 采用SPSS18.0统计软件进行t检验、方差分析,PD-L1与临床病理特征的相关性分析采用χ2检验。
2 结 果
2.1PD-L1在结肠癌组织中的表达及与临床病理特征的关系 PD-L1主要表达于肿瘤细胞和淋巴细胞(图1),结肠癌组织中PD-L1蛋白表达阳性率为55.3%(26/47),显著高于癌旁组织〔27.7%(13/47)〕,差异有统计学意义(χ2=7.406,P=0.006 5)。结肠癌组织中PD-L1蛋白表达与肿瘤分化(χ2=6.021,P=0.031 2)、pN分期(χ2=7.141,P=0.003 7)、T分期有关(χ2=8.073,P=0.044 5),与患者年龄、性别、肿瘤最大径、肿瘤部位无明显相关性(表2)。
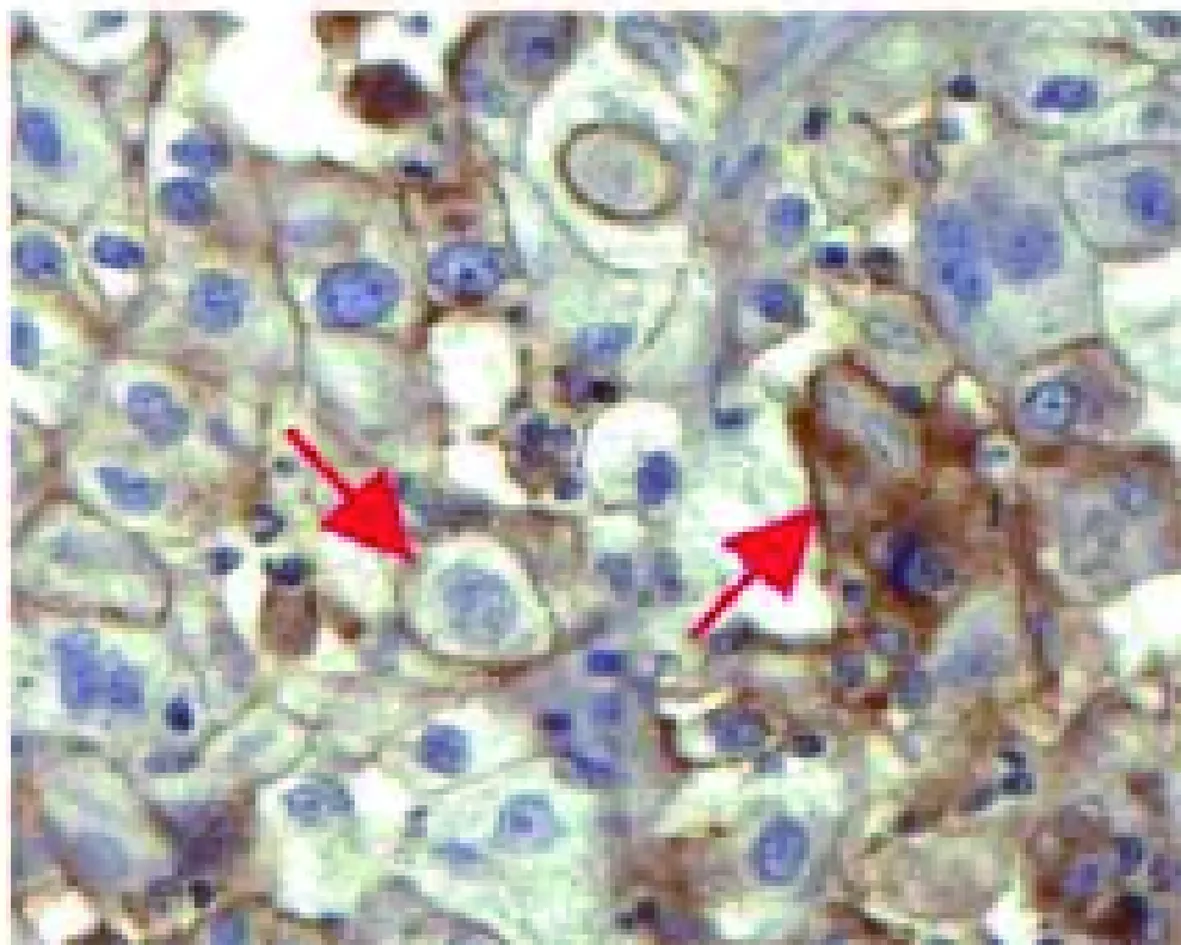
图1 PD-L1在结肠癌组织中的表达(DAB,×400)

表2 PD-L1表达与临床病理特征的相关性(n)
2.2miR-200c靶向调控结肠癌LoVo细胞PD-L1的表达 转染组转染 miR-200c mimic后,细胞内miR-200c的表达明显上升,miR-200c水平(2.23±0.52)较空白对照组(0.43±0.12)、阴性对照组(0.51±0.15)明显升高,差异有统计学意义(F=57.45,P<0.000 1),表明miR-200c mimic在结肠癌LoVo细胞中高表达,已成功转染 miR-200c mimic。miR-200c mimic转染后,细胞内PD-L1的表达下降至(0.27±0.06),与空白对照组(1.12±0.38)、阴性对照组(1.35±0.44)有统计学差异(F=19.14,P=0.000 2)。miR-200c mimic转染组荧光素酶活性(0.38±0.11),明显低于空白对照组(1.01±0.09)、阴性对照组(1.05±0.10),差异有统计学意义(F=118.2,P<0.000 1)。
2.3miR-200c对LoVo细胞侵袭能力的影响 miR-200c mimics 转染结肠癌 LoVo细胞48 h后,细胞迁移数目(156±43.6)明显低于空白对照组(239±59.8)、阴性对照组(274±61.9),差异有统计学意义(F=7.102,P=0.006 8)。
3 讨 论
肿瘤免疫治疗通过活化特异性T淋巴细胞,激活和增强机体对肿瘤细胞的免疫应答,是最新而且有效的肿瘤治疗手段〔7,8〕。PD-1是表达于T细胞表面的负共刺激信号分子,活化的PD-1通过与配体PD-L1结合,募集蛋白酪氨酸磷酸酶,使T细胞受体信号关键分子去磷酸化,抑制抑制免疫应答〔3~5,9〕,多项研究证实PD-L1在胃癌、肝细胞癌等实体肿瘤中呈过表达状态〔10~12〕。我们的研究发现47例结肠癌组织中PD-L1蛋白表达与肿瘤分化程度、淋巴结转移、浸润深度有关,与患者年龄、性别、肿瘤直径大小、肿瘤部位无明显相关性,提示PD-L1可能与结肠癌的发生发展有关。
PD-L1是一种由290个氨基酸构成的跨膜蛋白,基因定位于染色体9p24,胞外区含有与PD-1结合的结构域〔13〕。miR-200c是miR-200 家族成员之一,与家族成员miR-141成簇定位于染色体12p13,miR-200 家族通过参与肿瘤转移的上皮-间质转化过程〔14,15〕,有研究证实miR-200b通过靶向PD-L1 3′-UTR抑制胃癌细胞内 PD-L1的表达〔16〕,提示miR-200 家族成员可能通过抑制PD-L1发挥其抑癌基因的作用。本研究通过脂质体使结肠癌LoVo细胞过表达miR-200c后,进一步证实miR-200c在结肠癌中靶向下调PD-L1,与肿瘤的发生发展、浸润转移有关,推测其原因可能与miR-200c下调PD-L1后,结肠癌肿瘤转移和免疫逃逸能力增强,提示miR-200c介导的PD-L1基因沉默可能与结肠癌的转移侵袭有关,然而其具体机制仍有待进一步研究。结肠癌是发病率较高的消化道恶性肿瘤,一项多中心结肠癌患者临床Ⅱ期试验证实,PD-1/PD-L1抑制剂Pembrolizumab对氟嘧啶或伊立替康治疗失败的结肠癌患者,具有较高的疾病控制率,可能是结肠癌患者免疫治疗的新方向〔17〕。免疫治疗在最新肿瘤治疗中崭露头角,免疫检测点PD-1及其配体PD-L1诱导免疫耐受是肿瘤免疫逃逸的关键分子,虽然目前PD-1/PD-L1抑制剂Nivolumab和Pembrolizumab在消化道肿瘤的治疗中应用广泛,但其机制仍有待于从细胞分子、基因水平进一步加以探索,本研究发现,PD-L1在结肠癌组织中高表达,且与肿瘤分化、淋巴结转移、浸润深度有关,miR-200c通过靶向结肠癌LoVo细胞内PD-L1 3′-UTR抑制PD-L1的表达,上调miR-200c表达可抑制结肠癌LoVo细胞侵袭能力。

