白藜芦醇纳米粒联合丝素凝胶治疗银屑病的实验研究
毛艳菲,周岳娟,徐静红
(浙江省丽水市中心医院药剂科,丽水 323000)
银屑病是一种慢性炎症性皮肤疾病,全世界发病率2%~3%,且目前缺乏安全、有效的治疗方法[1]。研究证实,皮肤局部促炎症细胞因子如白细胞介素-6(IL-6)、白细胞介素-1β(IL-1β)及趋化因子如肿瘤坏死因子α(TNF-α)的表达增加,激活下游核因子-κB(NF-κB),吸引免疫细胞在炎症皮肤区域聚集并增殖替代原有的正常细胞,与银屑病的发病有着密切联系[2]。白藜芦醇(resveratrol,RSV)是一种天然存在的多酚类化合物,研究显示,其能够通过抑制多种炎症因子如IL-1Β、IL-6及TNF-α等的表达,下调NF-κB,发挥较强的抗炎作用[3],有望成为防治银屑病的新型化合物。但是由于白藜芦醇水溶性差,化学性质不稳定易被氧化分解,导致传统口服等给药方式药物难吸收,体内生物利用度低限制了其临床应用[4-5]。本次实验在前期研究基础上[6],以自主合成的维生素E琥珀酸酯(vitamin E succinate,VES)-接枝-(ε-多聚赖氨酸,polylysine,PLL)(VES-g-PLL)聚合物为膜材制备包载白藜芦醇的纳米粒,提高药物稳定性、水溶性,改善其皮肤穿透性,继以丝素凝胶为基质分散纳米粒,延长药物在皮肤等局部组织的滞留时间,制备成白藜芦醇纳米粒-丝素凝胶,通过苏木精-伊红 (Hematoxylin-Eosin,HE)染色法、 马松染色(Massom)及免疫组化染色等综合考察载药纳米粒联合丝素凝胶对于小鼠银屑病的治疗效果。
1 材料与方法
1.1实验动物 健康雄性BALB/c小鼠60只(8~11周)购自温州医科大学实验动物中心。实验动物生产许可证号:SYXK(浙)2015-0001,合格证号:wydw2013-0050。饲养环境:温度(22±2)℃,相对湿度50%~60%,12 h循环照明的环境中适应性饲养7 d,自由摄食和饮水。
1.2药品与试剂 白藜芦醇(购自阿拉丁,含量≥99%,批号:36794)、维生素E琥珀酸酯-接枝-(ε-多聚赖氨酸)聚合物由实验室前期合成,咪喹莫特(imiquimod,IMQ),含量≥98%,购自3M Health Care Limited 公司(批号:H20160079),小鼠 TNF-α、IL-6 和 IL-8专用 ELISA 试剂盒(eBioscience 公司,批号分别为168235001,146735017和165536004)、HE染色试剂盒(北京益利精细化学品有限公司,批号:201560326)。
1.3仪器与设备 透射电镜(日本电子公司,型号JEM-1230)、粒径分析仪(美国Microtrac公司,型号S3500)、细胞破碎仪(SCIENTZ公司,型号:IID)、扫描电镜(美国FEI公司,型号:Nova Nano SEM 200)。
1.4实验方法
1.4.1白藜芦醇纳米粒的制备及其质量表征 称取适量白藜芦醇以及VES-g-PLL聚合物,预先共溶于一定体积二甲亚砜(DMSO)溶液中,在磁力搅拌(转数:1500 r·min-1)下,将上述DMSO溶液缓慢(15滴·min-1)滴入去离子水中自发组装,在室温、避光条件下搅拌过夜,将组装纳米粒转移至透析袋内,用纯化水透析、离心,除去未包裹的游离药物以及有机溶剂,制备白藜芦醇纳米粒(RSV-NPs)[7]。按照上述方法,不加白藜芦醇,制备空白纳米粒(Bk-NPs)。
透射电镜观察载药及空白纳米粒的微观形态,同时应用粒径分析仪测定平均粒径和Zeta电位。采用离心分离法测定载药纳米粒的包封率:取等量载药及空白纳米粒13 000 r·min-1离心10 min(r=10 cm),去除上清液,将沉淀用去离子水冲洗后晾干24 h。将载药纳米粒沉淀质量减去空白纳米粒沉淀质量即为载药纳米粒中包封的白藜芦醇质量。
包封率(%)=载药纳米粒中白藜芦醇量(测定方法详见上述包封率测定步骤)/白藜芦醇总量×100%。
1.4.2白藜芦醇纳米粒-丝素凝胶的制备及其质量表征 蚕茧(由西南大学蚕丝学实验室提供)先在1.5%碳酸钠溶液中煮沸30 min,然后用纯化水清洗去除杂质。洗净的丝素蛋白在9.3 mol·L-1溴化锂溶液60 ℃条件下充分溶解2 h。再把丝素蛋白溶液在透析袋中用纯化水透析72 h。最终得到的丝素蛋白溶液浓度约2%。取制备好的丝素蛋白溶液和RVS-NPs溶液按体积比1:1混合,然后用细胞破碎仪超声(功率20%)混合溶液1 min得到白藜芦醇纳米粒-丝素凝胶(RVS-NPs-gel)[8]。将RVS-NPs溶液换成等体积纯化水,按照上述步骤制备空白丝素凝胶。
扫描电镜观察空白及载药丝素凝胶的微观形态,同时测定RSV-NPs及RVS-NPs-gel的体外药物释放度:将1 mLRVS-NPs溶液或RVS-NPs-gel加入到透析袋中(截留分析量3500 Da)。然后将透析袋放入10 mL释放介质[0.5%聚山梨酯80,pH=7.4磷酸盐缓冲溶液(phosphate buffer solution,PBS)]中,在37 ℃,120 r·min-1搅拌条件下进行释放试验。分别于1,3,6,9,12,18,24,30,36,42,54,66及78 h抽取定量释放介质,及时补充空白释放介质。
采用高效液相色谱(HPLC)法测定释放介质中白藜芦醇的浓度,色谱条件为:Agilent XDB C18色谱柱(4.6 mm×250 mm,5 μm)(安捷伦公司,美国),甲醇-水(60:40),流速1 mL·min-1,检测波长为306 nm,进样量20 μL,以峰面积定量。以上述释放介质为溶剂系统溶解白藜芦醇对照品,作标准曲线。
1.4.3白藜芦醇纳米粒-丝素凝胶的在体药物透皮实验 取健康雄性BALB/c小鼠10只,采用随机数字表法随机分成两组,除去背部皮肤上的毛发,选取1 cm2均匀涂抹白藜芦醇溶液丝素凝胶或RVS-NPs-gel(20 mg RVS)。于48 h后处死小鼠,剥离背部皮肤后,用0.9%氯化钠注射液反复冲洗干净,冰冻切片,厚度5 μm,苯基吲哚染色(DAPI)7 min后激光共聚焦显微镜下观察载药纳米胶束的皮肤渗透深度。
1.4.4白藜芦醇纳米粒联合丝素凝胶在体治疗小鼠银屑的实验研究
①银屑病皮肤模型的建立。另取上述健康BALB/c小鼠60只,采用随机数字表法选取小鼠15只作为正常对照组,另外45只正常小鼠参考文献[9]建模方法,建立小鼠银屑病皮肤模型,将实验组小鼠背部剃毛后固定选取皮肤面积2 cm×3 cm,每天涂抹5%IMQ乳膏剂量为60.5 mg,每天1次,连续用药8 d,以小鼠后背皮肤出现鳞屑及红斑为造模成功,正常对照组小鼠每天给予同等剂量凡士林,用法同造模组。
②实验分组及治疗药物干预。将上述造模成功后小鼠45只采用随机数字表法随机分成银屑病对照组、白藜芦醇溶液丝素凝胶组(RVS-gel组)、白藜芦醇纳米粒丝素凝胶(RVS-NPs-gel组),每组15只,分别接受相应形式的药物治疗,RVS-gel组及RVS-NPs-gel组小鼠分别给予RVS-gel及RVS-NPs-gel包含白藜芦醇20 mg,涂抹于银屑病皮肤处,隔天1次,总共5次,银屑病对照组给予同等剂量空白丝素凝胶,正常对照组小鼠给予同等剂量PBS。
③小鼠背部银屑病皮肤表型观测及评分。借鉴临床PASI评分标准[10]采用盲法对各组小鼠进行银屑病皮肤严重程度评估。评分内容包括:红斑、鳞屑及增厚。评分标准如下:0:无现象;1:轻微;2:中度;3:显著;4:十分显著。药物干预后开始评分,每天1次,总共进行10 d。
④HE染色实验。10 d之后,处死小鼠,取部分背部皮肤用甲醛固定后进行包埋切片、按照HE染色标准步骤行(试剂盒说明书)皮肤组织HE染色,考察各组药物干预结束后小鼠表皮细胞、炎症细胞及肉芽组织新生情况,剩余背部皮肤组织用于后续检测。
⑤酶联免疫法测定(ELISA)检测。取上述各组剩余皮肤组织1 cm2,加入PBS充分混匀,制成20%匀浆液,离心(2000 r·min-1,15 min)后取上清液,按试剂盒说明书进行操作,采用ELISA检测各组小鼠皮肤组织中TNF-α、IL-6和IL-8含量。

2 结果
2.1白藜芦醇纳米粒的质量表征 空白及载药纳米粒形态圆整,载药前后形态无明显变化,粒径及Zeta电位检测显示,空白及载药纳米粒粒径分别为(45.21±4.37)和(52.71±6.12)nm,Zeta电位分别为(21.41±2.34)及(17.53±1.43)mV,均大于15 mV,说明本次实验制备的空白及载药纳米粒稳定性好。本次实验制备的载药纳米粒的包封率高达(85.54±3.21)%,说明应用VES-g-PLL聚合物制备的新型纳米粒能够对难溶性药物白藜芦醇实现高包封。见图1。
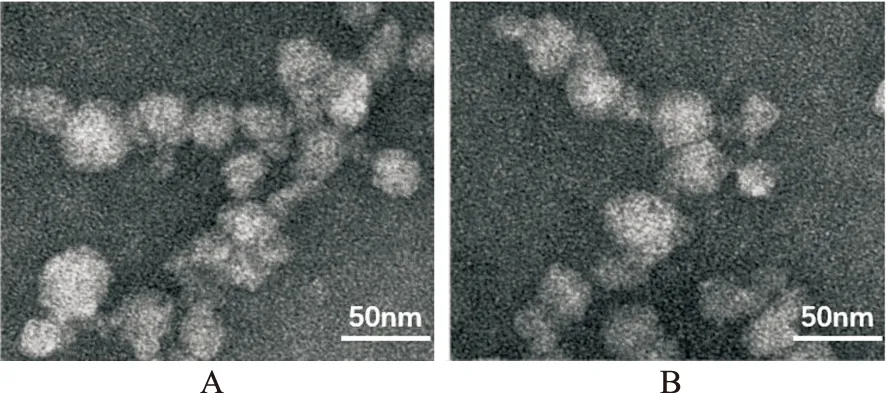
A.空白纳米粒;B.包载白藜芦醇纳米粒。
A.blank nanoparticles; B.RVS-loaded nanoparticles.
Fig.1Blankanddrug-loadednanoparticlesdetectedbytransmissionelectronmicroscopy
2.2白藜芦醇纳米粒-丝素凝胶的质量表征 空白丝素凝胶的内部主要以海绵样片状结构进行互相连接,形成3D网状结构,为载药纳米粒的着床及释药提供骨架结构。而载药纳米粒丝素凝胶的扫描电镜结果显示,载药纳米粒如絮状物一般吸附在海绵样3D网状结构的表面,从而用于银屑病的治疗。见图2。
白藜芦醇纳米粒丝素凝胶和白藜芦醇溶液丝素凝胶都没有明显的突释现象,同时在pH值=7.4的PBS中,72 h后只(30.9±2.5)%的药物从纳米粒-丝素凝胶释放,而(46.0±4.1)%的药物从白藜芦醇溶液丝素凝胶释放,说明相比于单纯的丝素凝胶,应用纳米粒结合丝素凝胶能够更好地实现难溶性药物的缓释作用,延长药物在靶部位的作用时间。见图3。
2.3白藜芦醇纳米粒-丝素凝胶的在体药物透皮实验 在激光共聚焦显微镜下白藜芦醇显绿色荧光而细胞核显蓝色荧光。见图4。结果证实:应用白藜芦醇溶液丝素凝胶干预48 h后大部分的白藜芦醇还是停留在皮肤表面的角质层,而应用载药纳米粒丝素凝胶48 h后,皮肤组织的所有层面包括角质层、上皮层及真皮层都分布有绿色荧光,说明应用载药纳米粒丝素凝胶能够增加药物穿透皮肤的能力,增加药物的治疗效果。

A.空白丝素凝胶;B.白藜芦醇纳米粒-丝素纳米凝胶。
图2 扫描电镜观察空白丝素凝胶及载药纳米粒-丝素凝胶
A.blank NPs-gel;B.RVS-NPs-gel.
Fig.2BlankandRVS-NPsloadedgeldetectedbyscanningelectronmicroscope
2.4PASI评分评价各组小鼠药物干预结束后的银屑病治疗效果 如图5A所示,连续用IMQ乳膏8 d后,小鼠背部皮肤出现明显的胶质细胞增殖分化、红斑等银屑病典型症状,说明本次实验银屑病小鼠皮肤模型造模成功。图5B为各组小鼠药物治疗干预后的病变部位皮肤组织的PASI评分,结果包括:皮肤红斑、鳞屑及厚度。结果显示,药物开始治疗前(银屑病造模结束后),银屑病模型组小鼠的各项PASI评分包括红斑、鳞屑及厚度评分分别为(3.57±0.19),(3.63±0.16)和(3.71±0.13)分,较正常对照组小鼠的各项指标显著升高(均P<0.05),进一步说明银屑病小鼠模型造模成功。药物治疗开始后,RVS-gel治疗的小鼠较RVS-NPs-gel治疗组小鼠各项PASI评分下降更快,而药物治疗10 d结束后,应用RVS-NPs-gel治疗组的各项PASI评分包括较RVS-gel显著下降,红斑、鳞屑及厚度评分分别为(1.02±0.15),(1.09±0.1),(1.12±0.2)比(2.17±0.13),(2.06±0.11),(2.08±0.14)分,均(P<0.05)。

图3 白藜芦醇不同载药形式的体外释放度测定
Fig.3Determinationoninvitroreleaseofresveratrolindifferentdrugloadingforms

图4 RVS-NPs丝素凝胶及RVS溶液丝素凝胶的在体皮肤渗透结果

A.RVS干预IMQ乳膏诱导银屑病小鼠的治疗效果图。B.4组小鼠RVS干预后的PASI评分。与正常对照组比较,*1P<0.05,与RVS-NPs-gel组比较,*2P<0.05。

A.Images of therapeutic effect of RVS on IMQ cream-induced psoriasis mice.B.PASI scores of four groups of mice after RVS treatment.Compared with normal control group,*1P<0.05; compared with the RVS-NPs-gel group,*2P<0.05.


A.正常对照组;B.银屑病对照组;C.RVS-gel治疗干预组;D.RVS-NPs-gel治疗干预组。
2.5HE染色评级各组小鼠银屑病药物治疗效果 各组小鼠药物干预结束后(10 d之后)皮肤组织HE染色结果如图6所示:与正常对照组比较,银屑病对照组小鼠皮肤厚度明显增加,同时角质化细胞异常增殖及分化,出现明显的角质化不全及角化过度等典型银屑病症状,而经过不同形式药物干预后,银屑病小鼠皮肤的病理出现明显改善,特别经过RVS-NPs-gel干预组小鼠的皮肤表皮厚度较银屑病对照组及RVS-gel治疗干预组明显变薄,皮肤未见明显角质化不全及角质化过度等银屑病病理特征。
2.6皮肤组织TNF-α、IL-6和IL-8的含量测定 如表1所示:相比于正常对照组,银屑病模型组小鼠的皮肤组织TNF-α、IL-6和IL-8含量显著升高(P<0.05),而相比于银屑病模型组及RVS-gel治疗干预组,应用RVS-NPs-gel治疗干预组小鼠皮肤组织的TNF-α、IL-6和IL-8含量显著下降(P<0.05)。
3 讨论
相比于传统的药物制剂,纳米药物载体在递送药物至表皮、真皮提高治疗部位药物浓度、减小全身毒副作用方面,具有明显的优势[11]。在众多纳米载体中,纳米粒因具有较小的粒径和功能多样性等优势,具有提高难溶性药物溶解度、增加药物穿透致密皮肤的能力[12]。本次实验应用自主合成的两亲性新材料维生素 E 琥珀酸酯-接枝-ε-多聚赖氨酸(VES-g-PLL)为膜材制备包载难溶性药物白藜芦醇的纳米粒,从纳米粒的质量考察结果可知,载药纳米粒的微观形态圆整,Zeta电位(21.41±2.34) mV,包封率高达(85.54±3.21)%,说明载药纳米粒能够达到对于难溶性药物白藜芦醇的高包封,提高药物的溶解度。
表1 4组小鼠皮肤组织TNF-α、IL-6和IL-8的含量比较


组别TNF-αIL-6IL-8正常对照组20.21±1.452.41±0.324.61±0.43银屑病对照组36.59±2.96∗1∗2 5.14±0.41∗1∗27.87±1.67∗1∗2RVS-gel组28.41±1.21∗23.47±0.21∗26.12±1.31∗2RVS-NPs-gel组21.35±0.872.63±0.225.12±0.56
与正常对照组比较,*1P<0.05,与RVS-NPs-gel组比较,*2P<0.05。
Compared with normal control group,*1P<0.05; compared with RVS-NPs-gel group,*2P<0.05.
另外,为了进一步增加载药纳米粒在皮肤组织的停留时间,延长药物的疗效,本次实验还应用天然蚕丝提取物丝素作为凝胶基质制备白藜芦醇纳米粒-丝素水凝胶。体外药物释放及在体的透皮实验结果显示,相比于白藜芦醇溶液凝胶,应用载药纳米粒联合丝素凝胶能够明显减缓药物的释放速度(P<0.05),同时增加药物的皮肤穿透性能。其原因一方面可能是丝素水凝胶带负电可用于带正电的载药纳米粒的吸附,实现载药纳米粒的缓释作用,同时纳米粒又能增加药物的皮肤穿透性能。因此,应用载药纳米粒联合丝素凝胶能够在增加药物的皮肤渗透性能的同时实现药物的缓释效果,进一步延长药物的疗效。
为了验证载药纳米粒联合丝素凝胶对于银屑病的治疗效果,本次实验应用IMQ皮肤刺激建立小鼠银屑病模型,同时采用经典的PASI评分及HE染色进行各组治疗效果评价。结果显示:药物干预10 d结束后,银屑病模型组小鼠皮肤表皮增厚,角质化细胞增殖明显,PASI的各项评分较正常对照组明显升高(均P<0.05),而经过载药纳米粒联合丝素凝胶治疗组小鼠的皮肤组织病理结构明显改善,各项PASI评分较银屑病对照组及白藜芦醇溶液凝胶组显著下降(均P<0.05),说明应用载药纳米粒联合丝素凝胶较单纯药物溶液凝胶具有更好的银屑病的治疗效果。另外,本次实验还应用ELISA测定了促炎症细胞因子TNF-α、IL-6和IL-8的浓度[13-14]考察载药纳米粒联合丝素凝胶治疗银屑病的机制。结果显示:银屑病对照组与正常对照组小鼠皮损组织TNF-α、IL-6和IL-8含量具有显著差异(P<0.05)。而经过载药纳米粒联合丝素凝胶治疗之后小鼠皮损组织TNF-α、IL-6和IL-8含量较银屑病对照组及白藜芦醇溶液凝胶对照组显著下降(P<0.05),说明白藜芦醇能够通过抑制炎症因子的表达从而发挥治疗银屑病的作用。
综上所述,本次实验通过应用自主合成的新材料VES-g-PLL制备包载难溶性药物白藜芦醇的载药纳米粒联合丝素凝胶能够通过抑制TNF-α、IL-6和IL-8等炎症因子的表达,发挥治疗银屑病的作用,有望为临床防治银屑病提供新的方法及途径。

