罗格列酮对哮喘小鼠气道炎症因子及MUC5ac蛋白表达水平的影响*
杨红霞,张建勇,赵建军,陈玲,郑飞彦,毕海,张红
(遵义医学院附属医院呼吸二科,遵义 563003)
支气管哮喘(简称哮喘)是呼吸系统常见病和多发病之一,气道慢性炎症、气道重塑、气道黏液高分泌及气道高反应性为其主要特征[1]。其中气道黏液高分泌可阻塞气道,从而使气道处于高反应状态,同时可加重呼吸困难和引起呼吸道感染,增加哮喘发病率和死亡率。气道黏液高分泌的主要机制为气道上皮杯状细胞增生及产生的黏蛋白高表达,而黏蛋白MUC5ac过度表达被认为是气道上皮杯状细胞增生及高分泌的标志[2],因此气道MUC5ac表达水平可一定程度反映气道黏液高分泌的强度。罗炜等[3]报道,MUC5ac的表达与炎症因子白细胞介素(IL)-5、IL-13及肿瘤坏死因子(TNF)-α密切相关。罗格列酮是高选择性过氧化物酶体增殖活化受体γ(peroxidosome proliferation activates receptor gamma,PPAR-γ)的外源性强力配体激动剂,具有调控炎症反应因子的作用[4]。目前关于罗格列酮灌胃对哮喘小鼠气道炎症因子及MUC5ac表达水平的影响的研究较少,笔者在本研究中探讨罗格列酮对哮喘气道黏液高分泌的治疗作用及作用机制。
1 材料与方法
1.1材料
1.1.1实验动物 雄性BALB/c小鼠30只,购自上海斯莱克实验动物中心,实验动物合格证号:SCXK(沪)2011-0005,体质量(18±2) g,6~8周龄。饲养条件:湿度40%~70%,室温22~25 ℃,清洁级环境,自由饮水,无卵蛋白(ovalbumin,OVA)进食。清楚小鼠免疫遗传背景,个体之间差异较小,对OVA的反应稳定,可速发相哮喘及迟发相哮喘反应,适合过敏性哮喘动物模型的制作。动物实验在遵义医学院药理实验室完成,经遵义医学院动物实验委员会批准,实验设计符合有关动物保护原则、实验动物福利等伦理要求。
1.1.2试剂 鸡卵清白蛋白(Ⅴ级,美国Sigma公司),氢氧化铝凝胶(美国Sigma公司),罗格列酮片(天津葛兰素史克有限公司),阿尔新蓝-碘酸雪夫(Alxin blue -periodie acid Schiff,AB-PAS)染色试剂盒 (上海源叶生物科技有限公司),IL-5试剂盒(美国BioLegend公司),IL-13、TNF-α试剂盒(上海邦奕生物科技有限公司),小鼠抗小鼠-MUC5ac单克隆抗体(英国abcam公司),免疫组化通用型二步法检测试剂盒(北京中杉生物技术有限公司),RNAiso Reagent、实时荧光定量(RT-PCR)试剂盒、RT-PCR引物(MUC5ac、TSLP、β-actin,大连TaKaRa公司)。
1.1.3仪器 压缩雾化器L2160003(德国PARI公司),电子分析天平(德国赛多利思公司,感量:0.1 mg),高速冷冻离心机(美国贝克曼公司),Multiskan spectrum酶标仪(美国Thermo scientific公司),光学显微镜(日本NIKON公司),核酸蛋白测量仪ND-1000(美国Nanodrop公司),Icycler iQ5荧光定量PCR仪(美国Bio-Rad公司)。
1.2方法
1.2.1动物分级与模型制备 30只小鼠随机分为正常对照组、哮喘组和罗格列酮组,各10只。正常对照组小鼠分别于第1和第13天腹腔注射0.9%氯化钠溶液0.2 mL,第19天起连续5 d每天超声雾化吸入0.9%氯化钠溶液8 mL,每天30 min,至第24天,无小鼠死亡。哮喘组和罗格列酮组分别于第1和第13天各腹腔注射致敏液0.2 mL(含OVA 60 μg和氢氧化铝凝胶2.25 mg)致敏,第19天起连续5 d超声雾化吸入OVA溶液(浓度为5%)8 mL激发,每天30 min,至第24天,共计20只小鼠成功构建哮喘模型,无小鼠死亡。
1.2.2给药方法 罗格列酮组于第17天起每天给予小鼠罗格列酮片5 mg·kg-1(纯化水溶解后1 mL)灌胃1次,第19天起给药时间定于每次雾化激发前30 min,共连续灌胃7 d。正常对照组和哮喘组采用等剂量0.9%氯化钠溶液1 mL灌胃。
1.2.3标本采集 小鼠于末次激发24 h后予以麻醉、固定并处死,开胸取右肺组织,其中右上叶和中叶肺组织置入EP管,保存于-70 ℃ 冰箱用于RNA提取,取右下叶肺组织放入多聚甲醛(浓度为4%)固定24 h,常规漂洗脱水,石蜡包埋,切片。颈部气管充分暴露,作“V”型切口将留置针插入气管,缓慢注入0.9%氯化钠溶液0.3 mL于肺内,回抽灌洗液,灌洗3次,收集支气管肺泡灌洗液(BALF)且置于EP管(高压灭菌),离心,上清液保存于-80 ℃冰箱。
1.2.4肺组织病理学检查及病理图像分析 制备肺组织切片,根据试剂盒说明书行HE、AB-PAS染色,在普通光学显微镜下观察。参照HENDERSON等[5]方法进行支气管周围炎症细胞浸润评分,判断标准:①无炎症细胞(0分);②少许炎症细胞(1分);③较多分布不均炎症细胞(2分);④大量炎症细胞,分布较均匀,少见聚集成团(3分);⑤大量炎症细胞聚集成团(4分);由两位病理科医生进行盲法阅片,每组测定≥25个气道。AB-PAS染色:酸性黏液物质或细胞呈蓝色,中性黏液物质或细胞呈红色,混合黏液物质或细胞呈紫红色,使用图象分析软件测量气道杯状细胞和黏液物质阳性相对着色面积。
1.2.5采用酶联免疫吸附(ELISA)法检测IL-5、IL-13及TNF-α水平 按试剂盒说明操作,用酶标仪在490 nm处读取吸光度值,计算BALF中IL-5、IL-13及TNF-α的浓度。
1.2.6采用免疫组化(immunohistochemical,IHC)测定肺组织MUC5ac蛋白含量 常规脱蜡、水化,采用过氧化氢(浓度为3%)将内源性氧化酶去除,高压修复抗原,其余操作严格按试剂盒说明书进行。阳性对照:已知阳性片,阴性对照:PBS代替一抗。MUC5ac黏蛋白单克隆抗体稀释浓度为1:100。高倍镜下,IHC染色呈棕黄色染色为阳性细胞。
1.2.7RT-PCR检测小鼠肺组织MUC5ac mRNA水平 采用大连TaKaRa公司的Trizol试剂提取小鼠肺组织中的RNA,将mRNA逆转录成cDNA,以此为模板行RT-PCR扩增。设置MUC5ac mRNA引物序列:上游引物:5′- AATGGCGAGTCTGTGCAGGA-3′,下游引物:5′-CACCAGGTGTGGCATTGTGA -3′,扩增产物139 bp,β-actin上游引物:5′-CATCCGTAAAGACCTCTATGCCA AC-3′,下游引物:5′-ATGGAGCCACCGATCC ACA -3′,扩增产物171 bp。每一样本反应结束后由计算机自动计算并读出定量结果Ct值(threshold cycle)。采用2-△△Ct法计算Muc5ac mRNA(△Ct=Ctβ-actin-Ct Muc5ac)的相对表达量。

2 结果
2.1各组小鼠支气管周围炎症病理评分比较 正常对照组、哮喘组和罗格列酮组小鼠支气管周围炎症病理评分分别为(0.24±0.44),(3.12±0.67)和(1.72±0.68)分(气道数n=25),罗格列酮组小鼠支气管周围炎症病理评分较哮喘组降低,但仍高于正常对照组(F=135.540,P<0.01)。
2.2各组小鼠气道上皮杯状细胞和黏液物质AB-PAS染色结果 正常对照组、哮喘组和罗格列酮组AB-PAS染色阳性相对着色面积分别为(0.51±0.41)%,(12.41±4.69)%和(4.25±1.88)%(F=38.912,P<0.01)。在正常对照组小鼠气道组织中极少观察到杯状细胞,黏液分泌较少;哮喘组小鼠染色后出现大量杯状细胞,黏液大量分泌,其相对着色面积较正常对照组升高(t=6.146,P<0.01);罗格列酮组气道上皮杯状细胞和黏液物质相对着色面积较哮喘组降低(t=5.107,P<0.01),见图1。
2.3各组小鼠BALF中炎症因子水平比较 罗格列酮组小鼠BALF中IL-5、IL-13及TNF-α水平较哮喘组降低,但仍然高于正常对照组(F=863.466,57.324,42.335,P<0.01)。见表1。
2.4各组小鼠肺组织MUC5ac蛋白和MUC5acmRNA含量比较 IHC染色显示MUC5ac蛋白阳性表达主要在气道上皮杯状细胞及管腔内;罗格列酮组小鼠肺组织MUC5ac蛋白和mRNA含量较哮喘组降低,但仍高于正常对照组(F=327.786,129.086,P<0.01)。见表2和图2。
3 讨论
哮喘的临床常见症状为喘息、气促、胸闷、咳嗽,其发生的病理学基础为肺组织病理学变化[6]。小鼠的哮喘症状主要表现为呼吸急促、焦躁不安、抓鼻、腹肌痉挛等异常行为[7]。本研究通过OVA致敏成功建立哮喘BALB/c小鼠模型,小鼠出现呼吸急促、呼吸异常等哮喘症状,同时可见挠痒、抓鼻等过敏症状。在OVA激发时给予小鼠罗格列酮灌胃,哮喘小鼠未发生明显的哮喘症状。肺组织病理学结果显示,罗格列酮组小鼠支气管周围炎症病理评分较哮喘组降低,但仍高于正常对照组。提示罗格列酮可改善哮喘BALB/c小鼠的肺组织病理状况。
哮喘是多种炎症因子参与的气道慢性炎症疾病,其关键的效应细胞为嗜酸性粒细胞(eosinophile granulocyte,EOS)和T淋巴细胞[8]。正常情况下,Th1/Th2免疫应答处于平衡状态,而支气管哮喘患者Th1/Th2免疫应答失衡,导致炎症因子IL-5、IL-13过度产生。IL-5是调节EOS功能最重要的细胞因子,其参与EOS活化、成熟、存活和募集至气道的整个过程[9]。本研究发现哮喘组小鼠BALF中IL-5水平显著高于正常对照组,胡志红等[10]研究发现IL-5水平上调,嗜酸粒细胞阳离子蛋白(eosinophil cationic protein,ECP)水平也随之升高。由此说明,IL-5水平升高可作为反映哮喘发作的重要指标。IL-13对嗜酸粒细胞趋化因子的合成具有上调作用,而嗜酸粒细胞趋化因子能激活EOS并诱导其聚集于炎症部位[11]。此外,IL-13能诱导气道黏蛋白MUC5ac及其mRNA的表达[12],从而诱导呼吸道杯状细胞增生和黏液过度分泌。本实验发现哮喘组小鼠BALF中IL-13水平显著高于正常对照组,说明IL-13升高对哮喘发作可能发挥一定作用。炎症反应时巨噬细胞分泌的TNF-α能够通过损伤血管内皮细胞,诱发凝血过程,促进巨噬细胞的黏附作用,并且能促进血管平滑肌细胞增殖。大量研究证明[13-14],哮喘发作时患者体内TNF-α的表达水平显著上升,在哮喘发作过程中发挥重要作用,王梦航等[15]研究发现TNF-α具有间接促进黏蛋白MUC5ac分泌的作用,从而加重哮喘症状。本实验发现哮喘组小鼠BALF中TNF-α水平显著高于正常对照组,说明TNF-α水平与哮喘的发生发展密切相关。气道杯状细胞增生及黏蛋白高表达导致的黏液高分泌是哮喘的重要特征之一。哮喘发作时杯状细胞增生从而大量产生和分泌黏液,其较高的黏滞性严重阻塞气道,加重哮喘及肺功能急剧下降[16]。MUC5ac被认为是气道杯状细胞增生的标志,本研究发现喘组小鼠肺组织中MUC5ac表达水平显著高于正常对照组。王艳杰等[17]研究报道黏蛋白MUC5ac在哮喘发作时高表达,与本研究结果一致。说明小鼠肺组织中MUC5ac表达水平上调在气道炎症和气道黏液高分泌中发挥重要作用。
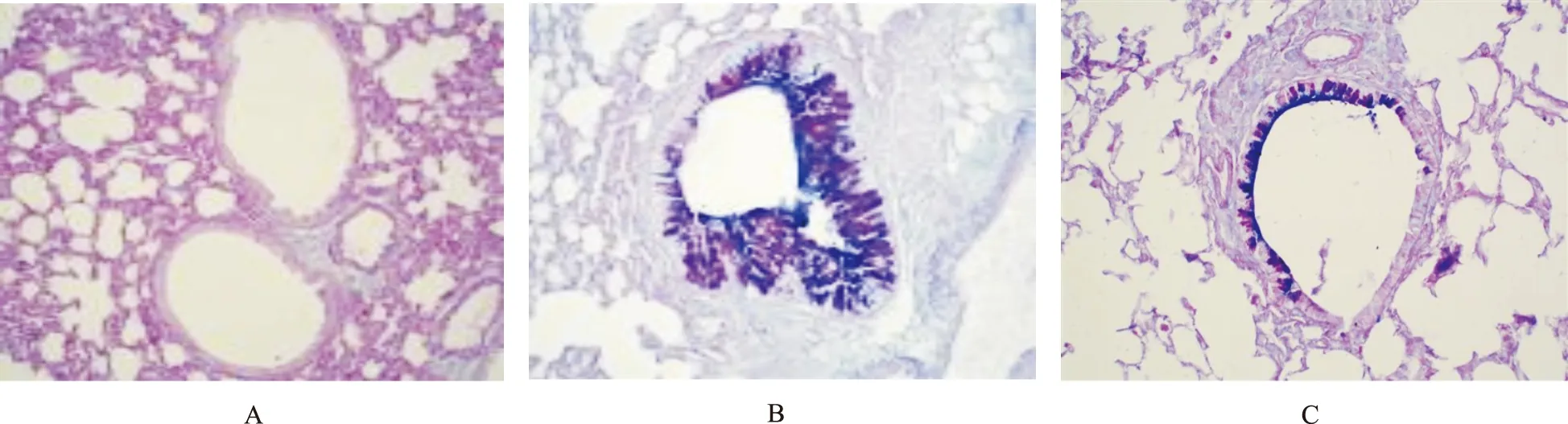
A.正常对照组; B.哮喘组;C.罗格列酮组。
表1 3组小鼠BALF中炎症因子水平比较

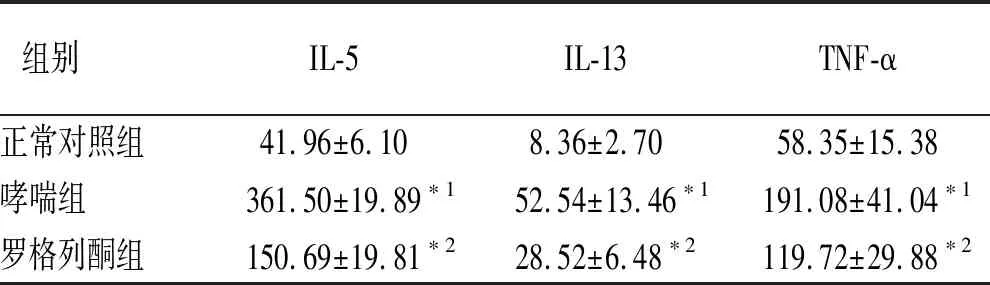
组别IL-5IL-13TNF-α正常对照组41.96±6.108.36±2.7058.35±15.38哮喘组361.50±19.89∗152.54±13.46∗1191.08±41.04∗1罗格列酮组150.69±19.81∗228.52±6.48∗2119.72±29.88∗2
与正常对照组比较,*1P<0.01;与哮喘组比较,*2P<0.01。
Compared with normal control group,*1P<0.01; compared with asthma group,*2P<0.01.
表2 3组小鼠肺组织MUC5ac蛋白和mRNA含量的比较

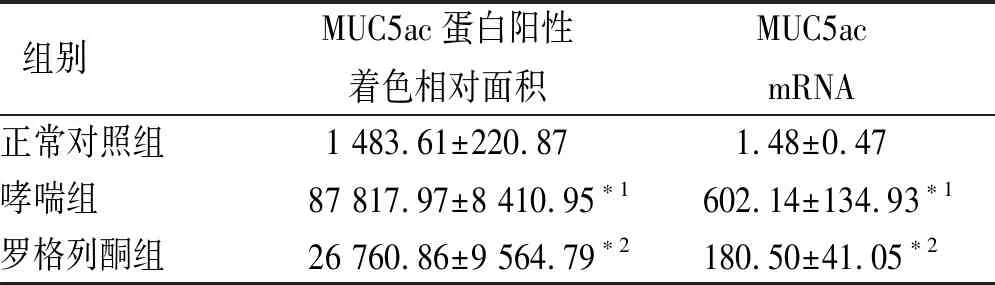
组别MUC5ac蛋白阳性着色相对面积MUC5ac mRNA正常对照组1 483.61±220.871.48±0.47哮喘组87 817.97±8 410.95∗1602.14±134.93∗1罗格列酮组26 760.86±9 564.79∗2180.50±41.05∗2
与正常对照组比较,*1P<0.01;与哮喘组比较,*2P<0.01。
Compared with normal control group,*1P<0.01; compared with asthma group,*2P<0.01.
PPAR-γ是一类核激素受体,主要在肺组织气道平滑肌细胞、内皮细胞及上皮细胞表达,受配体激动剂激活后可发挥生理效应[18]:降低哮喘小鼠气道高反应性和Th2细胞因子、IgE水平表达、减少黏蛋白分泌等。罗格列酮是PPAR-γ高选择性的外源性强力配体激动剂,可显著减轻哮喘小鼠过敏性炎症反应。本实验发现,罗格列酮组小鼠BALF中IL-5、IL-13及TNF-α水平,气道上皮杯状细胞和黏液物质相对着色面积及肺组织MUC5ac蛋白和mRNA含量较哮喘组降低,提示罗格列酮可有效减少哮喘小鼠IL-5、IL-13及TNF-α水平表达和肺组织MUC5ac蛋白和mRNA含量。
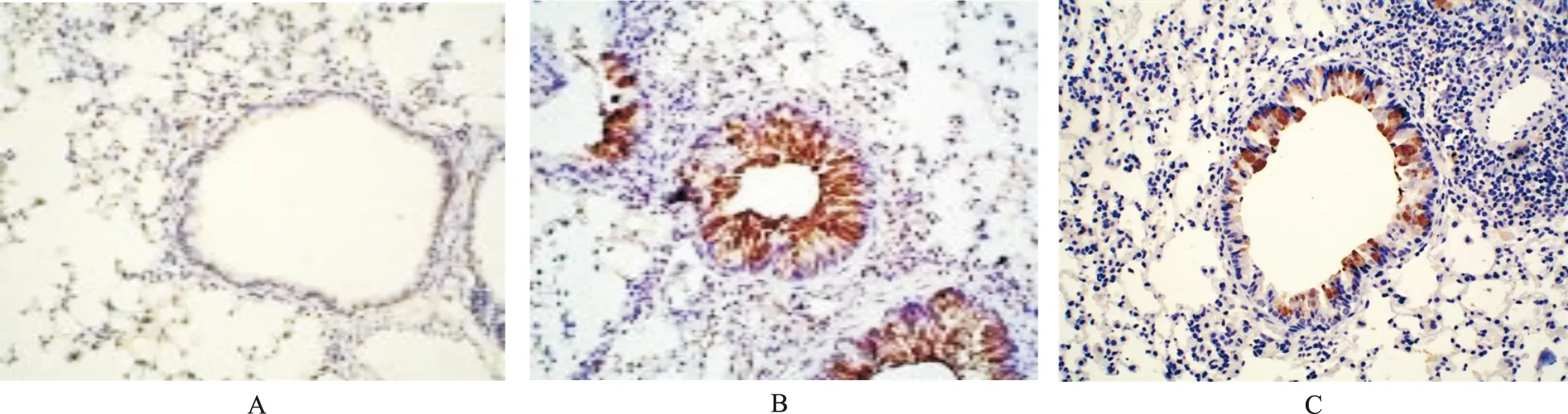
A.正常对照组; B.哮喘组 ;C.罗格列酮组。
综上所述,罗格列酮可有效减轻哮喘小鼠气道炎症反应,调节气道黏蛋白MUC5ac的表达,抑制气道黏液高分泌。

