干扰MDM4基因对卵巢癌细胞顺铂耐药性的影响
张 靖,杨 茹,白惠娟
郑州大学附属肿瘤医院(河南省肿瘤医院)妇瘤科 郑州 450008
卵巢癌是常见的妇科恶性肿瘤,临床数据[1]显示,约80%的卵巢癌患者预后不良,表现出铂类耐药,导致化疗效果不理想。鼠双微体(murine doubleminute,MDM)4基因位于人类染色体1q32,其编码的蛋白质在结构上与MDM2蛋白高度同源[2]。多种恶性肿瘤的发生与MDM4基因异常表达密切相关[3]。研究[4]发现MDM4基因在肿瘤化疗耐药中同样发挥重要作用。Pellegrino等[5]的研究显示,MDM4通过介导PI3K/AKT途径参与肝细胞癌的发病和进展。还有研究[6-7]表明,PI3K/AKT途径的异常激活参与顺铂(DDP)耐药。本实验通过沉默MDM4在卵巢癌DDP耐药细胞A2780/DDP中的表达,观察细胞对DDP耐药性及PI3K/AKT信号通路的变化,为进一步阐明卵巢癌DDP耐药的分子机制奠定理论基础。
1 材料与方法
1.1细胞及试剂卵巢癌细胞株SKOV3、A2780及其DDP耐药细胞株SKOV3/DDP、A2780/DDP均购自中国典型培养物保藏中心;DMEM培养基、胰蛋白酶购自美国Gibco公司;胎牛血清购自杭州四季青生物工程材料有限公司;BCA蛋白检测试剂盒购自上海生工生物工程有限公司;t-PI3K、p-PI3K、t-AKT、p-AKT、MDM4单抗及IgG二抗均购自美国CST公司;RNA提取试剂盒及反转录试剂盒均购自北京康为世纪生物科技有限公司;蛋白裂解液购自上海碧云天生物技术研究所;ECL化学发光检测试剂盒购自北京中杉金桥生物技术有限公司;Lipofectamine2000、MDM4 siRNA购自美国Invitrogen公司;MTT购自美国Sigma公司。
1.2细胞培养和转染SKOV3、A2780及SKOV3/DDP、A2780/DDP细胞均培养于含体积分数10%胎牛血清、100 U/mL青霉素和100 g/L链霉素的DMEM培养基中,置37 ℃、体积分数5%CO2、相对湿度为90%的培养箱中培养,细胞贴壁生长至对数生长期,收集细胞用于后续实验。转染前1 d将A2780/DDP细胞用胰蛋白酶消化成单细胞悬液,接种于6孔板中,密度为3×105个/孔,加入不含抗生素、含体积分数10%胎牛血清的DMEM培养基培养过夜,待细胞生长至40%融合时,将特异性沉默MDM4基因的重组载体质粒pLKO.1-puro-GFP-siRNA-MDM4及阴性对照pLKO.1-puro-GFP-siRNA-NC(上海钰博生物科技有限公司)转染至A2780/DDP细胞,分别记为MDM4 siRNA组和阴性对照组,将未转染质粒的A2780/DDP细胞记为空白对照组。每组均3个复孔。
1.3qRT-PCR检测细胞中MDM4mRNA表达水平分别收集对数生长期的SKOV3、A2780、SKOV3/DDP和A2780/DDP细胞,用含0、10、20、40 μmol/L DDP的培养基培养48 h的A2780/DDP细胞,以及转染48 h后的3组A2780/DDP细胞,采用RNA提取试剂盒提取总RNA,以分光光度计测定RNA浓度和纯度,参照反转录试剂盒说明书合成cDNA,以cDNA为模板进行扩增, 反应体系20 μL,其中模板0.8 μL、上下游引物各1 μL、2×SYBR Green PCR Mix 10 μL,以ddH2O补足20 μL。反应条件:94 ℃ 5 min;94 ℃ 30 s,56 ℃ 30 s,72 ℃ 30 s,40个循环。MDM4上游引物:5’-ACGTTGGATGGA CAACTCAAGTCTAGACCC-3’;下游引物:5’-ACGT TGGATGTGTGTTACCTGTGGCAAGAC-3’。 内参GAPDH上游引物:5’-TGAACGGGAAGCTCACTGG-3’;下游引物:5’-TCCACCACCCTGTTGCTGTA-3’。采用2-ΔΔCt法计算MDM4 mRNA的相对表达量。实验重复3次。
1.4Western blot法检测细胞中MDM4、p-PI3K、t-PI3K、p-AKT和t-AKT蛋白表达水平分别收集对数生长期的SKOV3、A2780、SKOV3/DDP和A2780/DDP细胞,用含0、10、20、40 μmol/L DDP的培养基培养48 h的A2780/DDP细胞,以及转染48 h后的3组A2780/DDP细胞,加入蛋白裂解液,置冰上提取总蛋白。以BCA法检测蛋白浓度,将蛋白与加样缓冲液混匀,加热15 min使蛋白变性。取等量蛋白样品加入蛋白上样孔中,行SDS-PAGE电泳,电泳结束后电转至硝酸纤维素膜上,于含体积分数5%胎牛血清的封闭液中封闭1 h,加入相应的一抗,其中MDM4一抗1∶800稀释,p-PI3K、t-PI3K、p-AKT、t-AKT一抗均1∶1 000稀释,4 ℃孵育过夜。TBST洗膜3次后加入1∶3 000稀释的二抗,室温下孵育1.5 h,TBST洗膜3次,加入ECL化学发光液,显影,采用Quantity One软件测定蛋白条带灰度值,以目的蛋白与内参GAPDH条带灰度值的比值表示目的蛋白的相对表达量。实验重复3次。
1.5MTT法检测细胞生长抑制率及耐药性将3组A2780/DDP细胞用胰蛋白酶消化,制成单细胞悬液,分别接种于96孔板中,密度为1×104个/孔,置37 ℃培养箱常规培养24 h,分别加入含0(对照)、10、20、40 μmol/L DDP的培养基,继续培养48 h后将培养基更换为正常培养基,24 h后每孔加入5 g/L的MTT溶液20 μL,继续培养4 h,去上清液后,每孔加入二甲基亚砜溶液150 μL,置振荡仪上低速振荡反应10 min,在酶标仪上于490 nm波长处测定各孔吸光度(A),计算细胞增殖抑制率,增殖抑制率=(1-实验孔A/对照孔A)×100%。绘制生存曲线,计算DDP对各组细胞的IC50。实验重复3次。
1.6统计学处理采用SPSS 21.0进行数据分析。不同组间MDM4 mRNA和蛋白相对表达量,细胞增殖抑制率,p-PI3K、t-PI3K、p-AKT和t-AKT蛋白相对表达量的比较均采用单因素方差分析,两两比较采用SNK-q检验。检验水准α=0.05。
2 结果
2.1不同卵巢癌细胞中MDM4表达的比较SKOV3、A2780和SKOV3/DDP、A2780/DDP中MDM4的表达水平见图1和表1。可知,与卵巢癌细胞相比,卵巢癌DDP耐药细胞中MDM4 mRNA和蛋白表达水平升高,MDM4在A2780/DDP细胞中表达水平最高,故后续选择A2780/DDP细胞进行实验。

1:SKOV3;2:SKOV3/DDP;3:A2780;4:A2780/DDP
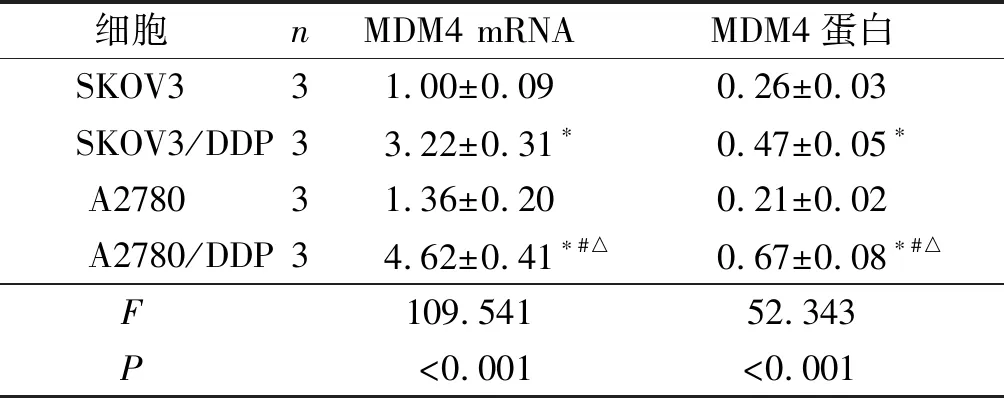
细胞nMDM4 mRNAMDM4蛋白SKOV331.00±0.090.26±0.03SKOV3/DDP33.22±0.31∗0.47±0.05∗A278031.36±0.200.21±0.02A2780/DDP34.62±0.41∗#△0.67±0.08∗#△F109.54152.343P<0.001<0.001
*:与SKOV3细胞比较,P<0.05;#:与A2780细胞比较,P<0.05;△:与SKOV3/DDP细胞比较,P<0.05
2.2不同剂量DDP作用后A2780/DDP细胞中MDM4表达的比较结果见图2和表2。随着DDP剂量的升高,A2780/DDP细胞中MDM4 mRNA和蛋白表达水平逐渐降低。
2.3沉默MDM4对A2780/DDP细胞中MDM4表达的影响结果见图3和表3。MDM4 siRNA组细胞中MDM4 mRNA和蛋白表达水平均低于空白对照组和阴性对照组。

1:0 μmol/L DDP;2:10 μmol/L DDP;3:20 μmol/L DDP;4:40 μmol/L DDP
图2不同剂量DDP作用后A2780/DDP细胞中MDM4蛋白的表达

表2 不同剂量DDP作用后A2780/DDP细胞中MDM4 mRNA和蛋白表达的比较
*:组间两两比较,P均<0.05

1:空白对照组;2:阴性对照组;3:MDM4 siRNA组

组别nMDM4 mRNAMDM4蛋白空白对照组31.01±0.100.68±0.07阴性对照组30.98±0.090.65±0.07MDM4 siRNA组30.22±0.03∗#0.16±0.02∗#F94.94275.206P<0.001<0.001
*:与空白对照组比较,P<0.05;#:与阴性对照组比较,P<0.05
2.4沉默MDM4对A2780/DDP细胞DDP耐药性的影响结果见表4。不同剂量DDP作用后,MDM4 siRNA组细胞增殖抑制率均高于其他两组。MDM4 siRNA组的IC50为(10.19±1.62) μmol/L,低于空白对照组的(29.20±3.53) μmol/L和阴性对照组的(25.92±3.28) μmol/L(F=107.882,P<0.001)。
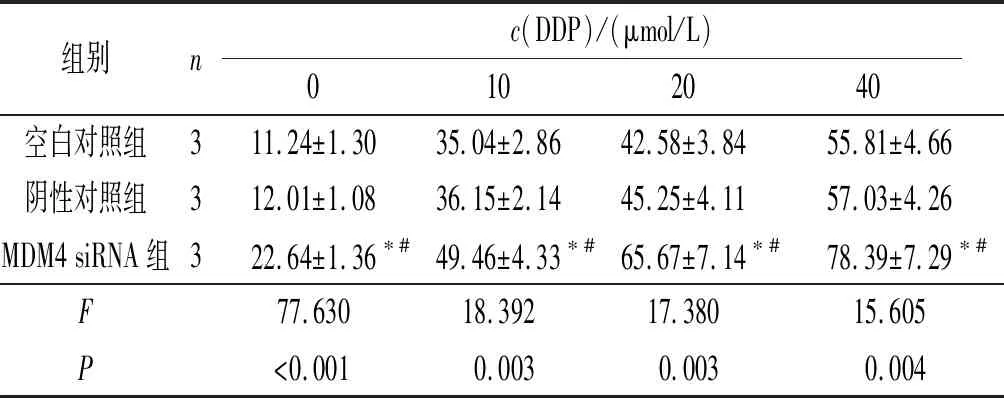
表4 不同剂量DDP作用后各组A2780/DDP细胞增殖抑制率的比较 %
*:与空白对照组比较,P<0.05;#:与阴性对照组比较,P<0.05
2.5沉默MDM4对A2780/DDP细胞PI3K/AKT信号通路的影响结果见图4和表5。MDM4 siRNA组中p-PI3K和p-AKT蛋白表达水平均低于其他两组。

1:空白对照组;2:阴性对照组;3:MDM4 siRNA组
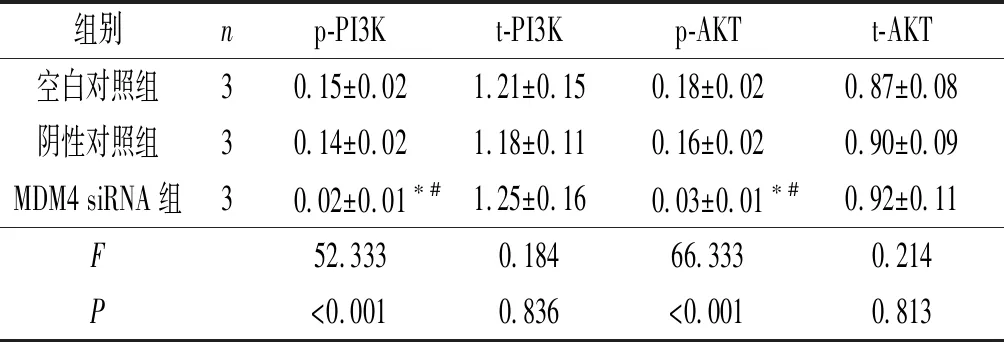
组别np-PI3Kt-PI3Kp-AKTt-AKT空白对照组30.15±0.021.21±0.150.18±0.020.87±0.08阴性对照组30.14±0.021.18±0.110.16±0.020.90±0.09MDM4 siRNA组30.02±0.01∗#1.25±0.160.03±0.01∗#0.92±0.11F52.3330.18466.3330.214P<0.0010.836<0.0010.813
*:与空白对照组比较,P<0.05;#:与阴性对照组比较,P<0.05
3 讨论
卵巢癌是一种发病率和病死率较高的妇科恶性肿瘤,晚期卵巢癌患者5 a生存率低于40%[8]。目前治疗晚期卵巢癌的主要方法是以铂类药物为基础的化疗,但多数患者对铂类化疗药物易产生耐药性,严重影响了化疗效果。MDM4基因在多种恶性肿瘤中呈高表达,参与肿瘤的发生发展[9]。该研究结果显示,MDM4在卵巢癌DDP耐药细胞株的表达水平明显升高;以不同剂量DDP干预A2780/DDP细胞,结果显示DDP干预后细胞中MDM4表达水平明显降低。将MDM4 siRNA转染到A2780/DDP细胞中,结果显示,沉默MDM4表达后A2780/DDP细胞增殖抑制率升高,DDP对A2780/DDP细胞的IC50降低,提示沉默MDM4基因能够降低A2780/DDP细胞对DDP的耐药性。Wang等[10]研究发现,miR-1307通过靶向MDM4调节细胞凋亡参与乳腺癌DDP耐药的发展。还有研究[11]显示,在DDP耐药的2780CP/Cl-16卵巢癌细胞中,p53(V172F)突变可促进MDM4募集,从而诱导DDP抗性。
PI3K/AKT信号通路与肿瘤化疗耐药密切相关。研究[12]显示,PI3K/AKT信号通路的活化与DDP、阿霉素等化疗药物的耐药密切相关。Yan等[13]发现,lncRNA HOTAIR通过靶向miR-126激活PI3K/AKT信号通路,促进胃癌DDP耐药。目前研究[14]已证实,PI3K/AKT信号通路的过度活化参与卵巢癌细胞DDP耐药性,抑制该通路能够明显降低DDP耐药性。AKT是PI3K/AKT信号通路的关键效应分子,p-AKT可激活下游靶基因表达,进而发挥生物学效应。本研究中发现,沉默MDM4后A2780/DDP细胞中p-PI3K和p-AKT蛋白表达水平显著下调,提示沉默MDM4能够抑制PI3K/AKT信号通路的激活。因此推测,沉默MDM4基因的表达可通过抑制PI3K/AKT信号通路而降低A2780/DDP细胞对DDP的耐药性。
总之,MDM4基因参与卵巢癌细胞对DDP耐药性,其作用机制可能与提高PI3K/AKT信号通路的活化水平有关。

