上调睾丸特异性Y样蛋白5的表达对LoVo细胞侵袭、迁移及STAT3蛋白表达的影响
付 强,张金岱,谢建国
河南省肿瘤医院(郑州大学附属肿瘤医院)普外科 郑州 450008
结直肠癌是常见的消化道肿瘤之一,随着我国人口老龄化及其他致癌因素的增加,结直肠癌的发病率呈上升趋势,严重威胁人们的生命健康[1]。肿瘤的侵袭及转移是引起结直肠癌患者复发死亡的一个主要原因。上皮细胞间质转化(epithelial mesenchymal transition,EMT)是上皮细胞在特定生理病理条件下向间质细胞转化的现象;已证实EMT与肿瘤侵袭、转移密切相关,是决定肿瘤侵袭和转移程度的一个关键因素[2]。多项研究[3-4]也表明,抑制EMT可降低结直肠癌细胞的侵袭及迁移能力。睾丸特异性Y样蛋白5(testis-specific Y-encoded-like protein 5,TSPYL5)是新发现的一种抑癌基因,属于TSPYL家族成员之一,定位于常染色体8q22.1,在人体正常组织表达广泛,而在肿瘤组织中表达下调[5]。有研究[6]表明,结肠癌组织中TSPYL5的表达低于癌旁正常黏膜,且其表达随TNM分期及浸润深度的增加而下调。STAT3是信号转导与转录激活因子(signal transducers and activators of transcription,STATs)家族成员之一,在多种肿瘤中异常活化,被称为癌基因,异常活化的STAT3信号通路可通过调控EMT促进结直肠癌细胞的侵袭和迁移能力[7]。本研究旨在观察上调TSPYL5的表达对结直肠癌LoVo细胞侵袭与迁移能力的影响,并进一步研究其对EMT相关蛋白及STAT3蛋白表达的影响。
1 材料与方法
1.1材料人结直肠癌LoVo细胞购自中科院上海细胞生物研究所细胞库。胎牛血清、RPMI 1640培养基、胰蛋白酶均购自美国Gibco公司,TSPYL5、E-cadherin、Vimentin、STAT3和p-STAT3抗体及HRP标记的羊抗鼠IgG均购自美国CST公司,Transwell小室购自美国Corning Costar公司,BCA试剂盒购自美国Thermo公司,STAT3信号通路抑制剂AG490购自美国Sigma公司,凝胶成像系统购自美国ProteinSimple公司。
1.2细胞培养LoVo细胞用含体积分数10%胎牛血清的RPMI 1640培养基,在体积分数5%CO2、饱和湿度、37 ℃恒温培养箱中培养。每隔2 d换液一次,细胞达70%~85%密度时用胰蛋白酶消化后传代。实验取处于对数生长期的细胞。
1.3细胞分组LoVo细胞分为空白1组、空载体组(转染pcDNA3.1质粒)和TSPYL5质粒组(转染pcDNA3.1-TSPYL5重组质粒,上海生工生物工程股份有限公司设计合成)。以2×105个/孔密度接种LoVo细胞于6孔板,于培养箱内常规培养,待细胞贴壁生长达70%融合时进行转染,转染参照Lipofectamine2000(美国Invitrogen公司)说明,依据预实验结果,每孔转染质粒4 μg,于转染48 h收集细胞,用于后续实验。
1.4细胞侵袭能力检测将120 μL的Matrigel胶(用2倍体积的无血清RPMI 1640稀释)铺在Transwell小室上室中,37 ℃、30 min后待胶凝固,将3组细胞密度调整为1×106个/mL,上室中每孔加入200 μL细胞悬液(约1×105个/孔),下室中加入500 μL含体积分数10%胎牛血清的培养液,37 ℃、体积分数5%CO2培养箱中常规培养,24 h后取出Transwell小室,吸弃上室液体,棉签轻轻拭掉Matrigel胶及未侵袭的细胞,PBS漂洗,甲醛固定,苏木精染色,倒置显微镜选取5个视野(×400),计数穿膜细胞,取均值。实验重复3次。
1.5细胞迁移能力检测除Transwell小室上室未铺Matrigel胶,其他操作同细胞侵袭能力检测。实验重复3次。
1.6TSPYL5、EMT相关蛋白(E-cadherin、Vimentin)、STAT3和p-STAT3蛋白表达的检测用RIPA裂解液提取上述3组细胞总蛋白,BCA法测定蛋白浓度。将蛋白样品煮沸变性5 min,低速离心30 s,加入适量4×SDS,每孔上样40 μg,经10 g/L SDS-PAGE分离后电转移至PVDF膜,用含50 g/L脱脂奶粉的TBST在37 ℃下封闭1 h,加1∶500稀释的TSPYL5、E-cadherin、Vimentin、STAT3和p-STAT3及1∶1 000稀释的GAPDH抗体(内参),4 ℃孵育过夜,TBST漂洗5 min×3次,加1∶4 000稀释的HRP标记的二抗,37 ℃孵育45 min。TBST漂洗5 min×3次,ECL化学发光法显影。用Image J软件分析条带灰度值。以目的条带与GAPDH条带灰度值的比值为目的蛋白的相对表达量。实验重复3次。
1.7抑制STAT3蛋白后细胞侵袭与迁移能力以及E-cadherin和Vimentin蛋白表达检测取LoVo细胞,分为空白2组、AG490组(加50 μmol/L AG490)和AG490+TSPYL5质粒组(50 μmol/L的AG490及pcDNA3.1-TSPYL5转染)。处理48 h后,参照1.4和1.5方法检测细胞侵袭及迁移能力,参照1.6方法检测E-cadherin和Vimentin蛋白的表达。
1.8统计学处理采用SPSS 21.0处理数据,采用单因素方差分析比较各组细胞以上指标的差异,两两比较采用SNK-q检验,检验水准α=0.05。
2 结果
2.1空白1组、空载体组和TSPYL5质粒组细胞TSPYL5蛋白表达及侵袭、迁移能力的比较结果见图1、表1。与空白1组和空载体组比较,TSPYL5质粒组细胞TSPYL5蛋白表达水平升高,侵袭和迁移能力降低。
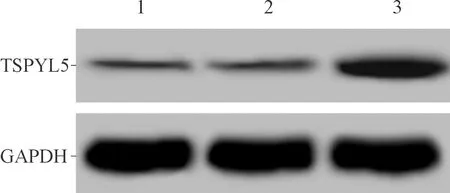
1~3:分别为空白1组、空载体组和TSPYL5质粒组
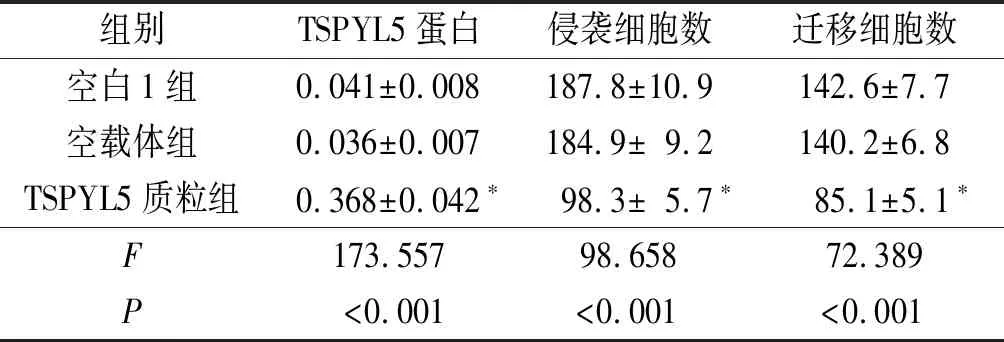
组别TSPYL5蛋白 侵袭细胞数迁移细胞数空白1组0.041±0.008187.8±10.9142.6±7.7空载体组0.036±0.007184.9±9.2140.2±6.8TSPYL5质粒组0.368±0.042∗98.3±5.7∗85.1±5.1∗F173.55798.65872.389P<0.001<0.001<0.001
*:与空白1组和空载体组比较,P<0.05
2.2空白1组、空载体组和TSPYL5质粒组细胞EMT相关蛋白及STAT3、p-STAT3蛋白表达水平的比较结果见图2、3和表2。与空白1组和空载体组比较,TSPYL5质粒组E-cadherin蛋白表达水平升高,Vimentin和p-STAT3蛋白表达水平降低。

1~3:分别为空白1组、空载体组和转染TSPYL5质粒组

1~3:分别为空白1组、空载体组和转染TSPYL5质粒组

组别E-cadherinVimentinSTAT3p-STAT3空白1组0.132±0.0120.311±0.0280.669±0.0720.147±0.016空载体组0.143±0.0140.337±0.0340.678±0.0750.159±0.018TSPYL5质粒组0.567±0.056∗0.158±0.016∗0.685±0.0740.029±0.006∗F159.28738.3370.03675.409P<0.001<0.0010.965<0.001
*:与空白1组和空载体组比较,P<0.05
2.3空白2组、AG490组及AG490+TSPYL5质粒组细胞侵袭、迁移能力及EMT相关蛋白表达的比较结果见表3。AG490组细胞侵袭及迁移能力均低于空白2组,而AG490+TSPYL5质粒组细胞侵袭及迁移能力均低于AG490组;AG490组E-cadherin蛋白的表达高于空白2组,Vimentin蛋白的表达低于空白2组,而AG490+TSPYL5质粒组E-cadherin蛋白的表达高于AG490组,Vimentin蛋白表达低于AG490组。
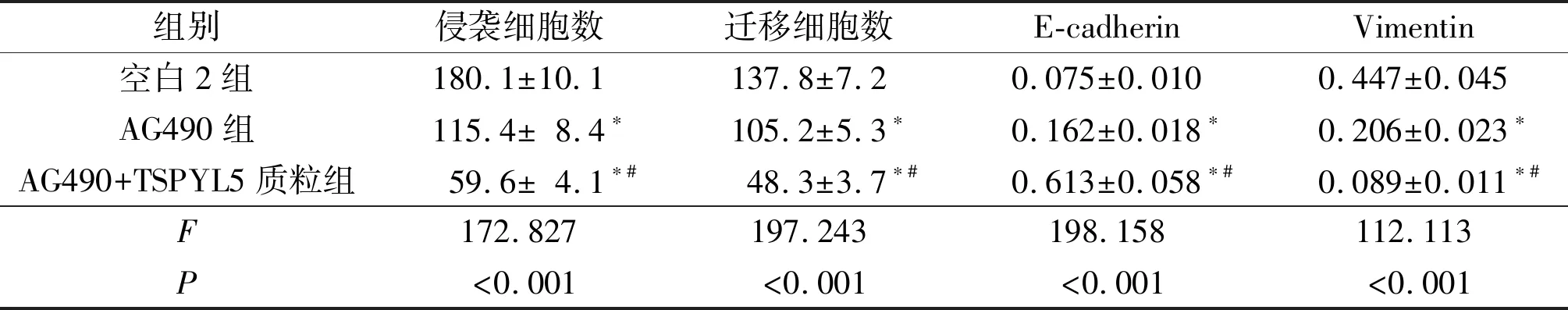
表3 3组细胞侵袭、迁移能力及EMT相关蛋白表达的比较(n=3)
*:与空白2组比较,P<0.05;#:与AG490组比较,P<0.05
3 讨论
肿瘤的发生发展是一个复杂的病理过程,涉及抑癌基因失活、癌基因过度表达、DNA错配修复的功能缺失等[8]。其中抑癌基因表达下调或失活被认为是肿瘤发生的早期事件[9]。TSPYL5属于TSPYL家族,是新发现的一种抑癌基因,参与染色质构成、各种细胞活动,同时也可能与调节基因表达有关[10]。目前TSPYL5的分子生物学功能及分子机制仍不明确。有研究[11-13]表明,胃癌中TSPYL5表达下调,上调其表达可抑制细胞生长;TSPYL5在结直肠癌低表达,过表达TSPYL5可抑制结直肠癌细胞增殖、侵袭、迁移和诱导凋亡;而肺腺癌A549细胞中TSPYL5表达上调,抑制其表达可抑制细胞生长。本研究结果表明,上调TSPYL5表达后,结直肠癌LoVo细胞侵袭和迁移能力降低,与文献[12]报道一致。
EMT主要表现为E-cadherin和角蛋白等上皮标志物表达缺失或降低,Vimentin和神经钙黏蛋白等间质性标志物表达增加,同时细胞形态向成纤维细胞等间质细胞样转变,进而获得侵袭和迁移能力[14]。有研究[15-16]显示,致癌基因FOXK1通过诱导EMT促进结直肠癌细胞的侵袭转移;二苯乙烯苷通过PI3K/AKT通路抑制TGF-β诱导的结直肠癌EMT,并降低其运动迁移能力。本研究结果显示,上调TSPYL5表达可抑制LoVo细胞Vimentin表达,促进E-cadherin表达,提示上调TSPYL5可通过逆转EMT抑制结直肠癌细胞的侵袭和迁移。
许多信号通路可诱导EMT的产生,如活化的Wnt信号、NF-κB信号、Notch信号、STAT3信号通路等[17]。STAT3是STATs家族成员之一,与细胞增殖、凋亡、侵袭、转移等密切相关,多种肿瘤中STAT3信号通路异常激活,活化的STAT3可转录激活下游的靶基因,进一步引起一系列相关因子的激活和蛋白表达,从而促进肿瘤发生、侵袭和转移,因此STAT3被称为癌基因[18-19]。研究[20]表明,抑制STAT3信号可阻碍肿瘤发生发展,因此抑制STAT3信号已成为肿瘤治疗热点。本研究结果显示,上调TSPYL5表达可抑制p-STAT3表达,提示上调TSPYL5表达可抑制STAT3信号。AG490为JAK2特异性抑制剂,可抑制STAT3信号,本研究进一步探究抑制STAT3信号对结直肠癌细胞侵袭和迁移的影响,结果显示,在应用AG490的基础上,上调TSPYL5表达可进一步抑制LoVo细胞侵袭和迁移能力,促进E-cadherin的表达,抑制Vimentin的表达,提示上调TSPYL5表达可能通过逆转EMT,从而抑制结直肠癌细胞侵袭和迁移能力。
综上所述,上调TSPYL5的表达可能通过抑制STAT3信号逆转EMT,进而降低结直肠癌细胞侵袭和迁移能力。后续研究将致力于TSPYL5对结直肠癌细胞其他生物学特性、机制的研究及体内研究,为结直肠癌的诊疗提供理论依据。
——一道江苏高考题的奥秘解读和拓展

