上调叉头框转录因子J2对肺癌细胞凋亡及CHOP蛋白表达的影响
郑连喜,邓 超,何 平,屈 敏
1)攀钢总医院肿瘤科 四川攀枝花 617000 2)重庆三峡中心医院肿瘤科 重庆 404000
肺癌是最为常见的呼吸系统恶性肿瘤,手术切除、放疗、化疗等是目前肺癌治疗的常见手段,这些传统的治疗方法虽然取得了一定的成效,但仍然不能满足需求,因此研究肺癌的发病机制对于肺癌的治疗具有重要意义[1-2]。叉头框转录因子J2(forkhead box J2,Foxj2)是Fox蛋白家族的成员,其在人类早期胚胎发育、心脏发育等过程中具有重要作用[3]。目前已发现,Foxj2参与调控细胞的生长,与细胞的多种生物学特性有关;Foxj2在肿瘤发生中扮演重要角色,其在胶质瘤、乳腺癌、肺癌等组织中表达下调,其表达水平降低预示着肿瘤患者预后不良[4-6]。近年来发现,内质网应激是细胞凋亡发生的重要途径之一。本研究观察了Foxj2过表达在肺癌细胞凋亡中的作用,同时观察了凋亡相关蛋白[Cleaved Caspase-3(活化的Caspase-3)、Bax]和内质网应激相关蛋白[活化转录因子4(activating transcription factor 4,ATF4)和CCAAT/增强子结合蛋白同源蛋白(CCAAT/enhancer-binding protein homologous protein, CHOP)]表达的变化,探讨Foxj2在肺癌发生中的作用。
1 材料与方法
1.1材料肺癌A549、H1299、SPCA1细胞购自通派(上海)生物科技有限公司,正常肺HBE细胞购自武汉普诺赛生命科技有限公司,细胞均用含体积分数10%胎牛血清的DMEM培养液培养。qRT-PCR所用试剂均购自美国Thermo公司,所用引物均由上海生工生物工程股份有限公司合成,pLV-EGFP-Foxj2慢病毒和pLV-EGFP对照慢病毒由上海吉凯基因化学技术有限公司构建,Foxj2抗体购自美国Abcam公司,ATF4抗体、Cleaved Caspase-3抗体、CHOP抗体及兔抗羊HRP标记的IgG购自武汉伊莱瑞特生物科技股份有限公司, Bax抗体购自美国Santa Cruz公司。
1.2肺癌细胞和正常肺细胞中Foxj2表达的检测①Foxj2 mRNA表达水平检测:肺癌A549、H1299、SPCA1细胞和正常肺HBE细胞均用RNA提取试剂盒分别提取总RNA,反转录成cDNA。PCR引物序列:Foxj2 上游引物5’-TTCTCGAGTTATGGCTTCT GACCTAGAGAGTAGC-3’,下游引物5’-TAGGATC CAGTGATCAAGTCCCAGTCGAAGTC-3’;β-actin上游引物5’-GGACCTGACTGACTACCTC-3’,下游引物5’-TACTCCTGCTTGCTGAT-3’。反应体系:0.5 μL的 cDNA 模板,上、下游引物各0.3 μL,0.4 μL Passive Reference Dye,10 μL的2×TS Top Green qPCR SuperMix,8.5 μL的ddH2O。反应条件:94 ℃ 50 s;94 ℃ 5 s;56 ℃ 34 s,35个循环。用2-ΔΔCt法计算Foxj2 mRNA的表达水平。每组设3个复孔,实验重复3次。
②Foxj2蛋白表达水平检测:肺癌A549、H1299、SPCA1细胞和正常肺HBE细胞用RIPA裂解提取总蛋白后,BCA法测定蛋白浓度。配制分离胶和浓缩胶,在上样孔中加入50 μg的蛋白样品和5 μL Marker,90 V恒压下电泳分离。用半干法将蛋白转移到PVDF膜上。将PVDF膜37 ℃封闭(体积分数5%的牛血清白蛋白)1 h后,在一抗孵育液(Foxj2抗体按1∶1 000稀释)中4 ℃孵育10 h,再放在二抗(1∶3 000稀释的兔抗羊HRP标记的IgG)孵育液中室温反应2 h。滴加ECL发光液,应用Bio-rad采集图片。Foxj2蛋白的表达水平为Foxj2条带和β-actin条带灰度值的比值。每组设3个复孔,实验重复3次。
1.3细胞分组和感染效果验证SPCA1细胞在感染前1 d接种于6孔板,分为3组,Foxj2组和阴性对照组分别感染pLV-EGFP-Foxj2慢病毒和pLV-EGFP对照慢病毒,未感染细胞为空白对照组。感染前更换细胞培养液,添加慢病毒液,使感染复数为30,感染后24 h换液,继续培养3 d后用嘌呤霉素筛选。48 h后采用qRT-PCR和Western blot法检测Foxj2的表达,步骤同1.2。
1.4 3组细胞增殖检测将空白对照组、阴性对照组、Foxj2组细胞分别接种于96孔板,每孔约2 000个细胞,培养48 h后取出培养板,每孔添加10 μL MTT溶液,37 ℃反应4 h后,取出培养板,吸弃上清,添加DMSO溶液反应10 min,用酶联免疫吸附仪测定波长450 nm的吸光度(A)值,经空白调零孔调零以后,计算各组细胞存活率。每组设3个复孔。存活率=实验组A值/空白对照组A值×100%。实验重复3次。
1.5 3组细胞凋亡检测培养48 h后,空白对照组、阴性对照组、Foxj2组各取106个细胞,用冰预冷的PBS悬浮,1 000 ×g离心10 min,添加300 μL的结合缓冲液混合,再分别添加PI染液和Annexin V-FITC各5 μL混合,上流式细胞仪检测前再添加200 μL的结合缓冲液。计算细胞凋亡率。每组设3个复孔,实验重复3次。
1.6 3组细胞中Cleaved Caspase-3、Bax、ATF4、CHOP蛋白表达水平的检测取空白对照组、阴性对照组、Foxj2组细胞,按照1.2中Western blot法步骤检测细胞中Cleaved Caspase-3、Bax、ATF4、CHOP蛋白表达水平(Cleaved Caspase-3抗体按1∶5 000稀释,Bax和ATF4抗体按1∶1 000稀释,CHOP抗体按1∶2 000稀释)。每组设3个复孔,实验重复3次。
1.7统计学处理采用SPSS 21.0处理数据,用单因素方差分析比较4种细胞Foxj2表达水平的差异以及3组SPCA1细胞组间Foxj2表达水平、细胞存活率、凋亡率及Cleaved Caspase-3、Bax、ATF4、CHOP蛋白表达水平的差异,组间两两比较用SNK-q检验,检验水准α=0.05。
2 结果
2.1肺癌细胞及正常肺细胞中Foxj2表达水平的比较结果见图1、表1。肺癌A549、H1299、SPCA1细胞中的Foxj2 mRNA和蛋白表达水平均低于正常肺HBE细胞,其中SPCA1细胞中Foxj2 mRNA和蛋白表达水平低于H1299和A549细胞,故后续实验选用Foxj2表达水平最低的SPCA1细胞。
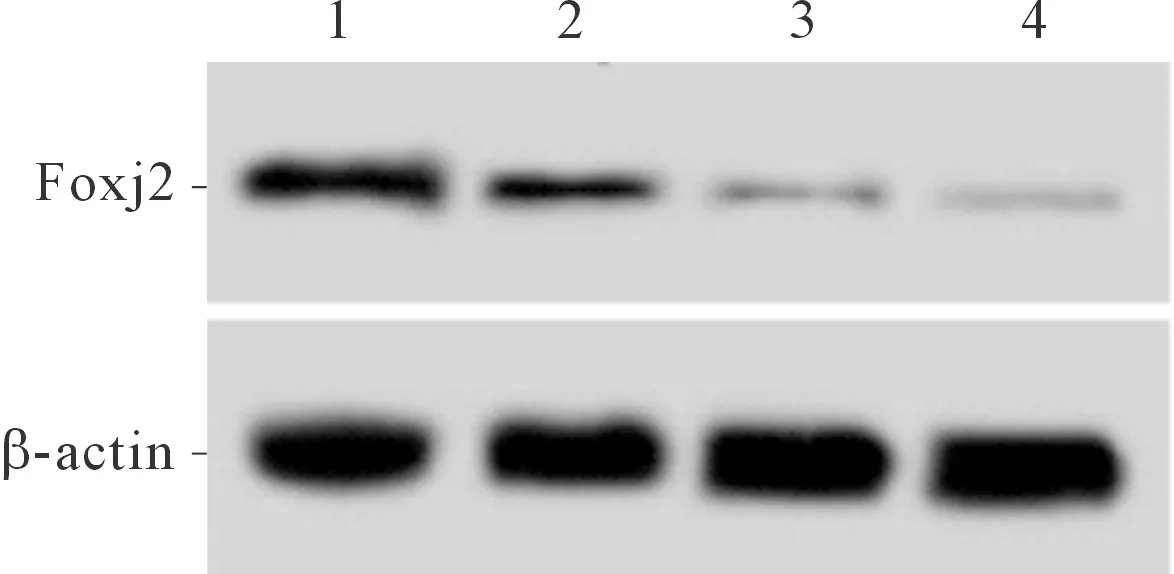
1~4:分别为HBE、A549、H1299、SPCA1细胞
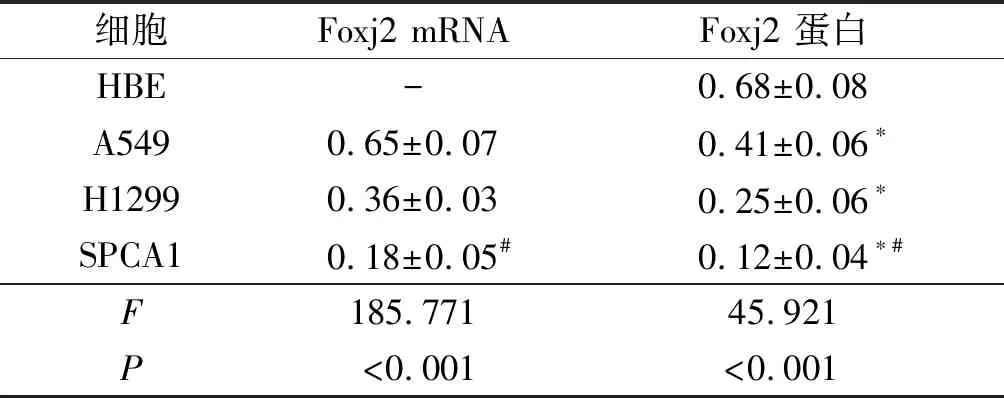
细胞Foxj2 mRNAFoxj2 蛋白HBE-0.68±0.08A5490.65±0.070.41±0.06∗H12990.36±0.030.25±0.06∗SPCA10.18±0.05#0.12±0.04∗#F185.77145.921P<0.001<0.001
*:与HBE细胞比较,P<0.05;#:与A549细胞和H1299细胞比较,P<0.05
2.2 3组SPCA1细胞中Foxj2表达水平的比较结果见图2、表2。与空白对照组和阴性对照组比较,Foxj2组SPCA1细胞中Foxj2 mRNA和蛋白表达水平上调。
2.3 3组SPCA1细胞存活率和凋亡率比较结果见表3。与空白对照组和阴性对照组比较,Foxj2组细胞存活率下降,细胞凋亡率升高。
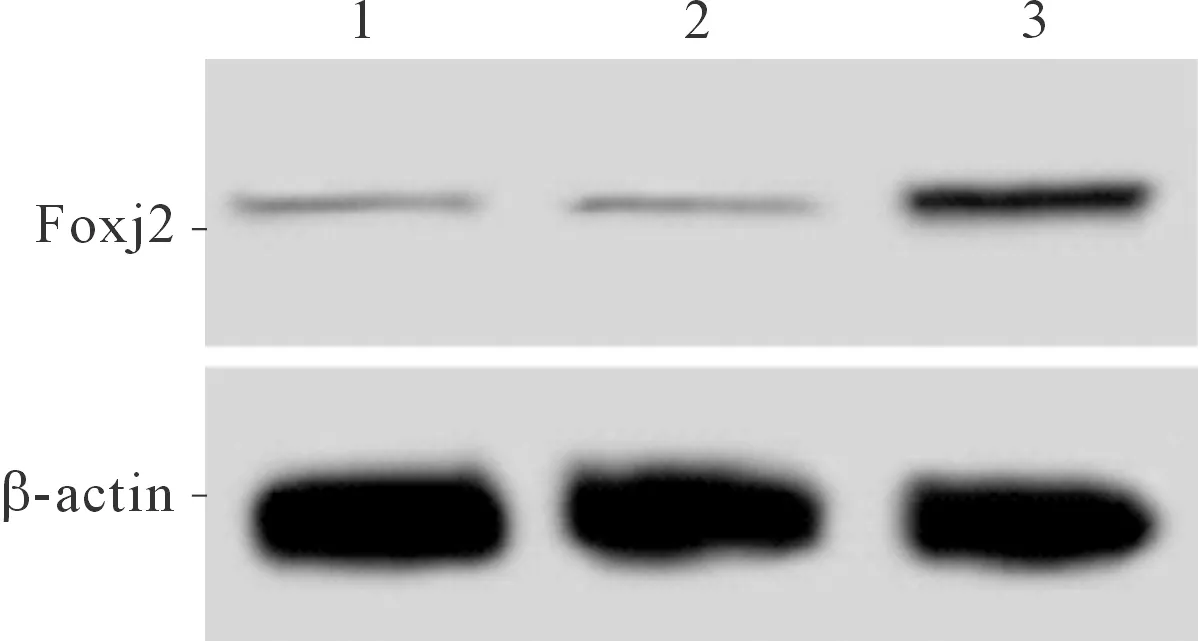
1~3:分别为空白对照组、阴性对照组和Foxj2组

组别Foxj2 mRNAFoxj2 蛋白空白对照组-0.16±0.04阴性对照组0.98±0.110.15±0.06Foxj2组2.17±0.13∗0.36±0.05∗#t/F144.07216.403P<0.0010.004
*:与阴性对照组比较,P<0.05; #:与空白对照组比较,P<0.05
表3 3组SPCA1细胞存活率和凋亡率比较(n=9) %

组别存活率凋亡率空白对照组-3.20±0.74阴性对照组97.35±10.453.47±0.69Foxj2组62.89±9.12∗26.95±3.78∗#t/F20.052109.271P0.002<0.001
*:与阴性对照组比较,P<0.05;#:与空白对照组比较,P<0.05
2.4 3组SPCA1细胞中Cleaved Caspase-3、Bax、ATF4、CHOP蛋白表达水平的比较结果见图3、表4。与空白对照组和阴性对照组比较,Foxj2组细胞中凋亡相关蛋白Cleaved Caspase-3、Bax及内质网应激蛋白ATF4、CHOP的表达升高。
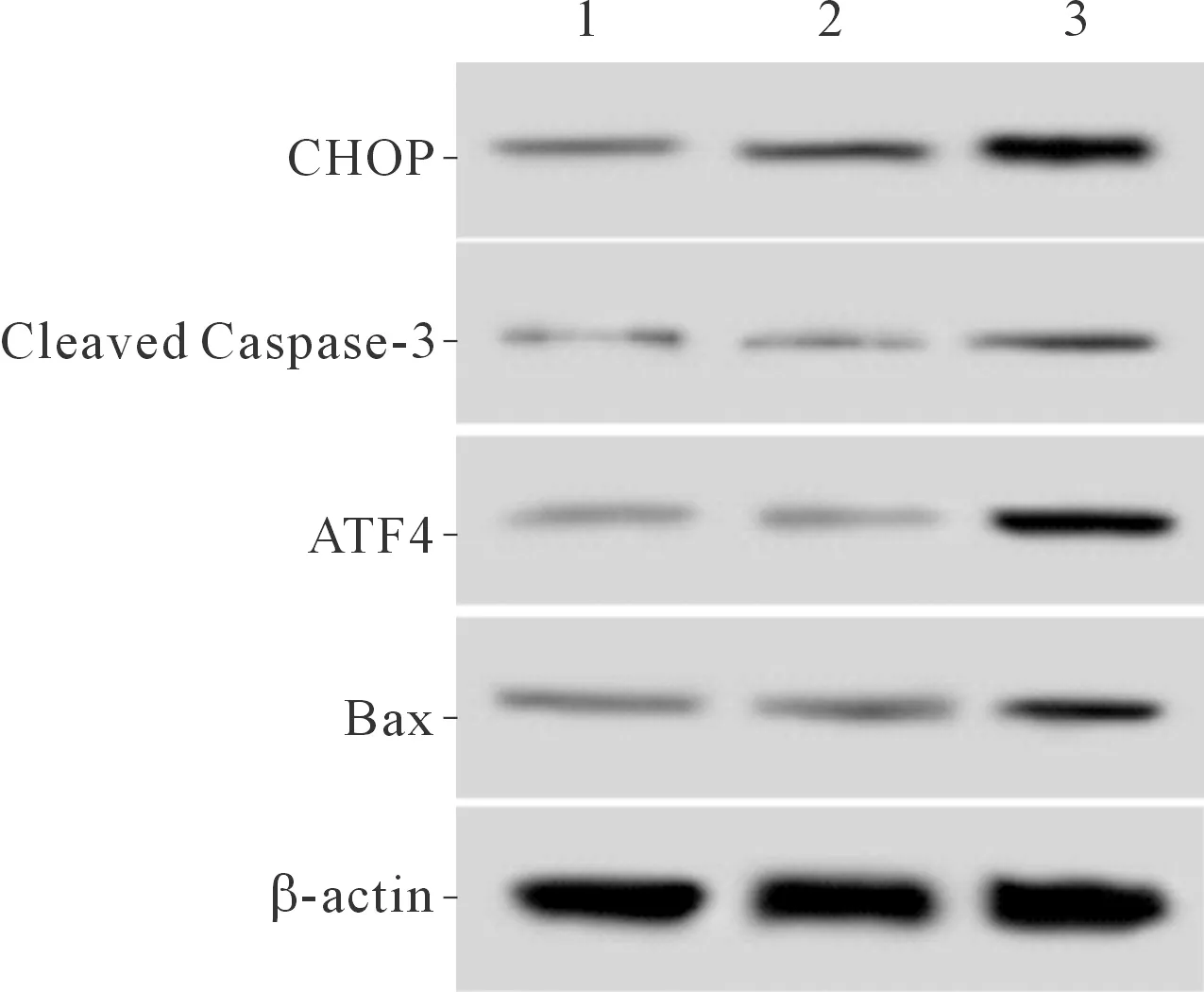
1~3:分别为空白对照组、阴性对照组和Foxj2组

组别Cleaved Caspase-3BaxATF4CHOP空白对照组0.17±0.020.19±0.020.15±0.040.21±0.05阴性对照组0.16±0.050.20±0.030.16±0.030.23±0.04Foxj2组0.26±0.03∗0.30±0.04∗0.43±0.06∗0.45±0.05∗F7.18411.48337.23024.182P0.0260.009<0.0010.001
*:与空白对照组和阴性对照组比较,P<0.05
3 讨论
Fox是众多转录因子家族中的一个超级大家族,包含100多个蛋白家族成员,均含有一个由1~100个氨基酸组成的单体DNA结合区域,能够与DNA结合诱导DNA分子发生回折[7-9]。Foxj2基因是Fox蛋白成员,含有2个DNA结合区域,能够识别2种不同的DNA序列,同时也能够被其他Fox转录因子识别。有研究[4-6,10-11]显示,Foxj2在人体内所有组织中均有表达,在乳腺癌、肺癌、胶质瘤等肿瘤组织中Foxj2表达下调,Foxj2可能通过调控细胞的生长影响肿瘤的发生和发展。已有研究[3,12]表明过表达Foxj2可以诱导成年大鼠肺出血和心脏肥大。在肺癌中的研究显示,STAT6基因沉默可以下调miR-197的表达,诱导细胞凋亡,而miR-197又可以靶向负调控的Foxj2表达;还有研究表明,过表达Foxj2可以抑制肺癌细胞上皮间质转化,反之敲低Foxj2具有促进肺癌细胞转移的作用,Foxj2可能在肺癌中发挥抑癌基因的作用[6,13]。本实验结果显示,Foxj2在肺癌细胞中的表达水平低于正常肺细胞,并且过表达Foxj2的肺癌细胞的增殖能力降低,与上述研究报道一致。
细胞凋亡减少是细胞癌变的重要特征之一,也是肿瘤发展的重要原因,目前的研究显示,Caspase和Bcl-2是与细胞凋亡密切相关的两大蛋白家族,Caspase被激活可以发生Caspase凋亡级联反应,Caspase-3是位于该凋亡反应下游的执行因子,其只有被活化后才可以发挥促进细胞凋亡的作用;Bax是Bcl-2蛋白家族成员,其在细胞凋亡过程中发挥促进作用,Bax表达水平升高是细胞凋亡发生的标志[14-17]。细胞凋亡发生的具体机制目前尚不明确,近年来发现,内质网应激是细胞凋亡发生的重要途径之一,CHOP表达上调是内质网应激发生的直接结果,ATF4是位于CHOP上游的内质网应激分子,其可以激活CHOP的表达[18-20]。研究[13,21]显示,Foxj2诱导细胞发生内质网应激,这可能是其诱导细胞凋亡发生的途径之一。本实验的结果表明,过表达Foxj2后的肺癌细胞中Cleaved Caspase-3、Bax、ATF4、CHOP蛋白表达水平均升高,提示Foxj2可能通过激活肺癌细胞内质网凋亡途径诱导Caspase凋亡反应和Bax蛋白表达,从而发挥凋亡促进的作用。
综上所述,Foxj2在肺癌中发挥抑癌基因的作用,Foxj2在肺癌细胞中表达下调,过表达Foxj2可能通过内质网途径诱导肺癌细胞凋亡。本实验结果为研究Foxj2在肿瘤发生中的作用机制,并进一步阐明肺癌发病机制提供了参考。Foxj2如何靶向调控内质网应激尚不明确,有待后续进一步探索。

