羊肉火腿加工过程中粗肽抗氧化活性
王勇勤,郭 新,马雪莲,袁湖川,朱苗苗,黄笠原,王 远,王庆玲,*
(1.石河子大学食品学院,新疆 石河子 832000;2.新疆农垦科学院,新疆 石河子 832000)
新疆羊肉因其高蛋白、低脂、低胆固醇深受各族人民喜爱[1]。羊肉火腿是以新疆羊后腿为原料,经过腌制、发酵、成熟获得的具有特征香气的特色食品。研究表明在传统火腿生产加工过程中,蛋白质发生复杂变化,产生小分子肽和氨基酸等物质[2];还有学者在对火腿的研究中发现蛋白质降解产生了具有抗氧化能力的肽类物质[3-6]。
天然抗氧化肽在减少细胞氧化、防止脂质过氧化、降低自由基生成速率等方面具有重要作用[7],并在人体新陈代谢方面也发挥调节功能[8]。与人工合成抗氧化剂相比,天然抗氧化肽具有分子质量小、易消化、无副作用等优势[9]。马艳梅[10]对新疆绵羊火腿蛋白质降解的研究表明,肌浆蛋白和肌原纤维蛋白在加工过程中发生不同程度的降解,产生大量的游离氨基酸,生成羊肉火腿独特的前体风味物质。王勇勤等[11]研究了羊肉火腿加工中抗氧化体系的动态变化,证明脂溶性内源抗氧化物在羊肉火腿加工中发挥重要作用。然而,目前对羊肉火腿加工过程中抗氧化肽的研究甚少,关于抗氧化肽对羊肉火腿脂质氧化的调控作用尚未明确。
基于此,本研究以不同加工时期的羊肉火腿为研究对象,提取粗肽并对其含量进行测定,继而对抗氧化能力进行表征和评价,以期获得羊肉火腿中抗氧化肽的抗氧化能力变化规律,为进一步研究粗肽对脂质氧化的调控提供参考。
1 材料与方法
1.1 材料与试剂
新疆塔城巴什拜羊后腿,畜龄12 个月,购于石河子市农贸市场。
邻二氮菲、1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)、2,2’-联氮-二(3-乙基-苯并噻唑-6-磺酸)(2,2’-azino-bis(3-ethylbenzothiazoline-6-sulfonic acid) diammonium salt,ABTS)、水溶性VE(Trolox)、二丁基羟基甲苯(butylated hydroxyltoluene,BHT)、谷胱甘肽(glutathione,GSH)、邻苯二甲醛、十二烷基硫酸钠(sodium dodecyl sulfate,SDS) 国药集团化学试剂有限公司。以上试剂均为分析纯。
1.2 仪器与设备
RE-2000E旋转蒸发器 西安仪贝尔仪器设备有限公司;X7型酶标仪 美国伯腾仪器有限公司;DCodeTMSystem蛋白电泳仪、Universal Hood II凝胶成像仪美国Bio-Rad公司。
1.3 方法
1.3.1 羊肉火腿加工工艺
1.3.1.1 羊肉火腿工艺流程
新鲜羊后腿→预冷修整→加盐腌制→洗刷浸泡→晾晒风干→晾挂发酵→成熟→羊肉火腿[11]
1.3.1.2 工艺条件
参考Wang Zhenyu等[12]研究方法并略作修改。原料腿:4 ℃放置48 h预冷;腌制期:添加质量分数6.5%(以鲜腿质量计)食盐腌制,分5 次揉搓于原料表面,于6 ℃、相对湿度(relative humidity,RH)65%条件下腌制30 d;风干期:10 ℃、RH 62%,风干30 d;发酵期:20 ℃、RH 72%,发酵60 d;成熟中期:25 ℃、RH 78%,成熟30 d;成熟结束期:28 ℃、RH 70%,后熟65 d。
1.3.2 取样时间
于原料腿、腌制期、风干期、发酵期、成熟期、成熟中期、成熟结束期6 个工艺点分别取样,对应取样时间点分别为0、30、60、120、150、180 d,样品真空包装后冷冻保藏备用。
1.3.3 羊肉火腿粗肽及粗蛋白的提取
参照Zhu Chaozhi等[13]研究方法并略作修改。去除羊肉火腿样品中脂肪、肌膜,将其剪碎,称取5.0 g加入15 mL 0.2 mol/L磷酸盐缓冲液(phosphate buffered saline,PBS),匀浆3 次,每次10 s。匀浆液于4 ℃下冷藏20 min,离心40 min(4 ℃、6 500 r/min);取上清液加入3 倍体积的体积分数40%乙醇溶液,4 ℃下冷藏12 h后,4 ℃、6 500 r/min离心35 min,收集上清液;沉淀物重复上述操作步骤,合并上清液,冷冻干燥12 h制得粗肽粉,-20 ℃冷冻备用。火腿粗蛋白的提取按照上述方法,不进行体积分数40%乙醇溶液沉淀及之后的操作。
1.3.4 多肽质量分数的测定
参照Church等[14]研究方法并略作修改。20 mg邻苯二甲醛溶于0.5 mL甲醇,加入12.5 mL 0.1 mol/L四硼酸钠溶液、1.25 mL 0.2 g/mL SDS、50 μLβ-巯基乙醇、100 μL 1 mg/mL粗肽溶液混合(现配现用)定容至25 mL,得粗肽混合液。取0.1 mL粗肽混合液与1.0 mL 0.8 mg/mL邻苯二甲醛溶液混合,室温下反应2 min,于340 nm波长处测定吸光度(A340nm)。用胰酪蛋白胨作标准物配制标准蛋白质溶液,以蛋白质量浓度为横坐标,以A340nm为纵坐标绘制标准曲线,所得线性回归方程为Y=0.528 7X+0.193 8(R2=0.993 6)。多肽质量分数按式(1)计算。

式中:ρ为粗肽溶液中多肽质量浓度/(mg/mL);V为稀释体积/mL;m为粗肽粉质量/mg。
1.3.5 还原力的测定
参考Remanan等[15]研究方法并略作修改。将1.0 mL粗肽液(5 mg/mL)、1.0 mL 1 g/100 mL铁氰化钾溶液和1 mL PBS(0.2 mol/L)混合,40 ℃水浴孵育30 min后冰水冷却,加入1.0 mL体积分数10%的三氯乙酸溶液混匀,4 500 r/min离心30 min。上清液加入2.5 mL蒸馏水、0.2 mL 0.1 g/100 mL三氯化铁溶液充分反应15 min,于700 nm波长处测定吸光度,平行测定3 次。
1.3.6 ABTS阳离子自由基清除能力的测定
参考Floegel等[16]研究方法,略作修改。将7 mmol/L ABTS溶液、2.45 mmol/L K2S2O8溶液等体积混合,生成ABTS阳离子自由基,用去离子水与无水乙醇混合液(1∶1,V/V)将其稀释13 倍(试剂需现配现用)。取20 μL粗肽液(3 mg/mL),加入80 μL去离子水和100 μL稀释的ABTS溶液于酶标板中避光反应10 min,于734 nm波长处测定吸光度(A734nm)。以A734nm为纵坐标,以Trolox浓度为横坐标绘制标准曲线,所得线性回归方程为Y=-2.543 3X+0.407 9(R2=0.997 9,线性范围0~0.16 mmol/L),将所测样品A734nm代入标准曲线方程计算ABTS阳离子自由基清除能力,结果以每毫升溶液中Trolox的物质的量表示。
1.3.7 DPPH自由基清除能力的测定
参考Sheih等[17]研究方法并略作修改。取80 μL粗肽液(3 mg/mL)与100 μL DPPH自由基溶液(0.2 mmol/L),加入酶标板中室温避光反应25 min,于517 nm波长处测定吸光度。以A517nm为纵坐标,以Trolox浓度为横坐标绘制标准曲线,所得线性回归方程为Y=-3.008 8X+0.478 3(R2=0.998 6,线性范围0~0.16 mmol/L)。将所测样品A517nm代入标准曲线方程计算DPPH自由基清除能力,结果以每毫升溶液中Trolox的物质的量表示。
1.3.8 羟自由基清除率的测定
参照Zhu Chaozhi等[13]研究方法并略作修改。将0.7 mL PBS(0.2 mol/L)、1.0 mL邻二氮菲(5 mmol/L)、1.0 mL乙二胺四乙酸(pH 7.4)、1.0 mL 2 mmol/L硫酸亚铁溶液及1.4 mL体积分数1%的H2O2溶液加入1.0 mL粗肽液(5 mg/mL)中,30 ℃恒温孵育1.5 h,于536 nm波长处测定吸光度,记为A样品;用去离子水代替H2O2溶液重复上述步骤测定吸光度,记为A未损伤;用去离子水代替粗肽液重复上述步骤测定吸光度,记为A损伤[12]。羟自由基清除率按式(2)计算。

1.3.9 脂质氧化抑制率的测定
参照Jayaprakasha等[18]研究方法并略作修改。配制不同质量浓度(5、10、15、20、25 mg/mL)粗肽溶液,考察粗肽溶液质量浓度对脂质氧化抑制率的影响。将0.48 g亚油酸、0.048 g吐温20溶于PBS(0.2 mol/L),PBS定容至50 mL配得亚油酸乳化液。将1.0 mL无水乙醇、5.0 mL亚油酸乳化液、4.0 mL 0.2 mol/L PBS与4.0 mL不同质量浓度粗肽液混合。0.1 mL混合液与4.7 mL体积分数70%的乙醇溶液、0.1 mL 30 g/100 mL硫氰酸铵溶液混匀后加入0.1 mL 0.02 mol/L氯化亚铁溶液反应5 min,于500 nm波长处测定吸光度,记为A样品0h,间隔120 h后测吸光度,记为A样品120h。空白对照:用去离子水代替粗肽液重复上述步骤测定吸光度,记为A空白0h,间隔120 h后测吸光度,记为A空白120h。脂质氧化抑制率按式(3)计算。

1.3.10 SDS-PAGE分析
SDS-聚丙烯酰胺凝胶电泳(polyacrylamide gel electrophoresis,PAGE)参照汪家政[19]的方法并略作修改。将100 μL蛋白粗提液(1 mg/mL)加入100 μL 5×样品缓冲溶液中,100 ℃恒温孵育10 min,冷却,立刻上样。SDS-PAGE条件:分离胶质量分数为12%,浓缩胶质量分数为5%,电泳起始电压80 V,样品进入分离胶后电压调至160 V,考马斯亮蓝染色35 min,脱色后于凝胶呈像仪上呈像观察。
1.4 数据处理与分析
2 结果与分析
2.1 羊肉火腿加工过程中粗肽中多肽质量分数的变化

图 1 羊肉火腿加工过程中多肽质量分数的变化Fig. 1 Changes in peptide content during mutton ham processing
由图1可知,随着加工的进行,羊肉火腿中多肽质量分数总体呈增长趋势。从原料腿到腌制期多肽质量分数由8%增至9%,变化不显著(P>0.05)。其原因可能在于低温腌制(4 ℃)过程中羊肉火腿的内源蛋白酶活力受到一定程度的抑制,继而抑制蛋白质水解。腌制期到成熟中期,火腿中多肽质量分数显著增高归因于加工温度的升高对内源蛋白酶的激活作用,加速了蛋白质向多肽分子的转化,同时,在二肽酶等蛋白酶作用下多肽分子继续水解为小肽和游离氨基酸[20]。从成熟中期至成熟结束期多肽质量分数大幅升高,火腿成品多肽质量分数高达63.32%,究其原因可能与火腿成熟后期的温度升高有关。Zhou Guanghong等[21]在金华火腿的加工中同样发现多肽含量在发酵期至成熟期迅速增加的现象。在火腿加工过程中,肌肉蛋白质在内源酶和微生物作用下水解产生大量多肽片段和小分子肽类等物质,并随着加工过程而逐渐累积[22]。
2.2 羊肉火腿加工过程中粗肽还原力的变化
还原力是以Fe3+被抗氧化物还原后在700 nm波长处的吸光度来表征[23]。对火腿加工过程中的粗肽还原力测定结果如图2所示。

图 2 羊肉火腿加工过程中粗肽还原力的变化Fig. 2 Changes in reducing power of crude peptides during mutton ham processing
由图2可知,火腿加工过程中粗肽还原力随加工时间延长呈上升趋势,原料腿的粗肽还原力低于此后各个加工时期,成熟结束期A700nm高达0.45,表明羊肉火腿在加工过程中粗肽抗氧化能力逐渐增强并在成熟结束期达到峰值。产生这种现象的主要原因可能是随加工时期温度的增加,食盐不断向肌肉内部浸入,加速蛋白结构的破坏和分解,继而大量产生抗氧化肽小分子[20]。与Mora等[24]对帕尔玛干腌火腿的研究结果相比,羊肉火腿粗肽的还原力较低,原因可能在于原料及加工工艺的不同所致,帕尔玛火腿腌制发酵时间远长羊肉火腿,长时间的腌制发酵可能产生更多的抗氧化肽,同时帕尔玛火腿加工过程中会在火腿表面涂抹猪脂,以防止内部脂质氧化,进而增加了抗氧化肽的积累,表现出更强的还原力。
2.3 羊肉火腿加工过程中粗肽ABTS阳离子自由基清除能力的变化
由图3可知,羊肉火腿加工中ABTS阳离子自由基清除能力总体呈上升趋势,并在成熟结束期达到最大。羊肉火腿腌制期粗肽ABTS阳离子自由基清除能力为0.04 mmol/L,低于原料腿粗肽,从腌制期至发酵期粗肽抗氧化能力上升,说明此阶段抗氧化物生成速率大于氧化速率[25];至成熟中期粗肽ABTS阳离子自由基清除能力急剧下降,主要原因可能是成熟期抗氧化物参与化学反应生成了挥发性风味物质,使抗氧化物转化为风味化合物,从而表现出抗氧化能力降低的现象[26]。羊肉火腿在成熟中期和成熟结束期分别呈现最低和最高的ABTS阳离子自由基清除能力,此阶段变化最为显著(P<0.05),上升幅度约200%。产生此现象的原因可能是蛋白酶活力逐渐增强,加快了蛋白质向抗氧化肽和氨基酸的转化速率[27],因此增强了粗肽抗氧化能力和ABTS阳离子自由基清除能力。

图 3 羊肉火腿粗肽对ABTS阳离子自由基清除效果Fig. 3 Scavenging effect of crude peptides from mutton ham on ABTS cation radicals
2.4 羊肉火腿加工过程中粗肽DPPH自由基清除能力的变化
DPPH自由基清除能力可以用来表征物质的抗氧化能力[28]。由图4可知,火腿加工过程中粗肽DPPH清除能力呈现不规则波动,整个工艺中,腌制期和成熟中期表现出较强的DPPH自由基清除能力,可能是由于在腌制期和成熟中期蛋白质水解程度大,疏水性小分子多肽含量增多,因而对DPPH自由基亲和能力增强[29]。从原料腿到腌制期粗肽DPPH自由基清除能力大幅上升,可能是由于食盐对蛋白质水解的加速作用,促使含有抗氧化基团的小肽大量生成;腌制结束后呈现的持续下降主要归因于含有色氨酸、酪氨酸的抗氧化肽进一步氧化的结果[30]。
2.5 羊肉火腿加工过程中粗肽羟自由基清除率的变化
羟自由基可以与食品中脂质和蛋白质分子发生生化反应,进而影响食品的货架期和品质[31]。由图5可知,羊肉火腿加工过程中羟自由基清除率整体呈下降趋势(P<0.05),成熟结束期粗肽羟自由基清除率最低(15.23%),而风干期呈最大值(65.17%)。风干期粗肽羟自由基清除率显著上升(P<0.05),这是由于此时火腿经过腌制、风干致使原料腿中水分大量散失,一些小分子多肽和氨基酸类物质富集,浓度升高,从而表现出较高的羟自由基清除率。但在风干期结束后由于抗氧化物质羟自由基清除活性较低[32]、氧化反应生成其他产物或生成大量挥发性风味物质[33],因而羟自由基清除率呈现下降趋势。此结果与胡亚亚等[23]对金华火腿的研究结果略有差异,主要原因是金华火腿在加工过程中经过自然晾晒并有长达1 年甚至3 年的发酵期,使火腿内部蛋白质充分降解成具有抗氧化能力的小分子多肽和游离氨基酸;此外,羊肉火腿加工过程中关键工艺参数与金华火腿也有较大差异,如温、湿度和腌制时间,因此共同导致了抗氧化能力的差异。

图 5 羊肉火腿加工中粗肽羟自由基清除率的变化Fig. 5 Changes in hydroxyl radical scavenging rate of crude peptides during mutton ham processing
2.6 羊肉火腿加工过程中粗肽液脂质氧化抑制率的变化
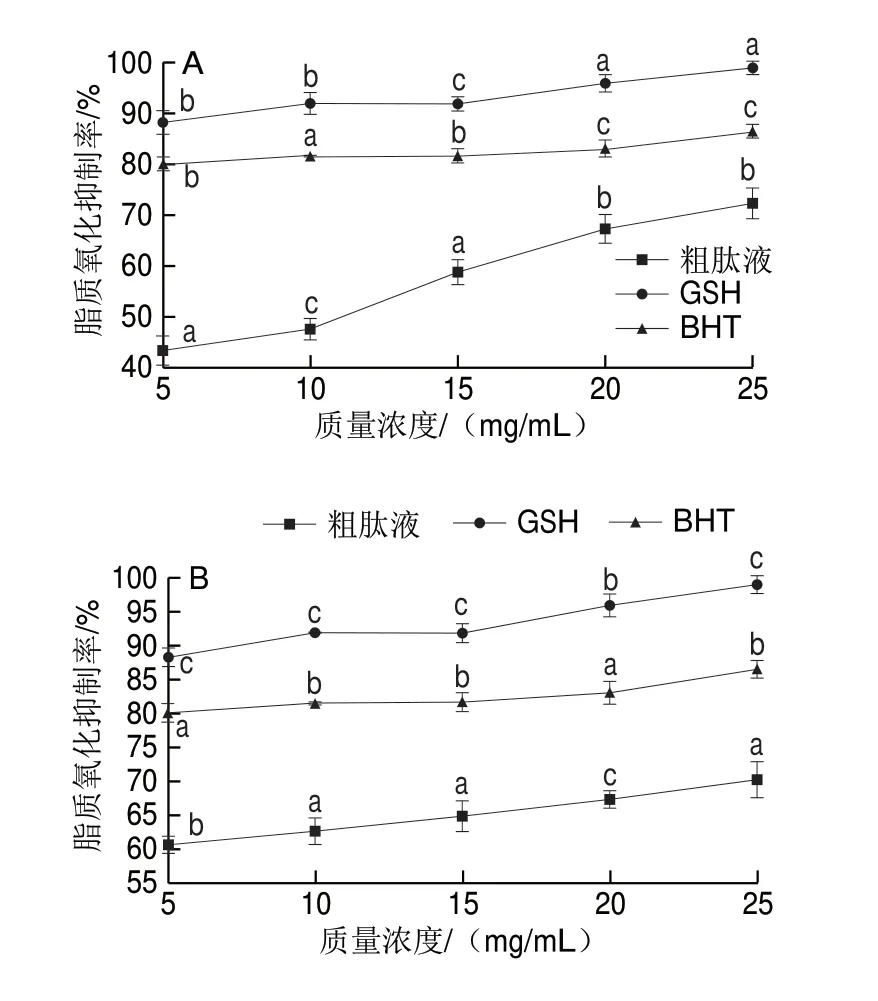
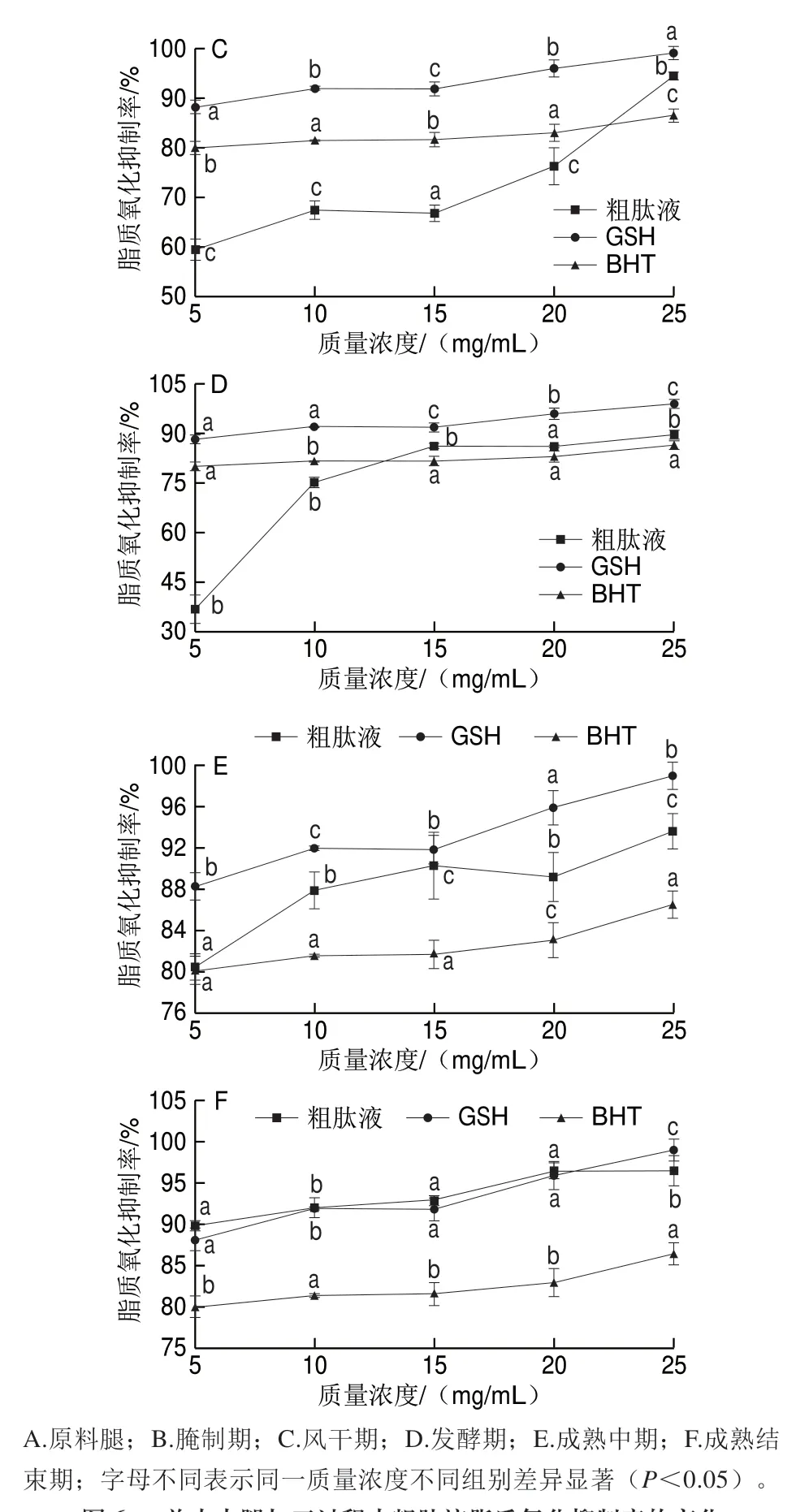
图 6 羊肉火腿加工过程中粗肽液脂质氧化抑制率的变化Fig. 6 Changes in anti-lipid oxidation activity of crude peptides during mutton ham processing
考察不同加工时期羊肉火腿粗肽脂质氧化抑制率,并与相同质量浓度的GSH、BHT进行对比,由图6可知,原料腿和腌制期粗肽液的脂质氧化抑制率明显低于GSH和BHT(图6A、B),可能是由于在原料腿和腌制期羊肉火腿水分含量较高,食盐未完全渗透至火腿内部以及发酵温度较低,此时蛋白质水解程度小,抗氧化物或潜在抗氧化物质生成较少[34];风干期和发酵期羊肉火腿粗肽液质量浓度分别高于25、15 mg/mL时,脂质氧化抑制率高于BHT但低于GSH(图6C、D),此时羊肉火腿蛋白质在微生物酶和食盐的协同作用下加速分解生成具有抗氧化力的多肽[20];成熟中期脂质氧化抑制率表现为GSH>粗肽液>BHT,当质量浓度为25 mg/mL时粗肽液脂质氧化抑制率为93.6%,抑制效果显著高于BHT(P<0.05)(图6E)。成熟结束期羊肉火腿粗肽液(5~20 mg/mL)的脂质氧化抑制率与GSH相当,且显著高于BHT(P<0.05)(图6F),说明羊肉火腿成品具有较强的抗氧化能力,此结果与邵靖萱等[35]对宣威火腿加工过程中抗氧化肽活性的研究结果相似。以上结果表明:羊肉火腿各加工时期粗肽液、GSH和BHT的脂质氧化抑制率均随质量浓度的增加而升高;羊肉火腿加工过程中粗肽液抗氧化能力不断增强,至成熟结束期其抗氧化能力与GSH相当。
2.7 羊肉火腿加工过程中蛋白质变化规律

图 7 羊肉火腿加工中蛋白质分解的变化Fig. 7 Changes in protein breakdown during mutton ham processing
由图7可知,羊肉火腿加工过程中主要蛋白质包括肌钙蛋白(73 kDa)、肌钙蛋白T(37 kDa)、磷酸甘油酸酯激酶(35 kDa)、原肌球蛋白(31 kDa)等。加工过程中肌肉蛋白发生了一定程度的降解,肌钙蛋白T从腌制期开始蛋白条带逐渐加深,表明在腌制阶段肌肉蛋白质的降解就已经逐步发生,可能发酵过程中温度上升,组织蛋白酶活力增强,从而加快了肌原纤维蛋白降解速率[27]。原肌球蛋白从原料腿开始蛋白条带逐渐变淡,表明原肌球蛋白分子从加工开始就出现降解,至火腿成熟结束条带颜色甚微,其原因可能是长时间加工过程中蛋白分子在食盐、温度、湿度条件共同作用下,导致原肌球蛋白变性、降解,生成小分子肽,此类小分子肽一般具有较好的抗氧化性能,同时能参与其他化学反应,生成赋予火腿良好感官品质的物质[36]。此外,分子质量62、48、41、24 kDa的蛋白质条带也发生降解。有研究表明,金华火腿在发酵过程中蛋白质发生显著降解,小分子多肽数量会逐渐增加[37],多肽组成可分为5 个分子质量范围,即160~375、375~500、500~1 200、1 200~2 700 Da和2 700~4 500 Da;同时,当火腿多肽氨基酸序列为Ser-Asn-Ala-Ala-Cys和Asp-Leu-Glu-Glu时抗氧化活性较强[38]。
3 结 论
通过对羊肉火腿加工过程中粗肽的多肽质量分数、还原力、羟自由基清除率、脂质氧化抑制率、抗氧化能力进行测定,结果表明:原料腿到成熟中期粗肽粉中多肽质量分数逐渐升高,还原力随加工时间延长而增加;多肽抗氧化能力整体呈上升趋势,羟自由基清除率整体呈下降趋势;随粗肽液质量浓度升高,脂质氧化抑制作用逐渐增强。SDS-PAGE结果显示,火腿加工过程中伴随着不同程度的蛋白质分子降解。综上表明新疆羊肉火腿在加工过程中蛋白质发生了一系列生化反应,并对羊肉火腿抗氧化功能产生重要影响。

