MG53蛋白联合hUC-MSCs移植对阿尔兹海默病小鼠行为和情绪失调的改善作用
周馨魁,马珊珊,黄团结,李 喆,崔渊博,王亚苹,刘腾飞,周建康,杨 波,关方霞1,
1) 郑州大学生命科学学院 郑州 450001 2) 郑州大学第一附属医院神经外科 郑州 450052
阿尔茨海默病(Alzheimer′s disease,AD)是一种常见的神经退行性疾病,主要表现为学习记忆能力受损、淀粉样蛋白沉积和Tau蛋白缠结[1]。研究[2]证实人脐带间充质干细胞(human umbilical cord derived mesenchymal stem cells, hUC-MSCs)移植是一种有效的治疗AD的方法,但是AD患者脑内通常处于严重的氧化应激状态,并不适合外源hUC-MSCs的存活。我们课题组的前期研究[2-3]显示MG53蛋白对体外培养的hUC-MSCs和小鼠海马神经元(HT22)的氧化损伤均具有保护作用。此外,MG53还可以促进hUC-MSCs在AD小鼠脑内的迁移,调控衰老相关基因的表达[4]。但是MG53对脑内氧化应激条件下的hUC-MSCs和神经元是否具有保护作用还不清楚。核因子E2相关因子2(NF-E2-related factor 2,Nrf2)通路是经典的氧化应激调控通路,我们前期的研究发现AD小鼠脑内Nrf2通路处于抑制状态。本研究拟用MG53联合hUC-MSCs移植治疗AD小鼠,观察小鼠脑内神经元数量、活性氧(reactive oxygen species,ROS)水平、Nrf2通路相关蛋白(Nrf2、Keap-1和NQO1蛋白)的表达,以及认知、焦虑等相关行为学的变化,为AD的防治提供思路。
1 材料与方法
1.1动物来源及主要仪器、试剂清洁级 3月龄APP695V717I 转基因小鼠购自中国协和医科大学动物研究所;hUC-MSCs由本实验室分离培养;rhMG53蛋白由美国俄亥俄州立大学麻建杰教授赠送;CO2恒温培养箱(日本三洋公司),酶标仪(上海圣荷西医疗用品有限公司),荧光倒置显微镜、冰冻切片机(莱卡公司),琼脂糖凝胶电泳仪(北京六一生物科技有限公司);DMEM-F12培养基、PBS、胎牛血清(美国 BI公司),硫磺素S、二氢乙啶(dihydroethidium, DHE)(美国Sigma公司),胰蛋白酶、青链霉素混合液(上海碧云天生物技术研究所);β-actin、Nrf2、Keap-1、NQO1多克隆抗体(沈阳万类生物科技有限公司)。
1.2实验分组将鉴定后的 APP695V717I 转基因小鼠随机分为4组,APP+组、MG53组、hUC-MSCs组、联合组,每组8只。APP+组小鼠通过尾静脉注射0.1 mL 生理盐水, hUC-MSCs组同法注射0.1 mL细胞密度为1×107个/mL的第5代hUC-MSCs悬液, MG53组按3 mg/kg注射0.1 mL rhMG53,联合组小鼠尾静脉注射含细胞密度为1×107个/mL的第5代hUC-MSCs和含rhMG53(3 mg/kg)的混合液0.1 mL。1次/d,连续3 d。
1.3小鼠脑组织内ROS的检测采用DHE染色法检测小鼠脑组织内ROS含量。治疗3 d后,每组选取3只小鼠,按照10 μL/g的剂量腹腔注射1 g/L的DHE,2 h后处死,常规灌注取脑,避光多聚甲醛固定过夜,梯度蔗糖溶液脱水后包埋,冰冻切片机切片,在荧光倒置显微镜下观察并拍照。所有采集的图像均使用同一曝光时间和曝光强度,使用Image J软件分析红色荧光强度,用以表示ROS含量。
1.4小鼠探索记忆能力的检测治疗后第26~28天,通过旷场实验观察小鼠自发性探索活动能力,每组4只。在一个40 cm×40 cm×30 cm的无盖纸盒活动箱内,用笔画成5 cm×5 cm的64个小正方形;将小鼠面朝箱壁放入纸盒的四个角落之一,记录小鼠3 min内跑动的格子数、直立次数,连续记录3 d。每只小鼠放置位置一样,同一方格同一方向。每次测试完后擦拭场地,避免气温、脏物的干扰,注意保持周围环境安静。双腿抬起、前爪全部离地、抬头视为直立。小鼠跨越方格以后肢跨出为标准。探索距离(cm)=横穿格子数×5+斜穿格子数×5×7.071。
1.5小鼠认知能力的检测治疗后第26~28天,通过新事物识别实验观察小鼠对新事物的认知能力,每组4只小鼠。在40 cm×40 cm×30 cm的活动箱中央放置两个大小、形状、颜色相同的无气味木块,放入小鼠适应10 min后,将其中一个木块替换成大小、形状、颜色不同的木块,记录3 min内小鼠趋向新老物体的时间。以小鼠用鼻子触碰物体开始计时,离开后停止计时。辨别指数=触碰新物体的时间/(触碰老物体的时间+触碰新物体的时间)×100%。实验过程中注意保持周围环境安静。
1.6小鼠抑郁情绪的检测治疗后第29天,采用新奇抑制喂养(novelty-suppressed feeding, NSF)实验评价小鼠抑郁状况,每组4只。在治疗后第28天小鼠禁食1 d。第29天,在40 cm×40 cm×30 cm的活动箱中放入小鼠适应5 min后,在中央放置新奇的食物(蔬果干),记录2 min内小鼠的进食潜伏期和进食量。进食潜伏期为食物放入开始至小鼠开始进食的时间。进食量=食物原质量-剩余食物质量。
1.7小鼠脑内尼氏小体、Aβ斑块面积的检测治疗后第29天,待所有行为学检测完毕,每组4只小鼠灌注取脑,多聚甲醛固定过夜后进行梯度蔗糖溶液脱水,再OCT包埋、冰冻切片,片厚10 μm。每只小鼠选取一张切片进行尼氏染色,计数海马CA1区尼氏小体数量。用蒸馏水配制10 g/L的硫磺素S染液,经0.45 μm滤头过滤。脑片在避光条件下行硫磺素S染色5 min,然后用体积分数70%乙醇脱色5 min,再用PBST漂洗3次×3 min[5],最后于荧光倒置显微镜下观察并拍照,计算染色区域面积的百分比,即为Aβ斑块面积。
1.8小鼠脑组织中Nrf2通路相关蛋白的Western blot法检测治疗后第29天,每组剩余1只小鼠灌注取脑,取0.1 g海马和皮层部位的脑组织用裂解液于冰上裂解10 min,离心收集上清,测定蛋白浓度后,以体积比为1∶4的比例将5×SDS-PAGE loading buffer和蛋白提取物混匀,95 ℃变性10 min,产物于-20 ℃保存。采用SDS-PAGE进行蛋白质的分离,转PVDF膜,用80 g/L脱脂奶粉液封闭2 h,加一抗(β-actin抗体按1∶2 000、Nrf2 抗体按1∶1 000、Keap-1抗体按1∶500、NQO1抗体按1∶1 000稀释) 4 ℃孵育过夜,TBST洗膜3次,加二抗(按1∶2 000稀释)室温孵育2 h,TBST洗膜3次,化学发光法显色,暗室曝光。
1.9统计学处理采用SPSS 19.0分析,应用2×2析因设计的方差分析比较4组小鼠尼氏小体数量、ROS含量、Aβ斑块面积、探索距离、直立次数、辨别指数、进食潜伏期和进食量。检验水准α=0.05。
2 结果
2.1MG53联合hUC-MSCs移植对AD小鼠认知能力的影响各项指标检测结果见表1。hUC-MSCs移植和MG53单独治疗均可增加AD小鼠直立次数、探索距离和新事物辨别指数,二者联合小鼠的探索距离和新事物辨别指数增加更显著。
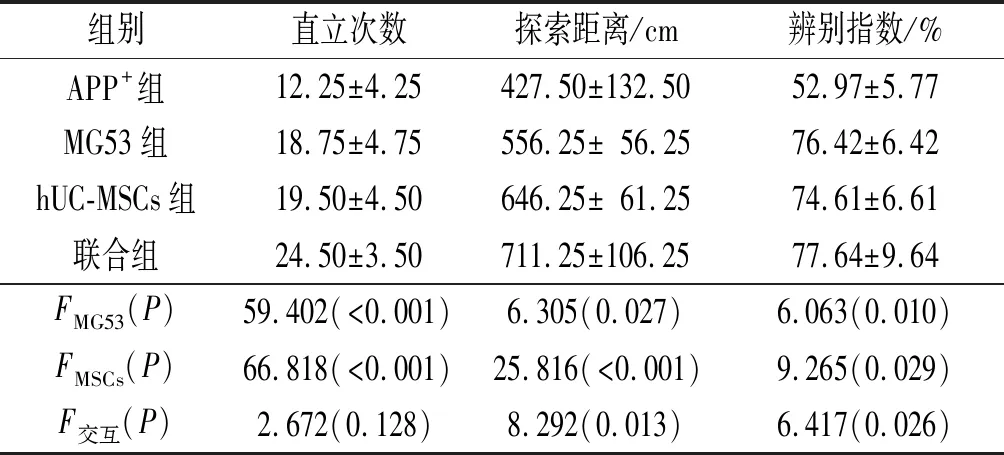
表1 4组小鼠直立次数、探索距离和新事物辨别指数的比较(n=4)
2.2MG53联合hUC-MSCs移植对AD小鼠抑郁情绪的影响NSF实验结果见表2。hUC-MSCs移植和MG53单独应用均可缩短AD小鼠的进食潜伏期,增加进食量;二者联合缩短进食潜伏期的效果更显著。
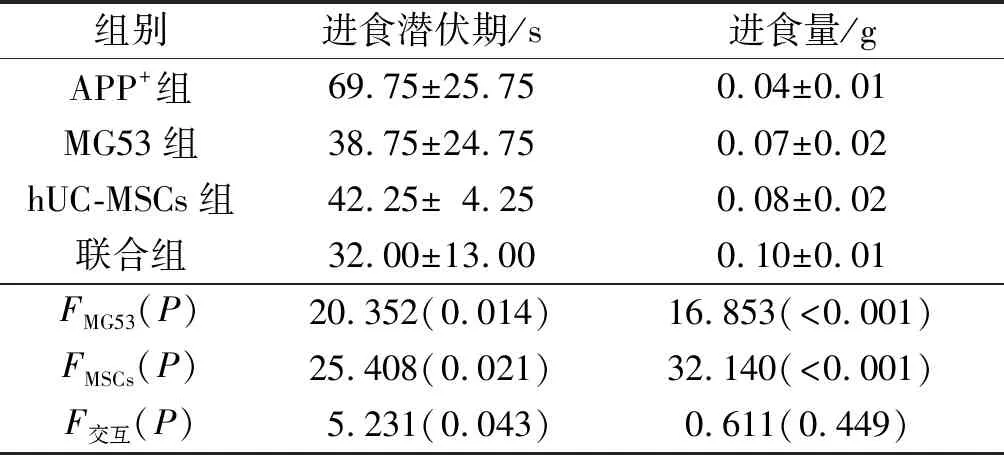
表2 4组小鼠进食潜伏期和进食量的比较(n=4)
2.3MG53联合hUC-MSCs移植对AD小鼠脑内ROS含量、尼氏小体数量、Aβ斑块面积的影响尼氏染色结果见图1,DHE和硫磺素S染色结果见图2。3个指标的定量结果见表3。hUC-MSCs移植和MG53蛋白单独治疗后,AD小鼠脑内尼氏小体数量增加,ROS含量降低,Aβ斑块面积减小;二者联用尼氏小体数量增加、ROS含量降低、Aβ斑块面积减小的效果更显著。
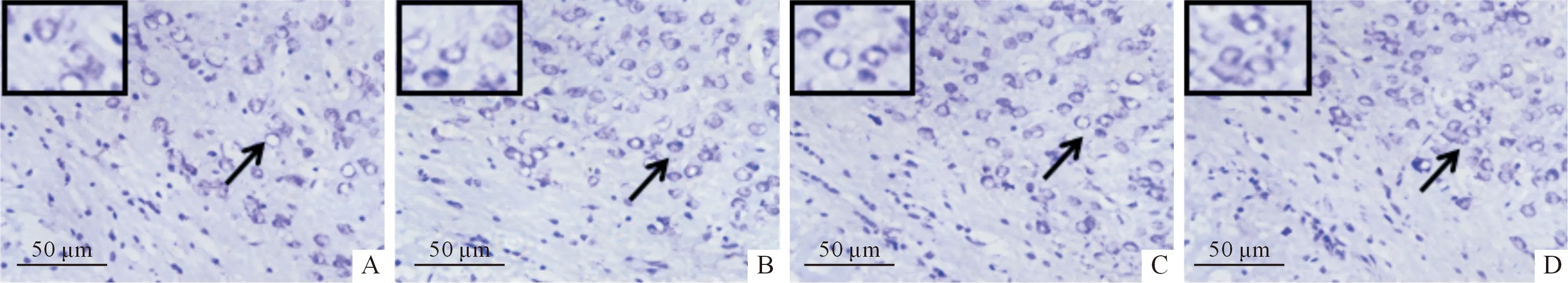
A、B、C、D:分别为APP+组、MG53组、hUC-MSCs组、联合组
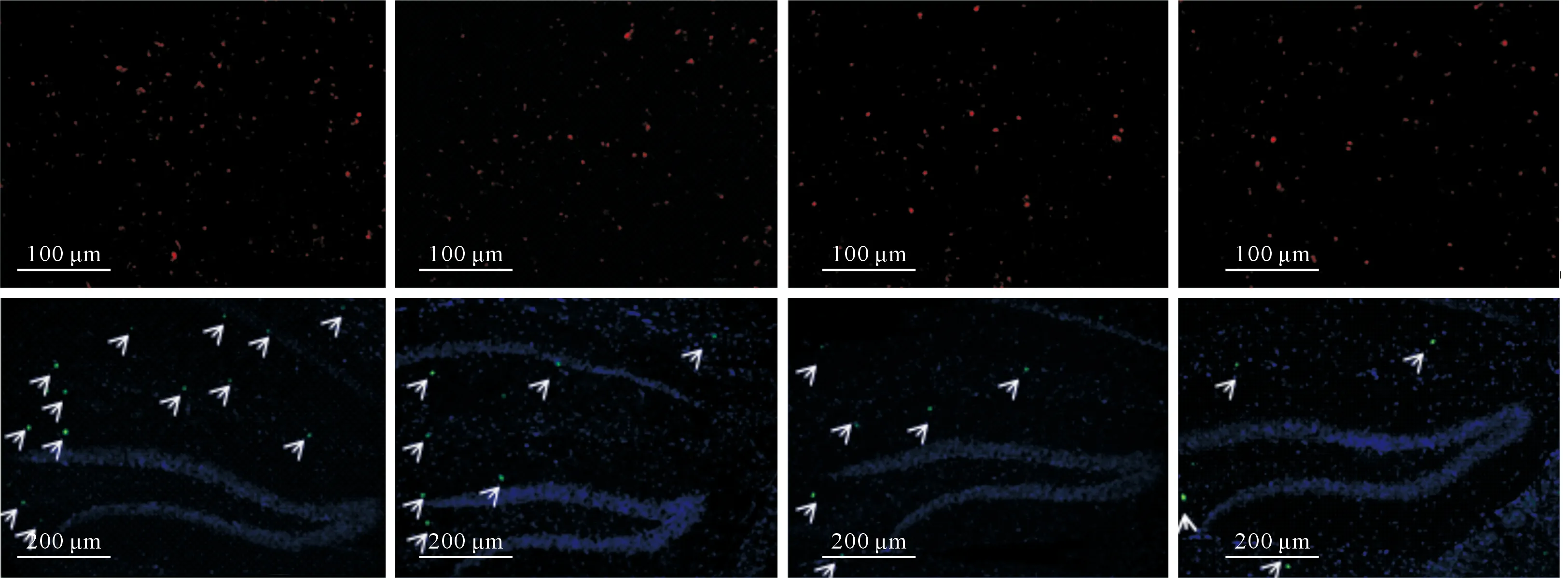
从左至右:分别为APP+组、MG53组、hUC-MSCs组、联合组
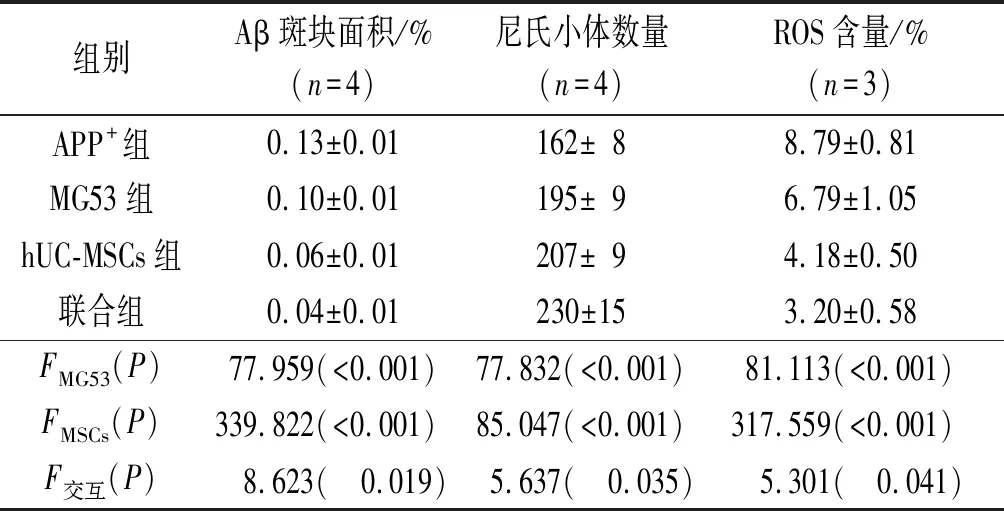
表3 4组小鼠脑内ROS含量、尼氏小体数量、Aβ斑块面积的比较
2.4 4组小鼠脑组织中Keap-1、Nrf2和NQO1蛋白表达的比较见图3。与APP+组相比,MG53组和MSCs组Keap-1表达降低,Nrf2和NQO1表达升高;与MG53组或MSCs组相比,联合组Keap-1表达更低,Nrf2和NQO1表达更高。

1、2、3、4:分别为APP+组、MG53组、hUC-MSCs组、联合组
3 讨论
AD在临床上表现为记忆障碍、失语、空间技能损害、执行功能障碍以及人格和行为改变等全面性痴呆症状,并且AD患者容易产生不良情绪,比如抑郁和淡漠[6]。本研究首先通过多种行为学方法评价了MG53联合hUC-MSCs移植对AD小鼠认知能力和抑郁状况的影响。旷场实验和新事物识别实验是检测小鼠认知能力的行为学实验。在旷场实验中,小鼠直立次数越多说明其对新环境的认知欲望越强,探索距离越长说明其对新环境的认知能力越强。在新事物识别实验中,小鼠对新事物触碰的时间越长说明其对新事物的认知能力越强,辨别指数也越大。在本研究中,我们发现经过MG53和hUC-MSCs移植单独治疗后AD小鼠的直立次数、探索距离以及新事物辨别指数均明显增加,联合组的认知能力提高更为明显。NSF实验是观察动物禁食后在饥饿状态下于新奇的环境中产生摄食和对新环境恐惧的矛盾冲突,实验中小鼠对新食物(蔬果干)进食潜伏期越短说明其抑郁程度越低,进食量越大说明小鼠越敢于进食,对新环境的恐惧程度越低[7]。在本研究中,我们发现经过MG53和hUC-MSCs移植单独治疗后AD小鼠的进食潜伏期缩短,进食量增加;联合组的进食潜伏期进一步缩短,说明该组小鼠抑郁程度降低更为明显。
AD患者脑内氧化应激反应异常[8]。Nrf2通路是调控细胞氧化应激和炎症相关基因的关键,对损伤或有变性疾患的神经功能起保护作用[9]。尼氏小体是评价脑内神经元数量的重要指标[10]。本实验发现MG53和hUC-MSCs移植单独或联合应用均能够增加AD小鼠脑内尼氏小体的数量,进而发挥神经保护作用。进一步研究发现MG53联合hUC-MSCs移植能够降低AD小鼠脑内ROS含量和Aβ斑块面积,减轻脑内氧化应激损伤。经过MG53蛋白治疗后,AD小鼠脑内Nrf2蛋白表达增加,而Keap-1表达下降,提示MG53蛋白减轻脑内氧化损伤与调节Nrf2通路有关。
综上所述,MG53蛋白对AD小鼠脑内神经细胞有保护作用,可通过Nrf2通路调节脑内氧化应激状态,降低脑内ROS含量,减少Aβ斑块沉积,从整体上提升AD小鼠的认知能力,减轻其抑郁程度,并且与hUC-MSCs移植有协同增效的作用,但是深入的机制还不明确,需要进一步研究。

