GRP78-ATF6-CHOP通路相关分子在葡聚糖硫酸钠诱导的小鼠结肠炎中的表达
郭腾飞,轩青霞,吴玉丹,董仕桢,高 磊,陈 攀,常永超,高 强
1)河南科技大学临床医学院;河南科技大学第一附属医院消化内科 河南洛阳 471003 2)河南科技大学临床医学院;河南科技大学第一附属医院检验科 河南洛阳 471003 3)首都医科大学附属北京康复医院消化内科 北京 100144
炎症性肠病(inflammatory bowel disease,IBD)是一组反复发作的慢性非特异性肠道炎症性疾病,包括溃疡性结肠炎(ulcerative colitis,UC)和克罗恩病(Crohn′s disease,CD),近年来在我国其发病率呈上升趋势[1]。IBD的病因和发病机制尚未明确,目前认为IBD是一种多因素相互作用的肠道障碍性疾病,包括遗传因素、宿主免疫反应、肠道菌群、环境因素等[1-2]。内质网是膜型及分泌型蛋白质合成及折叠的主要场所,此外也可参与脂质合成、能量代谢以及细胞内Ca2+的贮存和释放等,是真核细胞内重要的细胞器。当细胞内环境发生改变,导致未折叠或错误折叠蛋白在内质网管腔内发生堆积,便会诱发内质网应激(endoplasmic reticulum stress,ERS),从而产生一系列的细胞自我保护性反应,统称为未折叠蛋白反应(unfolded protein response,UPR)。ERS可通过3条信号通路激活UPR,分别为活化转录因子6(activating transcription factor 6, ATF6)、蛋白激酶RNA样内质网激酶[protein kinase RNA (PKR)-like ER kinase,PERK]、肌醇需求酶1 (inositol requiring enzyme 1,IRE1)[2-4]。ERS与多种人类疾病相关,在IBD的发展过程中起着重要的作用[5]。ATF6属于Ⅱ型膜转运蛋白,正常情况下与葡萄糖调节蛋白78(glucose regulated protein of 78 kDa, GRP78)结合处于未激活状态。当发生ERS时,GRP78与ATF6解离,从而激活ATF6通路[6]。ATF6可以影响C/EBP同源蛋白(CHOP),CHOP参与细胞凋亡、增殖、分化以及细胞型特异性基因能量代谢相关过程的调控[7]。本研究应用葡聚糖硫酸钠(dextran sulphate sodium,DSS)诱导小鼠急性肠炎模型,通过对GRP78、IRE1α、PERK、ATF6、CHOP等表达情况的检测,探讨GRP78-ATF6-CHOP通路与小鼠结肠炎之间的关系,以期为IBD发病机制的研究及治疗提供新的理论依据。
1 材料与方法
1.1实验动物6~8周龄、体重为19~25 g的健康清洁级雄性129S1/SvJ种系小鼠(购自深圳大学医学部)饲养于河南科技大学第一附属医院开元院区动物实验中心,室内灯光明暗交替周期设置为12 h,维持湿度在50%左右,室内温度在20~22 ℃,给予小鼠足量SPF级混合配方饲料(北京华阜康生物公司),小鼠自由饮水,并每日定时更换新鲜饮水,保持小鼠生活环境清洁卫生及通风良好。每日观察小鼠的摄食饮水量、大便性状及活动情况,确认小鼠健康且适应环境。
1.2主要试剂DSS购自美国MP Biomedicals 公司,相对分子质量为36 000~50 000;GRP78(ab21685)、ATF6(ab37149)和CHOP(ab11419)抗体均购自美国Abcam 公司;GAPDH(sc-32233)抗体购自美国Santa Cruz公司;羊抗鼠(BA1054)、羊抗兔(BA1050)二抗、SABC即用型小鼠(SA1021)/兔(SA1022) IgG免疫组化试剂盒、ECL试剂盒购自武汉博士德生物工程有限公司;大便隐血试剂盒购自珠海贝索生物技术有限公司;Trizol试剂购自美国Invitrogen公司;qRT-PCR扩增试剂盒和反转录试剂盒均购自日本TaKaRa公司;引物由上海生工生物工程技术有限公司合成(表1);DAB显色试剂盒、中性树脂购自北京索莱宝科技有限公司。

表1 引物序列和退火温度
1.3结肠炎动物模型的建立及标本留取采用随机数字表法将小鼠分为对照组和DSS组,每组8只。对照组饮用无菌蒸馏水,DSS组饮用30 g/L DSS溶液,自由饮用6 d。每组小鼠均给予充足SPF级混合饲料。第6天腹腔注射戊巴比妥钠麻醉小鼠,处死,剪开腹腔取出全部结肠,观察结肠性状,并测量结肠长度;翻转结肠,用预冷PBS清洗结肠内部粪便,自远端剪取结肠组织约5 mm放入体积分数10%甲醛溶液固定,石蜡包埋后4 μm厚切片,常温保存以备HE及免疫组化染色使用;另外自远端剪取约10 mm结肠组织,立即放入RNAlater中,4 ℃放置24 h后,转移至-80 ℃冰箱保存,备mRNA检测使用;再剪取约10 mm结肠组织,液氮冷冻后转至-80 ℃冰箱保存,备Western blot检测使用。
1.4观测指标及组织病理学评分动物模型建立期间每日上午及下午观察小鼠,观察指标:反应机警性、活动情况、毛发光泽度、大便性状和大便带血情况,称量小鼠的进食量以及饮水量,运用隐血检测试剂盒检测大便隐血情况,下午4点准时称量体重。按照Jackson等[8]方法进行DAI评分,DAI评分标准:根据小鼠大便性状(正常、松散、稀便)、大便带血情况(正常、隐血阳性、肉眼血便)及体重下降百分比3项指标分别进行评分,然后取三者平均值即为DAI评分结果。小鼠结肠组织切片行HE染色,在400倍光镜下观察,按照 Esworthy等[9]评分标准进行组织病理学评分,炎症的临界值定义为6分。
1.5小鼠结肠组织中IL-1β、IL-6、TNF-α、GRP78、IRE1α、PERK、ATF6和CHOP mRNA的qRT-PCR检测使用Trizol法提取小鼠结肠组织总RNA,运用核酸定量仪测定RNA浓度与纯度。取2 μg总RNA行反转录合成cDNA,置于-20 ℃冰箱保存备用。冰上配制25 μL PCR反应体系:cDNA 2 μL,上、下游引物各1 μL,DNase/RNase-free水8.5 μL,SYBR Premix EX Taq Ⅱ (2×) 12.5 μL。PCR反应条件:95 ℃预变性30 s; 95 ℃变性5 s,退火30 s,72 ℃延伸30 s,共计40个循环。每个样本做3个复孔,以β-actin作为内参,采用2-ΔΔCt法分析各项指标mRNA相对表达量。
1.6小鼠结肠组织中GRP78、ATF6和CHOP蛋白表达的检测
1.6.1 免疫组化法 结肠组织切片经常规乙醇梯度脱蜡后行染色,一抗GRP78(兔多克隆抗体)、ATF6(兔多克隆抗体)、CHOP(鼠单克隆抗体)分别按1∶1 000、1∶300、1∶200稀释,以PBS代替一抗作为阴性对照,4 ℃冰箱过夜后,滴加相应二抗,DAB显色,苏木精复染。显微镜下观察,每张切片选择10个视野(×200),每个视野计数100个细胞。参考文献[10]的方法对GRP78、ATF6和CHOP蛋白表达情况进行评分。
1.6.2 Western blot 取约50 mg小鼠结肠组织于EP管中,加入1 mL RIPA裂解液匀浆后置于冰上30 min,4 ℃离心后取上清,采用BCA法测定蛋白浓度。与蛋白上样缓冲液充分混匀后,100 ℃变性10 min,取40 μg蛋白样品进行SDS-PAGE,电泳结束后将蛋白转移至PVDF膜,50 g/L脱脂奶粉液封闭1 h。GRP78、ATF6、CHOP一抗均按1∶1 000稀释,4 ℃过夜,二抗(1∶2 000)室温2 h。ECL显色3 min,经成像系统成像,用Image J软件进行灰度分析,以目的蛋白与内参GAPDH条带灰度值的比值表示目的蛋白的相对表达量。
1.7统计学处理采用SPSS 19.0进行数据分析,应用两独立样本t检验比较两组小鼠第6天体重变化、DAI评分、结肠长度、组织病理学评分、炎症因子、GRP78、ATF6、CHOP mRNA及蛋白表达的差异,检验水准α=0.05。
2 结果
2.1小鼠一般状况、DAI评分、结肠组织病理学评分的比较对照组小鼠活动自如,体毛光泽,摄食饮水正常,生长发育良好,体重增加。DSS组于造模第3天开始出现体毛凌乱,活动量减少,摄食量及饮水量减少,小鼠肛周潮湿明显并出现稀便、大便隐血阳性等现象;第6天全部小鼠出现严重肉眼血便,体重下降约15%。与对照组相比,第6天DSS组DAI评分(3.8±0.3)增高,结肠长度缩短(P<0.05)。HE染色可见对照组小鼠结肠黏膜结构完整,无炎性细胞浸润(图1A1);DSS组可见黏膜上皮细胞广泛缺失,腺体多数不完整,杯状细胞缺失,黏膜及黏膜下层细胞排列紊乱,炎性细胞广泛浸润,呈严重炎症改变(图1B1);与对照组相比,DSS组组织病理学评分显著升高(P<0.05)。见表2。

表2 两组小鼠第6天体重变化、DAI、结肠长度、组织病理学评分比较

A:对照组;B:DSS组;1:HE染色;2:GRP78蛋白;3:ATF6蛋白;4:CHOP蛋白
2.2小鼠结肠组织中IL-1β、IL-6、TNF-α、GRP78、IRE1α、PERK、ATF6和CHOP mRNA表达的比较见表3。由表3可知,与对照组相比,IL-1β、IL-6、TNF-α、GRP78、ATF6和CHOP mRNA表达水平在DSS组显著增高(P<0.05)。
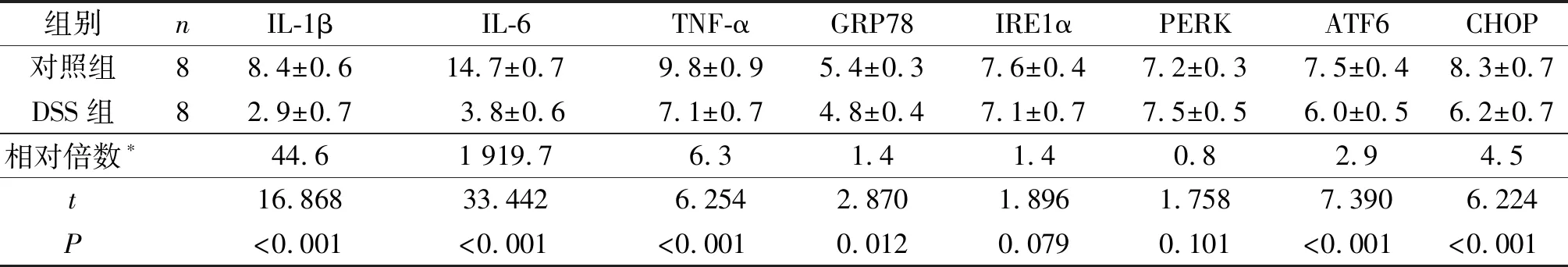
表3 两组小鼠结肠组织炎症因子和ERS相关分子mRNA的表达
*:DSS组与对照组相比
2.3两组小鼠结肠组织中GRP78、ATF6和CHOP蛋白的表达见图1。GRP78蛋白主要表达于上皮细胞胞质和胞膜。ATF6蛋白主要表达于上皮细胞胞质及胞核,也可表达于刷状缘;CHOP蛋白主要表达于结肠上皮细胞的胞核中。DSS组3种蛋白的表达较对照组明显上调(表4)。
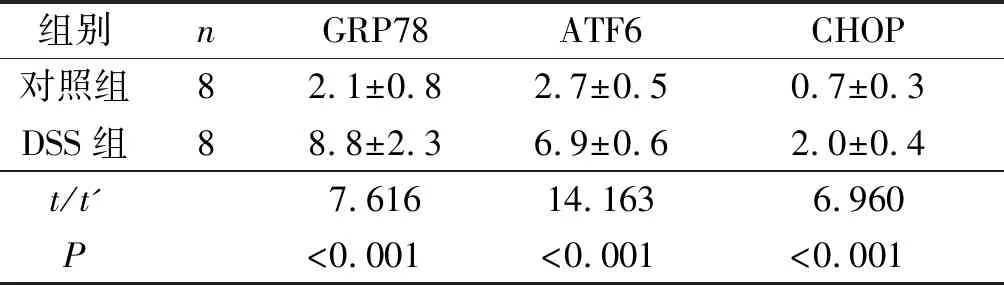
表4 两组小鼠结肠组织中GRP78、ATF6和CHOP蛋白表达情况
3 讨论
IBD在西方国家属于常见病,特别是北美、北欧、西欧、澳大利亚等地区和国家[11]。近年来随着人们生活水平、生活环境、医疗环境等因素的改变,IBD在中国等亚洲低发病率国家的发病率呈逐年上升趋势[11]。IBD主要表现为腹痛、腹泻、黏液血便等症状,病程迁延不愈,发作与缓解交替,并可伴发多种肠道外症状及并发症,严重影响患者的生活质量,增加患者经济负担[12-13]。本研究所建立的小鼠急性肠炎模型表现出腹泻、黏液血便、体重下降等与人类结肠炎相似的临床症状,病理组织学观察可见小鼠结肠黏膜上皮细胞广泛缺失,局部糜烂,腺体多数不完整,黏膜及黏膜下细胞结构排列紊乱,杯状细胞消失,中性粒细胞等炎症细胞广泛浸润,呈严重炎症改变;炎性因子IL-1β、IL-6和TNF-α mRNA在炎症组表达显著升高。
GRP78在正常情况下可与IRE1、PERK、ATF6的管腔域结合,使后者处于非激活状态;当发生ERS时,GRP78便与通路蛋白解离,使其处于激活状态,因此,GRP78被认为是ERS发生的标志[14]。本研究中DSS组小鼠结肠组织中GRP78 mRNA和蛋白表达均明显上调,与陈梦露等[10]的研究一致,说明本研究DSS诱导的小鼠结肠炎模型中ERS起到重要作用。
ATF6在维持组织稳态及正常发育过程中发挥着重要作用[15]。当发生ERS时,ATF6与GRP78解离,并转运至高尔基复合体,经蛋白水解酶1(site-1 protease, S1P)和S2P裂解,形成活化型ATF6,并转运至细胞核,调节GRP78、GRP94、XBP1、CHOP等的表达,帮助蛋白质折叠、分泌和降解[15-16]。研究[17]显示,ATF6通路在UC患者结肠上皮中被激活,表达上调。此外,Hanaoka等[18]研究显示,ATF6在溃疡性结肠炎相关直肠癌癌前不典型病变中表达上调。CHOP也称GADD153或者DDIT3,正常情况下CHOP表达量很低,参与多种疾病的病理性凋亡过程,包括神经退行性疾病、代谢性疾病、缺血性疾病和肿瘤等[14,19]。当细胞发生ERS时,CHOP可通过多种途径被激活从而诱导凋亡,如PERK-eIF2α-ATF4-CHOP、ATF6-CHOP等[14]。Xu等[20]的研究显示ATF6-CHOP通路的激活在脑内出血的大鼠模型中可能发挥着重要的调节神经元细胞凋亡的作用。然而,在IBD病理过程中,激活CHOP引起凋亡的机制目前尚未明确。本研究显示DSS组与对照组IRE1α和PERK mRNA表达水平差异无统计学意义,而DSS组ATF6和CHOP mRNA及蛋白均上调,说明CHOP在IBD肠道上皮细胞的凋亡过程中发挥了作用。
综上所述,本研究结果显示,GRP78-ATF6-CHOP通路的激活参与了IBD的发生发展,该研究结果可能为IBD的治疗探索提供新的理论依据。

