胃癌合并幽门螺杆菌感染CYP2C19基因型与其预后的关系分析
佟铁刚 张日来 冯瑞兴
1.广东省佛山市顺德区北滘医院内四科,广东佛山 528311;2.广东省佛山市顺德区北滘医院急诊科,广东佛山 528311
胃癌在我国各种恶性肿瘤中居首位,有研究显示,胃癌患者的Hp 感染率在60% 以上[1],表明胃癌的发病可能与Hp 感染有关,且Hp 感染可加速胃癌的发展,因此,胃癌患者合并Hp 感染后,可加重病情,影响其生存预后水平[2]。而有研究认为细胞色素P450 氧化酶2C19(CYP2C19)可参与前致癌的活化物和致癌物质的灭活,当CYP2C19 酶活性减弱时,致癌物质在体内代谢减慢,导致其在体内堆积,从而增加了肿瘤的易感性,且由于其慢代谢作用,对癌物质灭活过慢,可影响患者的治疗,易导致肿瘤复发和转移,从而影响患者的生存质量[3-4]。因此,CYP2C19 基因的表达水平可用于评价癌症的预后,然而目前关于CYP2C19 基因型与胃癌合Hp 患者预后关系的研究较少见,因此本研究拟通过对我院2017 年1 月~2018 年12 月收治的100 例胃癌合并Hp 感染患者为研究对象,并采用病例对照的方式探讨胃癌合并幽门螺旋杆菌感染CYP2C19 基因型与其预后的关系,现报道如下。
1 资料与方法
1.1 一般资料
选取我院2017 年1 月~2018 年12 月收治的胃癌合并Hp 感染患者100 例作为观察组,另选取同期胃癌无合并Hp 感染患者100 例作为对照组,纳入标准:经临床检查确诊为胃癌;观察组患者确诊为合并Hp 感染,对照组患者无Hp 感染;所有患者均签署知情同意书;排除标准:精神异常;合并脑血管疾病;血液系统疾病;严重肺部疾病;同时合并其他恶性肿瘤;脏器功能严重异常;未配合完成本研究者。观察组男58 例,女42 例,年龄58 ~74 岁,平均(67.9±6.2)岁;对照组男55 例,女45 例,年龄59 ~72 岁,平均(67.7±6.1)岁,两组患者性别、年龄比较无统计学差异(P>0.05),具有可比性,本研究并通过医院伦理委员会审查。
1.2 方法
抽取静脉血6mL,提取全血细胞DNA(采用TAKARA 公司提供的DNA 提取试剂直接从EDTA抗凝全血中提取DNA,溶解于50µL TE 缓冲液中),采用聚合酶链式反应- 限制性片段长度多态性法检测两组患者CYP2C19 的基因多态性,即50µL反 应 体 系:10×Buffer 5µL,DNTP 4µL,Taq 酶0.25µL,模板DNA 100ng,上下游引物各20pmol,灭菌水至50µL。扩增条件:94℃ 4min,35 个循环[94℃ 30s,60℃(SOD1 为55℃)30s,72℃ 30s],72 ℃ 10min,酶 切 体 系20µL:10×NEB 缓 冲 液2µL,DNA 片段≤1ng,内切酶0.5µL,双蒸灭菌水至20µL,60℃孵育14h。2% 琼脂糖,电泳1.45h,紫外成像后,判定基因型。并通过通过电话、复诊等方式对所有患者随访2 年,记录其生存情况,依据是否生存分为死亡组和生存组,采用单因素分析法分析CYP2C19 的基因多态性对胃癌患者Hp 感染及预后的影响,采用Logistic分析法筛选其中危险基因型,分析CYP2C19 基因型与该疾病及其预后的关系,指导实施针对性治疗方案。
1.3 观察指标
检测两组患者CYP2C19 的三种基因型[ 纯合子快代谢型(EM)、杂合子快代谢型(IM)、慢代谢型(PM)] 所占的比例。
1.4 统计学方法
本研究采用SPSS22.0 软件完成全部数据处理分析,对无序分类资料采用χ2检验,采用单因素分析CYP2C19 的基因型对胃癌患者Hp 感染及预后的影响,对有统计学差异的基因型进一步采用Logistic分析法筛选其中危险基因型,以P<0.05为差异有统计学意义。
2 结果
2.1 两组患者CYP2C19型分布比较
两组患者在纯合子快代谢型及杂合子快代谢型分布比例比较无统计学差异(P>0.05),观察组慢代谢型基因型比例显著高于对照组(P<0.05),见表1。

表1 两组基因型分布比较[n(%)]
2.2 CYP2C19基因多态性对胃癌患者生存预后的影响
由表2 可见死亡组慢代谢基因型所占比例显著高于生存组(P<0.001);而生存组与死亡组纯合子快代谢基因型、杂合子快代谢基因型所占比例比较均无统计学差异(P>0.05),见表2。
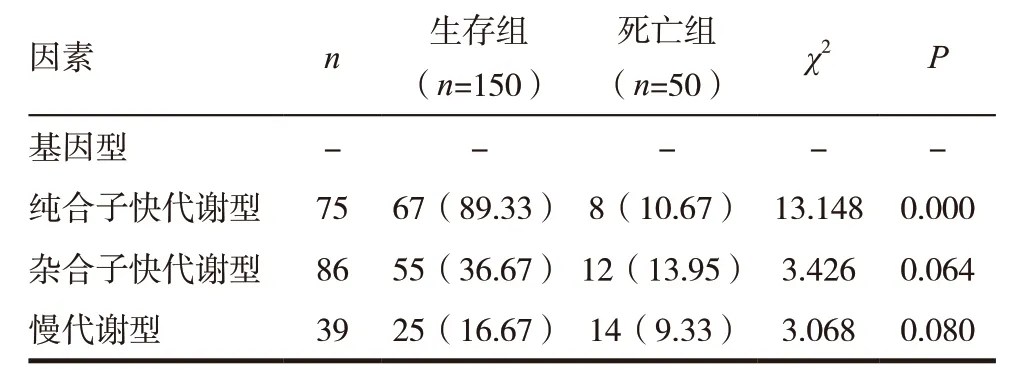
表2 CYP2C19基因多态性及Hp感染对胃癌患者生存预后的影响[n(%)]
2.3 CYP2C19基因多态性对胃癌患者Hp感染及预后的Logistic回归分析
经Logistic回归分析发现,慢代谢CYP2C19 基因型是影响胃癌患者Hp 感染及预后的危险基因型(P<0.05),见表3 ~ 4。

表3 CYP2C19基因多态性对胃癌患者Hp感染的Logistic回归分析

表4 CYP2C19的基因多态性对胃癌患者生存预后的Logistic分析
3 讨论
胃癌在我国各种恶性肿瘤中居于首位,其发生与Hp 感染、癌前病变、饮食、生活习惯、情绪、环境等多种因素有关。同时大量研究均表明Hp 感染与慢性胃炎、胃溃疡及胃癌的发病密切相关[5-7]。原因可能是由于Hp 可引起胃肠道的持续感染并诱发持续的轻度炎症反应从而导致慢性胃溃疡,随着时间的推移,可引起胃部组织的癌前病变,最终导致胃癌的发生[8-9]。且Hp 感染可加速或加重胃癌的发生发展,对患者预后产生不良影响[10]。因此对胃癌合并Hp 感染患者进行Hp 根除治疗,可有效改善患者的预后。研究发现在治疗过程中,CYP2C19 基因多态性对Hp 根治效果有显著影响[11-12]。CYP2C19可参与前致癌的活化物和致癌物质的灭活,当CYP2C19 酶活性减弱时,致癌物质在体内代谢减慢,导致其在体内堆积,增加了致癌物在体内的浓度及作用时间,从而增加了肿瘤的易感性,且由于其慢代谢作用,对癌物质灭活过慢,可影响患者的治疗,更易导致癌症的复发、转移等不良生物学行为,继而影响患者的生存质量,增加患者死亡的风险[13]。因此,不同代谢类型的CYP2C19 基因表达水平或许可作为胃癌预后的评价指标。
有学者对Hp 感染者进行了相关调查,发现慢代谢者胃癌风险较高[14],还有研究表明CYP2C19 慢代谢基因型对胃癌发生有一定促进作用[15]。本研究对胃癌合并Hp 感染及未合并Hp 感染患者进行CYP2C19 基因类型检测发现胃癌合并Hp 感染患者体内CYP2C19 慢代谢型比例显著高于未合并Hp感染者,与以往的研究[15]结果类似,表明CYP2C19慢代谢基因型与Hp 感染有关,慢代谢基因型表达水平高的患者其发生Hp 感染的可能性较高。其原因可能在于:胃癌的发生与饮食、生活习惯密切相关,如长期酗酒、吸烟、暴饮暴食等,以及情绪、环境等因素均可能导致胃癌的发生,此外真菌、细菌、毒素等感染也是引起胃癌的危险因素,而幽门螺杆菌感染是胃癌发生的最重要的因素之一。慢代谢型CYP2C19 患者体内代谢较缓慢,对外来毒素及病菌清除过程较慢,导致其在体内作用时间延长,因此增加了Hp 感染的可能。另外本研究还显示随访2年内慢代谢基因型胃癌患者死亡率显著高于另外两种基因型患者(P<0.001),而纯合子快代谢基因型与杂合子快代谢基因型间死亡率比较无显著差异(P>0.05),这表明CYP2C19 慢代谢型对胃癌患者的治疗预后有一定影响,而纯合子快代谢基因型与杂合子快代谢基因型与胃癌的治疗预后无明显影响。由此可推测慢代谢CYP2C19 表达水平较高的胃癌患者预后可能较差。其原因与慢代谢型CYP2C19 酶活性降低,对体内致癌物质的灭活作用减弱,导致致癌物质在体内堆积水平过高,对人体的作用时间相对较长有关[15]。因此提示临床对于胃癌的治疗可通过进行CYP2C19 基因型检测,来预测及评价患者的疗效,同时提示或许可针对改变不同类型的CYP2C19 基因表达水平来干预胃癌患者的治疗,对于胃癌高危因素的慢代谢型的HP 感染患者应进行正规根除HP 治疗。
综上所述,CYP2C19 基因型对胃癌合并幽门螺旋杆菌感染及预后均有密切关系,胃癌合并幽门螺旋杆菌感染患者CYP2C19 慢代谢基因型率表达较高,且CYP2C19 慢代谢基因型胃癌患者相对其他基因型的患者预后差,因此,临床可针对胃癌患者的基因型检测结果评估其疗效及预后。但本研究存在不足之处在于未结合患者的病理类型及临床分期进行分析,且缺乏大样本量的研究,以后的研究者可对此深入研究。
——早衰

