调节胆汁酸代谢及肠道菌群对非酒精性脂肪肝治疗效果研究
王 菲 王允野 张 丹 赵晓茹 刘 昆
吉林医药学院附属医院消化内科,吉林吉林 132013
随着人们饮食结构、生活习惯的改变,非酒精性脂肪性肝病(nonalcoholic fatty liver disease,NAFLD)的发病率逐年上升且呈低龄化,已成为我国乃至全球肝硬化的最主要病因之一。NAFLD 多同时伴有其他代谢性疾病,如肥胖、高脂血症、2 型糖尿病等。目前其发病机制尚未完全明确,可能与胰岛素抵抗、氧化应激及脂质过氧化损伤等机制有关[1],临床治疗上多采用降血脂、保肝、控制饮食、运动等方式,但患者依从性差,难以长期坚持。近些年,多项研究表明NAFLD 与饮食、胆汁酸水平以及肠道菌群有密切关系[2],通过调节饮食- 胆汁酸- 肠道菌群来治疗NAFLD 是目前提出的新的治疗途径,其效果如何目前缺乏实验研究,本研究应用抗生素、高脂饮食制造非酒精性脂肪肝病模型,并随机分组给予益生菌、调节胆汁酸治疗,观察比较其疗效,为NAFLD 治疗方案提供进一步实验理论支持。
1 材料与方法
1.1 材料
2017 年9 月~2018 年4 月选取SPF 级BALB/c小鼠72 只,雌雄各半,由吉林医药学院动物实验中心提供,体重(18±2)g。头孢曲松钠(湖南科伦制药有限公司,H20065642)1.0g/ 支,配成按100mg/kg 给药。高脂饲料:82.5% 普通饲料,2% 胆固醇,10%猪油,5% 蛋黄粉、0.5% 三号胆盐组成[3]。益生菌选用枯草杆菌二联活菌(北京韩美公司,S20030087)。熊去氧胆酸(德国 Dr.Falk 公司,H20181059),配成10µmol/L 溶液,胃管灌入。采用全自动血清生化仪(荷兰SelcetraXL)及南京建成生物科技有限公司试剂盒进行测试。
1.2 方法
1.2.1 实验第一部分方法 随机选取小鼠40 只,随机分为四组。10 只小鼠采用普通饲料喂养,为Ⅰ组;10 只采用高脂饲料喂养,为Ⅱ组;另外选择10只小鼠给予普通饲料喂养,并给予头孢曲松钠每日2 次经口灌入,为Ⅲ组。另10 只小鼠采用高脂饲料喂养,同时应用头孢曲松钠每日2 次经口灌入,为Ⅳ组。喂养12 周后,深度麻醉小鼠,摘眼球取血,化验甘油三酯、胆固醇、丙氨酸氨基转移酶、谷氨酰氨基转移酶、脂联素,收集小鼠粪便应用胆汁酸试剂盒检测胆汁酸水平,无菌取回盲部粪便进行肠道菌群培养进行比较,处死后称取全肝湿重并记录,取肝组织制成10% 肝匀浆,应用匀浆器匀浆,测定肝匀浆组织血脂成分。
1.2.2 实验第二部分方法 根据Ⅳ组方式喂养小鼠32 只12 周后均停用抗生素,给予普通饮食、无菌水,将其随机平均分为四组,每组8 只,一组为对照组,即A 组;8 只给予熊去氧胆酸,为B 组;另8只给予枯草杆菌二联活菌经口灌入,为C 组;其余8 只同时给予熊去氧胆酸及枯草杆菌二联活菌,为D 组。ABCD 四组小鼠均饲养12 周后深度麻醉小鼠,再次化验上述指标。
1.2.3 标本采集及处理 小鼠血清生化指标的测定:深度麻醉小鼠,摘眼球取血,将血置干燥管中,3000r/min 22℃离心10min,取上层血清,应用全自动生化检测仪检测血清中TG、TC、ALT 和AST。
1.2.4 肝匀浆血脂成分测定 测定肝匀浆组织血脂成分,制备10% 肝匀浆:取小鼠肝脏0.5g,用眼科剪在冰上尽快剪碎并倒入玻璃匀浆器中,加入4.5mL 预冷的生理盐水,将匀浆器下端插入冰水中充分研磨6 ~8min,使肝组织匀浆化。将制备好的10% 匀浆3500r/min 4℃离心10min,取上清液按同样条件再离心10min,取上清液备用。应用全自动生化检测仪检测上清液TG 和TC 含量。
1.2.5 肠道菌群定量检测 处死小鼠后无菌条件下取其盲肠内容物称重,10 倍稀释,进行平板计数,以下几种培养基进行活菌计数:乳酸杆菌选择性培养基(LBS);双歧杆菌选择性培养基(BS);肠球菌选择性培养基(EC);肠杆菌选择性培养基(EMB)。EC、EMB 平板均置于37℃有需氧培养24h 后计数;BS、LBS 平板置于37 ℃厌氧条件下培养48h 后计数。
1.2.6 粪便胆汁酸水平测定 收集小鼠粪便应用胆汁酸试剂盒检测胆汁酸水平(按说明书操作)。
表1 各组小鼠生化及粪便胆汁酸水平比较
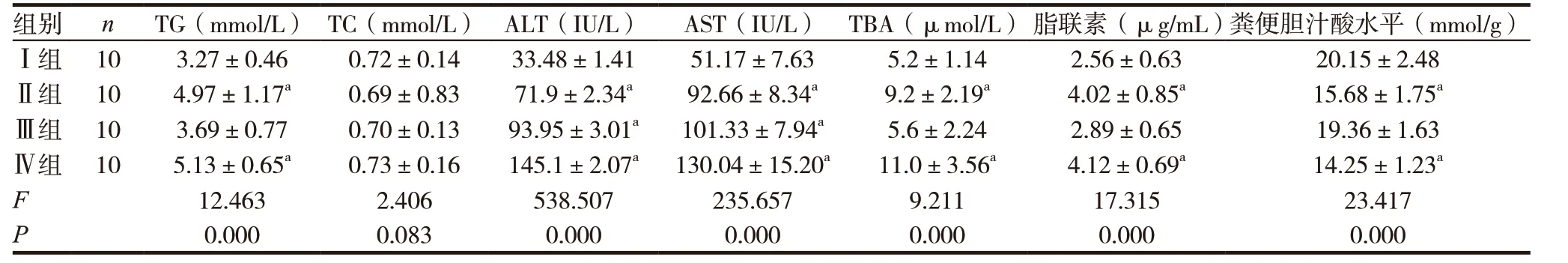
表1 各组小鼠生化及粪便胆汁酸水平比较
注:与Ⅰ组比较,aP <0.01
组别 n TG(mmol/L) TC(mmol/L) ALT(IU/L) AST(IU/L) TBA(µmol/L) 脂联素(µg/mL)粪便胆汁酸水平(mmol/g)Ⅰ组 10 3.27±0.46 0.72±0.14 33.48±1.41 51.17±7.63 5.2±1.14 2.56±0.63 20.15±2.48Ⅱ组 10 4.97±1.17a 0.69±0.83 71.9±2.34a 92.66±8.34a 9.2±2.19a 4.02±0.85a 15.68±1.75aⅢ组 10 3.69±0.77 0.70±0.13 93.95±3.01a 101.33±7.94a 5.6±2.24 2.89±0.65 19.36±1.63Ⅳ组 10 5.13±0.65a 0.73±0.16 145.1±2.07a 130.04±15.20a 11.0±3.56a 4.12±0.69a 14.25±1.23a F 12.463 2.406 538.507 235.657 9.211 17.315 23.417 P 0.000 0.083 0.000 0.000 0.000 0.000 0.000
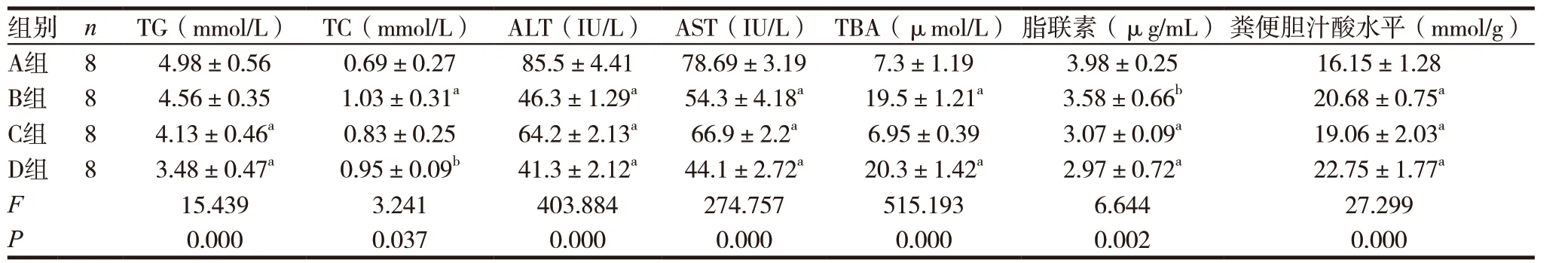
表2 各组小鼠生化及粪便胆汁酸水平
1.3 统计学处理
采用 SPSS20.0 统计软件对数据进行统计分析,计量资料以()表示,两组间比较采用t检验,P<0.05 为差异有统计学意义。
2 结果
2.1 各组小鼠一般状态
各组无死亡,Ⅰ组小鼠食欲好,毛发光泽度好,精神状态良好,Ⅱ组小鼠体重增长明显,Ⅲ、Ⅳ组小鼠出现精神萎靡不振,毛色粗糙,行动迟缓,伴有腹泻,Ⅳ组小鼠症状更加明显。
2.2 各组生化指标比较
2.2.1 各组小鼠生化及粪便胆汁酸水平比较 Ⅱ、Ⅳ组TG、TBA、脂联素较Ⅰ组均明显升高,粪便胆汁酸水平明显下降,比较差异有统计学意义(P<0.01)。Ⅱ、Ⅲ、Ⅳ组ALT、AST 水平均较Ⅰ组升高,差异有统计学意义(P<0.01),其中Ⅳ组升高最明显。见表1。
2.2.2 各组小鼠生化及粪便胆汁酸比较 C、D 组TG、脂联素较A 组均有明显下降,B、D 组TBA 较A 组明显升高,比较差异有统计学意义(P<0.01)。B、C、D 组ALT、AST 较A 组均有明显改善,粪便胆汁酸水平较A 组均升高,比较差异有统计学意义(P<0.01),D 组相关指标改善最明显。见表2。
2.3 各组小鼠肝组织匀浆检测结果分析
Ⅱ、Ⅲ、Ⅳ组TG,Ⅱ、Ⅳ组TC,与Ⅰ组比较差异有统计学意义(P<0.01)。B、C、D 组TG 较A 组明显下降,差异有统计学意义(P<0.01),D 组TC 较A 组下降,差异有统计学意义(P<0.05)。见表3。
表3 各组肝组织匀浆血脂成分(mmol/L)
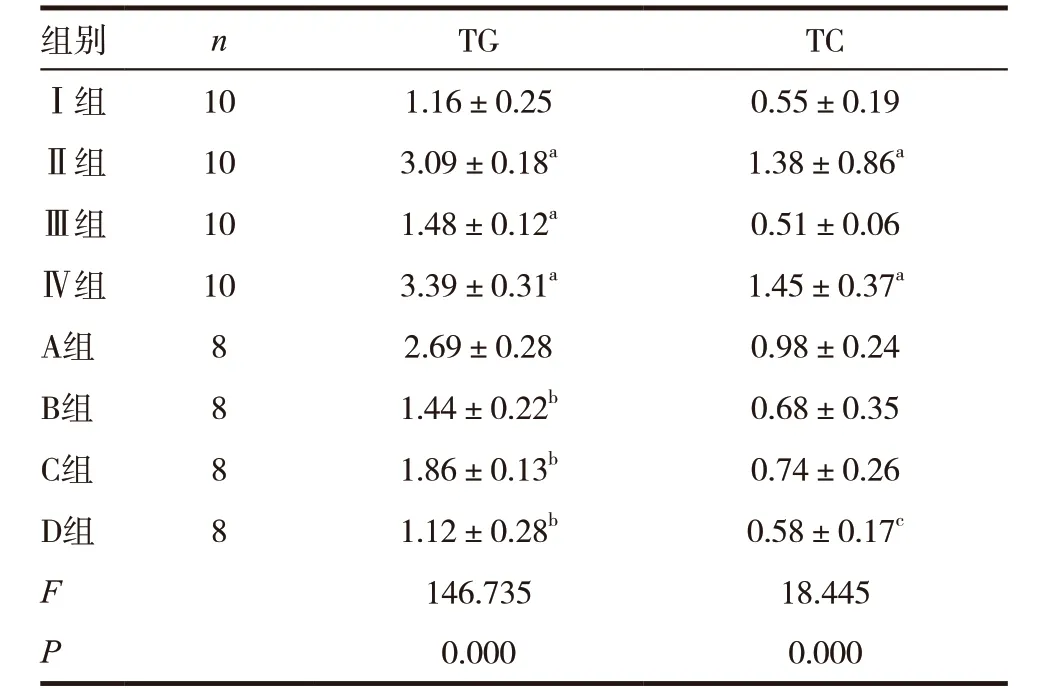
表3 各组肝组织匀浆血脂成分(mmol/L)
注:与Ⅰ组比较,aP <0.01,与A 组比较bP <0.01,cP <0.05
组别 n TG TCⅠ组 10 1.16±0.25 0.55±0.19Ⅱ组 10 3.09±0.18a 1.38±0.86aⅢ组 10 1.48±0.12a 0.51±0.06Ⅳ组 10 3.39±0.31a 1.45±0.37a A组 8 2.69±0.28 0.98±0.24 B组 8 1.44±0.22b 0.68±0.35 C组 8 1.86±0.13b 0.74±0.26 D组 8 1.12±0.28b 0.58±0.17c F 146.735 18.445 P 0.000 0.000
2.4 各组小鼠肠道菌群检测结果分析
Ⅲ、Ⅳ组双歧杆菌、乳酸杆菌、肠杆菌水平较Ⅰ组下降,而肠球菌水平升高,差异有统计学意义(P<0.01)。B、C、D 组双歧杆菌、乳酸杆菌,C、D 肠杆菌较A 组均明显升高,差异有统计学意义(P<0.01),B、C、D 组肠球菌与A 组比较无明显变化。见表4。
3 讨论
随着科学技术的发展、全球经济化的推进,人们的生存环境、饮食结构、生活习惯等发生了巨大变化,过去人们主要死亡原因是传染病、感染性疾病,而如今慢性非传染性疾病发病率逐年上升。肥胖、非酒精性脂肪肝、糖尿病、高脂血症、高尿酸血症等代谢性疾病跃居疾病谱前列。非酒精性脂肪性肝病是指排除饮酒、药物、机械等损肝因素导致大量肝细胞发生脂肪变性,从单纯脂肪变性逐渐发展到脂肪性肝炎、肝纤维化、肝硬化及其并发症。NAFLD 是多种因素共同作用结果,其发病机制除了饮食、环境、遗传等因素外,还与胰岛素抵抗、氧化应激和脂质过氧化、胆汁酸代谢、自噬、肠道菌群等因素有密切关系[1]。目前治疗多采用保肝、饮食控制、增加运动量等治疗方法,本文通过其病因发病机制,探讨通过调节胆汁酸代谢及肠道菌群,对NAFLD 治疗的效果。
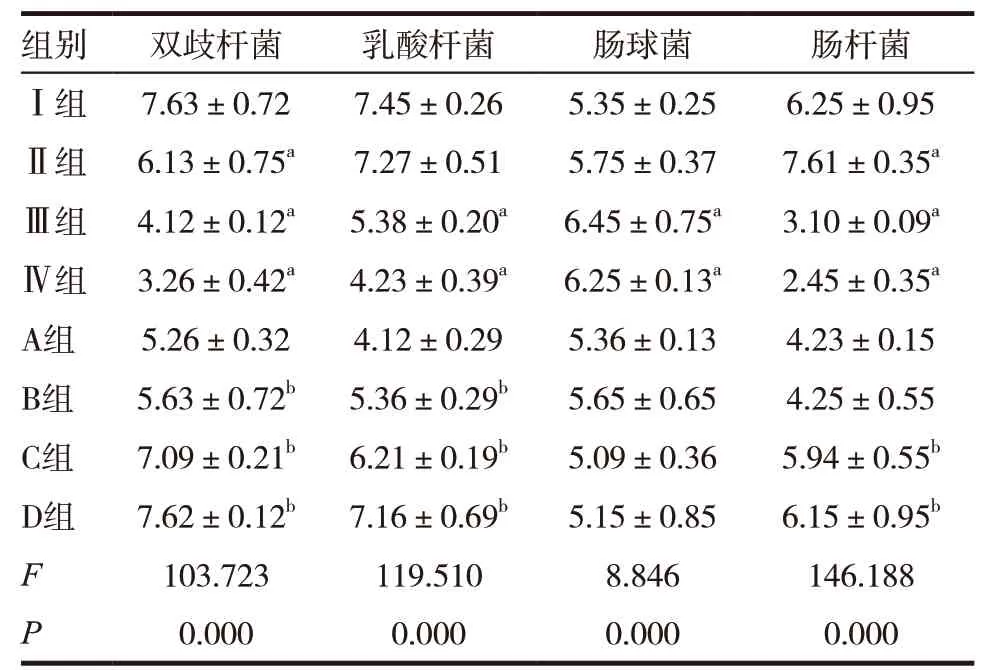
表4 各组肠道菌群定量检测结果比较
人体肠道内有大量微生物,称为肠道菌群,其数量可达1014,被称为“人体最大的器官”。肠道菌群不仅数量巨大,种类也非常丰富,是一个复杂的微生态系统,肠道菌群的主要功能包括分解碳水化合物,参与机体维生素的合成,促进各种离子的吸收,产生有机酸维持肠道内环境适合的pH 等。另外肠道菌群通过营养、肠道上皮细胞黏附位点的竞争以及产生抗菌物质等机制发挥屏障功能,抵御外来菌的定殖。通过观察无菌小鼠及非无菌小鼠相同食物消耗情况,体重变化,以及给无菌小鼠定植正常小鼠盲肠内容物引起即使摄入食物少也会造成脂肪累积、血脂变化等实验,显示肠道菌群在能量摄取转化方面起重要作用[4-5]。肠道的血流经门静脉系统进入肝脏,可使致病菌和LPS 大量移位损伤肝功能,反之肝脏功能异常,通过胆汁分泌和肠肝循环引起肠道功能紊乱,它们之间的病理生理联系称为“肠- 肝轴”。慢性肝炎、肝硬化、原发性肝癌患者降低肠道清除能力,增加外来菌的粘附机会,且影响肠道PH 值,导致细菌过度生长。大量研究表明,肠道菌群在非酒精性脂肪性肝炎(NASH)的发生中起重要作用[6]。Wigg 等[7]实验研究发现50%NASH 患者存在小肠细菌过度生长。Farhadi 等[8]通过研究发现NASH 的发生发展与肠道通透性之间的关系。
本研究通过高脂饮食及头孢曲松钠诱导NAFLD 小鼠模型,观察Ⅱ、Ⅳ组小鼠,TG、TBA、脂联素均明显升高,粪便胆汁酸水平明显下降,差异有统计学意义(P<0.01)。实验组ALT、AST 水平均较对照组升高,差异有统计学意义(P<0.01)。肝匀浆血脂成分Ⅱ、Ⅲ、Ⅳ组TG,Ⅱ、Ⅳ组TC,与对照组比较差异有统计学意义(P<0.01),提示高脂饮食及抗生素可引起肝内血脂成分显著升高,肝脏出现弥漫性脂肪变性,肝功转氨酶水平升高,引起NASH。比较各组肠道菌群变化,Ⅲ、Ⅳ组双歧杆菌、乳酸杆菌、肠杆菌下降明显,肠球菌水平升高,差异有统计学意义(P<0.01)。实验表明肠道菌群失调可加重肝脏损害。Li 等[9]应用混合益生菌治疗ob/ob 小鼠,能够有效改善肝组织学,降低肝总脂肪酸含量,并能降低ALT 的水平,证实益生菌能够治疗NAFLD。本实验应用枯草杆菌肠球菌二联活菌后,小鼠肠道菌群改善,血脂及肝脏相关指标也有所好转,说明改善肠道菌群能有有效治疗NAFLD。目前研究认为,肠道菌群失调引起NAFLD 的机制:(1)增加能量摄入导致肥胖[4],进而引起一系列代谢性疾病;(2)改变肠道的通透性,产生低度炎症;(3)肠道微生物有害产物通过“肠-肝轴”,导致肝损害等。此外,还认为肠道微生物有调节饮食胆碱代谢、胆汁酸代谢[10]及增加内源性乙醇来发挥作用。
胆汁酸是胆汁的重要组成成分,是胆固醇的终末降解产物,在脂肪代谢中起重要作用,且能够调节胆固醇的水平。胆汁酸在肝脏合成后进入胆囊,在胆囊中储存浓缩5 ~ 10 倍,食物可引起胆囊收缩,驱动胆汁酸的肠肝循环[11]。各种形式胆汁酸在肠道发挥不同的生理功能,在肠道菌群作用下,发生转化,并按主动运输或被动运输机理大约 95% 的胆汁酸被重吸收,只有大约5% 的胆汁酸随食物残渣排出,丢失的胆汁酸则通过胆汁酸的合成补充。胆汁酸的代谢多由核受体FXR 和G 蛋白偶联受体TGR5 介导,这种作用的具体机制目前还不是很清楚,研究表明,胆汁酸除促进脂溶性物质消化外,还是通过直接或间接激活法尼醇X 受体(farnesoid X receptor,FXR)和G 蛋白偶联胆汁酸受体5(G protein coupledbile acid receptor 5,TGR5)在 葡 萄糖和脂质代谢中发挥作用[12]。目前认为胆汁酸与高血脂、肥胖、糖尿病等代谢性疾病有着密切关系。基于胆汁酸肠- 肝循环,本实验通过经胃灌注熊去氧胆酸,调节胆汁酸水平,观察对NAFLD 小鼠肝脏的影响。观察发现,熊去氧胆酸可以改善小鼠的肝脏功能及脂肪变性相关指标。Bechmann 等[13]对113 名NAFLD 患者进行研究,发现随着体内游离脂肪酸水平的升高,CYP7A1 和胆汁酸转运体钠离子/ 牛磺胆酸盐同向转运器(Na+/taurocholate cotransporter,NTCP)的表达水平提高,提示胆汁酸的合成速率和血浆中的胆汁酸浓度与NAFLD 严重程度相关。
肠道菌群对胆汁酸的转化必不可少,肠道细菌数量增加,刺激FXR 或TGR5 的表达,抑制胆汁酸的合成。不同肠道菌属,也影响胆汁酸的代谢,肠道中的厚壁菌属和放线菌属刺激胆汁酸合成,而拟杆菌属和变形杆菌属则抑制胆汁酸合成。胆汁酸是一种抑菌活性物质,能够抑制细菌生长增殖,可以显著影响肠道菌群的生长和组成。在胆汁淤积及终末期肝病患者中,肠道中的胆汁酸含量降低,造成细菌过度生长[14]。给予肝硬化大鼠胆汁酸,提高肠道胆汁酸浓度,会抑制肠道细菌过度生长,减少细菌移位的发生[15]。WAHLSTRÖM A[16-17]等进行的实验研究表明,给无菌小鼠,接种人类肠道菌群后,可抑制小鼠胆汁酸的合成。小鼠口服1.25 ~5.00mmol/kg的胆汁酸,改变小鼠胆汁酸水平,其肠道菌群种类比例也发生变化,厚壁菌属由54% 升高至94% ~98%,而拟杆菌和放线菌比例显著降低[18-19]。Boulange 等[20]研究发现肠道微生物能减少肠道胆汁酸重吸收,使粪便胆汁酸排泄增加。Degirolamo 等[21]应用混合益生菌喂饲小鼠,结果发现,混合益生菌能够显著增加肠道中厚壁菌属和放线菌属的数量,降低拟杆菌属和变形杆菌属的数量,增加粪便中胆汁酸的排出量,降低肠道FGF 的表达水平,提高CYP7A1 和CYP8B1 的活性,从而增加肝脏胆汁酸的产量。
大量动物实验和临床研究表明,在肠道菌群失衡或胆汁酸代谢紊乱的情况下,肠道菌群、胆汁酸代谢和NAFLD 构成相互影响的恶性循环。Devkota等[22] 的研究表明,饮食中的脂肪酸能够通过改变胆汁酸池中的胆汁酸成分,进而使肠道菌群发生改变。经抗生素处理后肠道菌群减少,肠道胆汁酸重吸收增加,粪便中胆汁酸排泄显著减少[23]。本实验给予脂肪肝小鼠益生菌和熊去氧胆酸,调节肠道菌群及胆汁酸水平,观察表明可有效改善肝脏功能及血脂水平,促进肝细胞修复。
总之,由于非酒精性脂肪肝的发病率增加,对其治疗成为目前研究的热点,有学者[17]提出肝脏-胆汁酸- 肠道微生态轴的概念,通过调节饮食- 胆汁酸- 肠道菌群来治疗非酒精性脂肪肝是目前提出的新的治疗途径。本实验观察发现通过调节肠道菌群及胆汁酸水平可以有效改善肝脏脂质代谢及炎症反应,对非酒精脂肪肝新的治疗方案提供实验理论支持。

