胰腺神经内分泌肿瘤37例临床特征分析和远期生活质量分析
唐雨辰 杨 健
苏州大学附属第一医院普通外科 苏州大学附属第一医院胰腺疾病研究中心,江苏苏州 215006
胰腺神经内分泌肿瘤(pancreatic neuroendocrine neoplasms,pNENs)是一种起源于胰腺神经内分泌细胞的少见肿瘤,仅占原发性胰腺肿瘤的1% ~2%,但近年来由于检测手段的提高,生活方式的改变,其发病率呈逐渐增加的趋势[1]。pNENs按照是否产生临床症状,可分为无功能性神经内分泌肿瘤和有功能性神经内分泌肿瘤,包括胰岛素瘤、胃泌素瘤、胰高血糖素瘤、血管活性肠肽瘤、生长抑素瘤等[2]。由此可见,pNENs 种类繁多,临床表现复杂多变并且病理特征、恶性程度和预后差异程度较大,给疾病的诊断及治疗带来了极大的难度。因此对于pNENs 的研究迫在眉睫,而国内关于pNENs 的临床研究尚不够全面透彻。本研究回顾性分析了我院2013 年1 月~2018 年7 月间收治的37 例pNENs 患者的临床资料,对其外科诊治方法进行总结分析。
1 资料与方法
1.1 一般资料
将2013 年1 月~2018 年7 月苏州大学附属第一医院收治的37 例pNENs 患者纳入研究范围,所有病例均经手术及病理证实。其中男21 例,女16 例;年龄19 ~73 岁,平均46 岁。其中无功能性肿瘤28 例及功能性肿瘤9 例(均为胰岛细胞瘤)。本研究通过我院伦理委员会审批。患者及家属术前均签署手术知情同意书。
1.2 诊断标准
根据2013 年中国胃肠胰神经内分泌肿瘤病理诊断共识[3]和2017 年世界卫生组织(WHO)制定的胰腺神经内分泌肿瘤分类[4]对pNENs 患者的临床资料和病理诊断进行分类、分级。根据2017 年美国癌症研究联合会(AJCC)第8 版指南[5]进行pNENs 的肿瘤分期。
1.3 研究方法
回顾性分析本研究中37 例pNENs 患者的临床特征、肿瘤大小及部位、肿瘤标志物检测、影像学特征、手术方式、病理特点等,总结pNENs 的临床特点及病理特征,分析诊治pNENs 的关键因素。
1.4 随访
采用门诊复查和电话方式进行随访,随访频率每3 个月一次,随访时间截止至2019 年1 月1 日。术后生活质量使用EORTC QLQ-C30 量表(欧洲癌症患者生活质量评估量表)[6],指标包括躯体功能,角色功能,情绪功能,认知功能,社会功能,总体健康,采用100 分制评分。
1.5 统计学处理
应用SPSS25.0 和Prism 7 软件进行统计分析作图。正态分布的计量资料用()表示,组间比较采用t检验;计数资料比较采用χ2检验;生存分析及单因素分析采用Kaplan-Meier分析及Log-Rank检验。P<0.05 为差异有统计学意义。
2 结果
2.1 临床表现
本研究中37 例pNENs 患者功能性肿瘤9 例(24.32%),无功能性肿瘤28 例(75.68%),均行根治手术治疗。根据AJCC 第8 版TNM 肿瘤分期,I、Ⅱ、Ⅲ、Ⅳ期患者分别为19 例(51.35%)、13 例(35.14%)、3 例(8.11%)、2 例(5.41%)。根据WHO2017 版分级标准,G1、G2、G3 级肿瘤患者分别为19 例(51.35%)、12 例(32.43%)、6 例(16.22%)。病理类型:胰腺神经内分泌瘤27 例,神经内分泌癌10 例。
28 例无功能pNENs 患者主要临床表现为中上腹腹胀伴或不伴腹痛(14 例)、腰背部疼痛(6 例)、腹部包块(5 例)、食欲下降(7 例)、体重下降伴乏力(6 例)等;9 例胰岛细胞瘤主要症状为反复出现的心悸、晕厥及大汗等低血糖反应,可通过对症处理缓解症状。本研究肿瘤指标中CA199 有5 例升高,CEA 升高者仅2 例,而CA125 均未超过正常值。
2.2 影像学检查
目前对于pNENs 主要影像学诊断包括腹部B超、超声内镜以及CT/MRI。本研究中有13 例行B超检查均提示胰腺局部增大或肿物,回声不均匀。34 例行增强CT 检查,其中有29 例发现胰腺占位,提示增强后强化不均匀(见图1)。18 例行增强MR检查,呈长T1 长T2 信号影,DWI 呈高信号,动脉期病灶强化稍高于正常胰腺组织,门脉期及延迟期病灶强化减低,可发现<2cm 的肿瘤(见图2)。有2例CT 未能发现的,经过超声内镜检查后均发现了胰腺肿瘤。
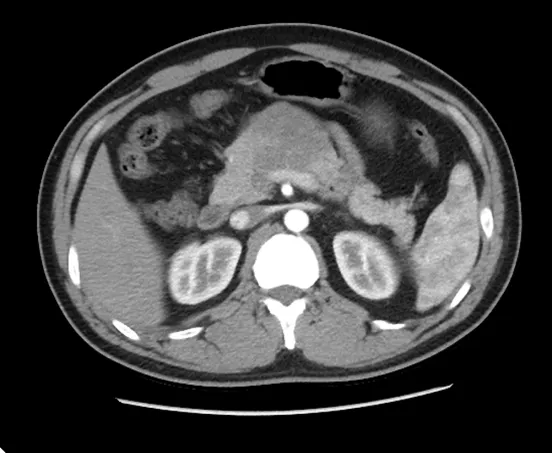
图1 术前CT 检查增强CT 可见胰头部肿瘤,边界清,强化不均匀,胰头增大

图2 术前MR 检查增强MR 可见胰头部肿瘤包膜不均质强化,胰头体积增大
2.3 手术治疗
37 例pNENs 患者均行胰腺根治术,包括10 例胰体尾切除术,2 例胰腺肿瘤剜除术,1 例腹腔镜下保留脾脏的胰体尾切除术,2 例胰腺中段切除术,21 例胰十二指肠切除术,1 例保留幽门的胰十二指肠切除术。术后出现腹腔内出血4 例,其中2 例经保守治疗后好转,另2 例经手术治疗后好转,胰瘘8 例(A 级5 例,B 级2 例,C 级1 例),胆瘘1 例,腹腔感染2 例,胃排空障碍3 例,血糖控制差6 例,二次手术2 例。
2.4 病理检查
本组肿瘤位于胰腺头部11 例,中段5 例,体尾部19 例,壶腹部2 例。直径≤20mm 者13 例,直径>20mm 者24 例。术后病理均诊断为胰腺内分泌肿瘤(图3)。NSE(+)者31 例,Syn(+)者35 例,CgA(+)29 例。
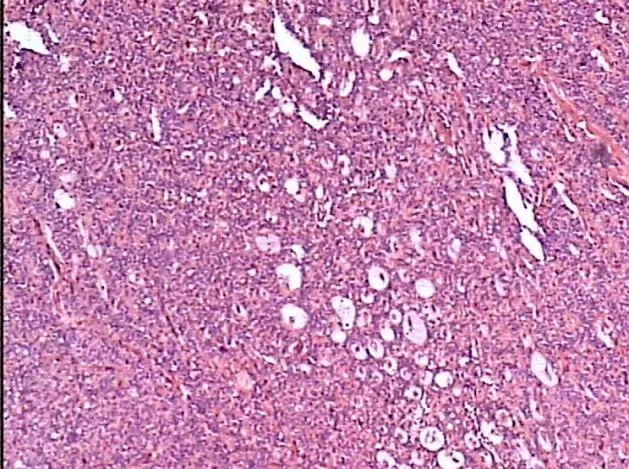
图3 术后病理组织学检查(HE,×100)肿瘤细胞染色均匀,肿瘤排列呈梁索状、假菊团状
2.5 随访结果
患者术后每3 个月至门诊复查胸腹部CT 及肿瘤指标。37 例患者均获得随访数据,随访时间6 ~68 个月,平均随访时间36 个月。其中32 例存活,另3例因肿瘤肝转移死亡,1例因肺部疾患死亡,2 例死因不明。对随访患者进行生存相关单因素分析,发现肿瘤分级、TNM 分期、有无区域淋巴结转移与患者预后有关(P<0.05)(见表1)。肿瘤分级和TNM 分期相关生存曲线分别(见图4 ~ 5)。对有功能pNENs 与无功能pNENs 患者行远期生活质量评估对比,发现其差异无统计学意义(P>0.05),但平均得分较高,术后生活质量尚可(见表2)。
3 讨论
胰腺神经内分泌肿瘤(pNENs)起源于弥漫性神经内分泌细胞,是胰腺的临床罕见疾病。pNENs仅占所有胰腺肿瘤的1% ~ 2%,尽管这种肿瘤很罕见,但其在过去几十年中发病率增加了两倍多,这可能与影像诊断技术的提升有很大关系[7]。根据是否存在内分泌激素产生的临床症状,pNENs被分类为功能性和无功能性两大类。其中功能性pNENs 会产生不同的特定激素包括胃泌素、胰岛素、胰高血糖素、生长抑素、血管活性肠肽(VIP)、生长激素因子和促肾上腺皮质激素等而产生一系列相应的综合征,因而功能性pNENs 患者的诊断时间(平均年龄55 岁)早于非功能性pNENs 患者(平均年龄59 岁)[8]。此外,无功能性pNENs 大约占pNENs 的40% ~ 90%[9]。因此,对于pNENs 的诊断和治疗对于临床医生是一项巨大的挑战。
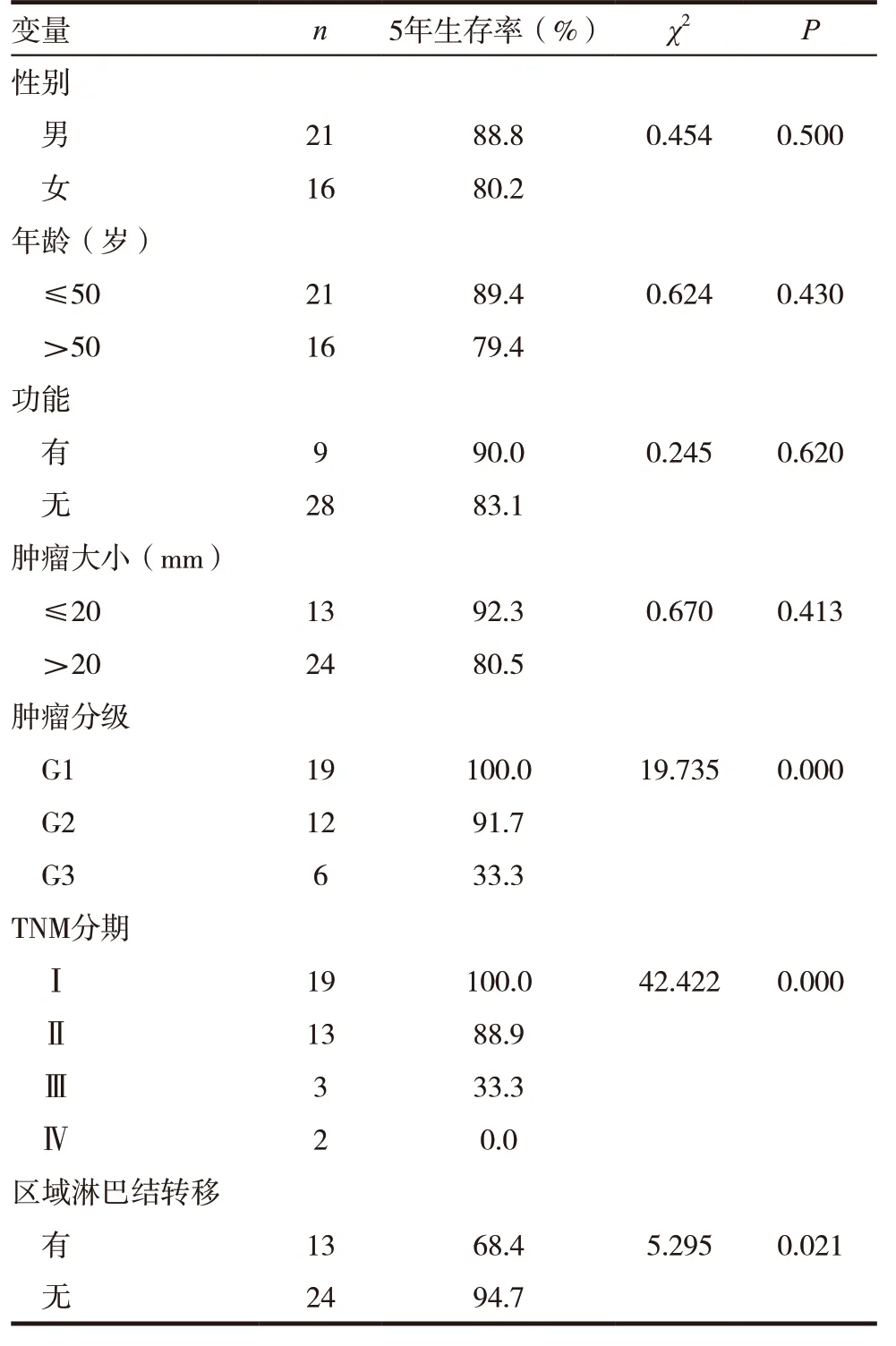
表1 37例患者术后生存相关单因素分析
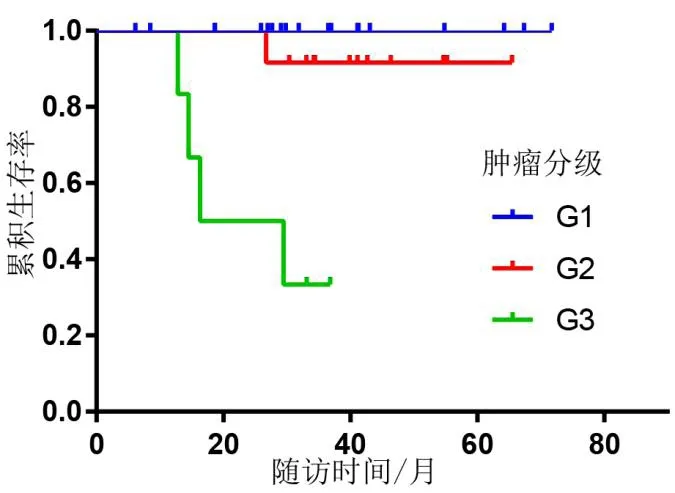
图4 肿瘤分级的相关生存曲线
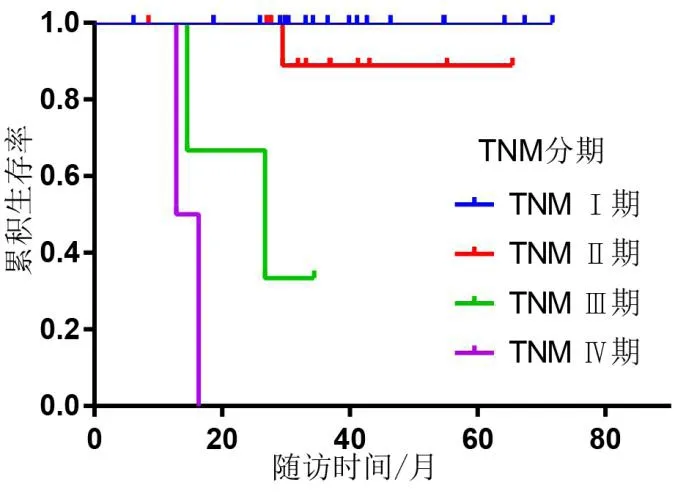
图5 TNM 分期的相关生存曲线
表2 无功能与有功能pNEN患者远期生活质量评估比较(,分)
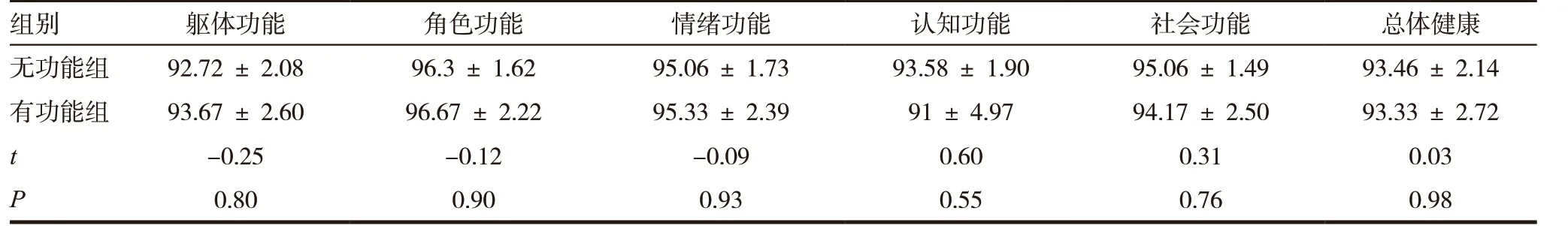
表2 无功能与有功能pNEN患者远期生活质量评估比较(,分)
组别 躯体功能 角色功能 情绪功能 认知功能 社会功能 总体健康无功能组 92.72 ± 2.08 96.3 ± 1.62 95.06 ± 1.73 93.58 ± 1.90 95.06 ± 1.49 93.46 ± 2.14有功能组 93.67 ± 2.60 96.67 ± 2.22 95.33 ± 2.39 91 ± 4.97 94.17 ± 2.50 93.33 ± 2.72 t-0.25 -0.12 -0.09 0.60 0.31 0.03 P 0.80 0.90 0.93 0.55 0.76 0.98
pNENs 的分类和分期并不统一,并且经历了大量的变化。到目前为止,pNENs 有三个指南被广泛使用,包括世界卫生组织(WHO)分级方案,欧洲神经内分泌肿瘤学会(ENETS)分类[10]和美国癌症联合会(AJCC)分期系统。
本组研究中有28 例无功能性神经内分泌肿瘤和9 例胰岛细胞瘤。胰岛细胞瘤也是最常见的功能性神经内分泌肿瘤[11],大多会产生Whipple 三联征。而无功能性的pNENs 在早期缺乏特异性症状和体征,肿瘤不易被发现,多是偶然体检发现或触及腹部包块和局部压迫周围器官引起相应症状,如皮肤黄染、腹部胀痛、纳差乏力等[12]。
此外,影像学检查对于pNENs 的诊断极其重要。目前用于检测pNENs 的成像技术包括形态学和功能成像技术,例如多普勒超声成像(B 超)、计算机断层扫描(CT)、磁共振成像(MRI)、超声内镜(EUS)、生长抑素受体闪烁扫描(SRS)和正电子发射断层扫描(PET)。B 超是最常用的检测技术,但多用于疾病的筛查。而CT/MRI 是用于诊断pNENs的首选技术,CT 的平均灵敏度和特异性分别为73%和96%。但对于肝转移瘤,MRI 具有更高的平均检出率(82%)[13]。一般来说,由于改善的组织对比度,放射学专家倾向于使用MRI 而不是CT 来对肝脏和胰腺进行成像[14]。此外,CT/MRI 在直径<2cm的小肿瘤中灵敏度会有所降低[15]。超声内镜(EUS)因为可以产生高分辨率成像,适用于检测小尺寸(2 ~ 5mm)pNENs,平均检出率超过90%,并且对于局部淋巴结转移也有独特的优势[16]。本研究中就有2 例病例因直径较小未能被CT 发现,而通过超声内镜发现。大多数pNENs 表达高水平的生长抑素受体,主要是生长抑素受体2 型(SSTR2),因此可以用放射性标记形式的生长抑素类似物奥曲肽(SRS)成像。用于PET/CT 成像的用正电子发射放射性核素68Ga 标记的一类新的生长抑素类似物已成为NETs 目前的黄金标准[17]。
除了影像学检查,某些肿瘤标志物,包括血清肿瘤标志物和免疫组织化学肿瘤标志物,可用于诊断和预后,特别是对于非功能性pNENs。其中血浆嗜铬粒蛋白A(CgA)是最广泛使用的血清标记物,其在88% ~ 100%的pNENs 中升高。其他血清标志物还包括血浆神经元特异性烯醇化酶(NSE),胰多肽(PP),胰蛋白酶抑制剂和人绒毛膜促性腺激素亚基[18]。本研究中NSE(+)者31 例(83.78%),Syn(+)者35 例(94.59%),CgA(+)29 例(78.38%)。而常用的肿瘤指标CEA、CA199、CA125 等多无明显增高,对于pNENs 无特异性。此外,对于功能性pNENs,特定肽可以用作诊断pNENs 的标志物,例如胰岛素和胰高血糖素、胃泌素等。
对于确诊pNENs 的患者,手术仍是当前的首选治疗方案。手术方案的选择主要根据病灶的位置、大小、有无局部浸润、有无远处转移等。对于可切除的局部复发病灶、孤立远处转移灶、或发病时不可切除的pNENs,经综合治疗后转化为可切除的病灶时,如果患者一般情况允许,均考虑手术治疗。本研究中所有病人均行根治性手术治疗,包括10例胰体尾切除术,2 例胰腺肿瘤剜除术,1 例腹腔镜下保留脾脏的胰体尾切除术,2 例胰腺中段切除术,21 例胰十二指肠切除术,1 例保留幽门的胰十二指肠切除术。对肿瘤直径>2.0cm 且伴淋巴结及相邻脏器浸润转移者,无论有无功能,均应常规行淋巴结清扫[19]。pNENs 患者有半数以上存在肝转移,如肝转移患者不进行治疗,5 年生存率仅30% ~ 40%。对于无法手术切除的局部晚期或转移性pNENs,可选择使用生长抑素类似物治疗,例如包括奥曲肽和兰瑞肽等,其疾病控制率可达50% ~60%[20]。
我们对于患者的远期生活质量进行评估,并分为有功能组和无功能组进行比较,发现在躯体功能、角色功能、情绪功能、认知功能、社会功能和总体健康6 个方面的差异无统计学意义,但患者平均得分均较高,这可能与肿瘤良恶性程度及患者均行根治术有关。对于远期生活质量的评估还需要更多的病例进行统计学分析。
综上所述,pNENs 患者的临床表现多样,大多无特异性,诊断方法复杂,易被误诊和漏诊。因此,应寻找更多特异性指标,提高早期诊断率,并进行多学科综合诊疗,个体化地制定手术治疗方案,改善预后,提高患者的远期生活质量。

