特布他林联合布地奈德治疗慢性阻塞性肺疾病对炎症因子及炎症介质的影响
李柱棠 颜运明 杜宝民
南方医院太和分院内科,广东广州 510540
慢性阻塞性肺疾病是一种常见的慢性呼吸系统疾病,有极高的发病率和病死率,且发病率呈逐年上升趋势[1-3]。慢性阻塞性肺疾病的发病与疾病进展与免疫密切相关,雾化吸入治疗慢性阻塞性肺疾病具有广泛的应用前景[4-6]。硫酸特布他林雾化液与吸入用布地奈德混悬液均是雾化吸入治疗慢性阻塞性肺疾病的理想剂型。然而,目前有关特布他林联合布地奈德治疗慢性阻塞性肺疾病的临床研究鲜有报道,其作用机制尚不明确。为此,我院开展本研究旨在探讨特布他林联合布地奈德治疗慢性阻塞性肺疾病对炎症因子及炎症介质的影响,为临床治疗慢性阻塞性肺疾病提高科学依据。
1 资料与方法
1.1 一般资料
本研究经过南方医院太和分院伦理学委员会批准。选取2016 年1 月~2018 年12 月我院新诊断慢性阻塞性肺疾病患者80 例,按随机数字表法分为观察组和对照组,每组40 例。观察组男32 例,女8 例;年龄48 ~79 岁,平均(66.5±5.2)岁;病程1 ~3 年,平均(1.87±0.24)年。对照组男30 例,女10 例;年龄48 ~80 岁,平均(66.5±5.3)岁;病程1 ~3 年,平均(1.84±0.27)年。两组患者一般资料比较,差异无统计学意义(P>0.05),具有可比性。
1.2 诊断标准
参照慢性阻塞性肺疾病全球倡议机构制定《慢性阻塞性肺疾病诊断、治疗和预防的全球策略(2016 年)》中慢性阻塞性肺疾病的诊断标准[7-8]。
1.3 病例入选标准
1.3.1 纳入标准 符合上述诊断标准;近3 个月未使用过糖皮质激素;近期未参加过其他临床研究;知情并签署知情同意书。
1.3.2 排除标准 妊娠期及哺乳期妇女;哮喘、呼吸衰竭等疾病患者;近1 个月全身感染。
1.3.3 其他标准 符合脱落、剔除、终止、中止和退出标准。
1.4 治疗方法
对照组给予2.00mL:5.00mg 硫酸特布他林 雾 化 液(AstraZenecaAB,H20140108)雾 化 吸入,3 次/d,连续治疗2 个月。 观察组在此基础上给予2.00mL:2.00mg 吸入用布地奈德混悬液(AstraZeneca Pty Ltd,H20140474)雾化吸入,2 次/d,连续治疗2 个月。
1.5 观察指标
基线期与治疗后2 个月(治疗后)测定患者FEV1、FEV1 predicted、FEV1/FVC[9-10]。
基线期与治疗后抽取患者清晨肘静脉血4mL,采用全自动生化分析仪及其配套试剂测定患者血清EOS、CRP、IL-2、CD3、CD4、CD8 水平。
1.6 统计学方法
所有数据均经SPSS20.0 统计学软件进行处理。计量资料若呈正态分布,组间比较采用独立样本t检验,以()表示;计数资料采用χ2检验,以[n(%)] 表示;检验水准α=0.05。
2 结果
2.1 试验完成情况
观察组和对照组中无一例剔除、脱落。因此,80 例纳入全分析集(full analysis set,FAS),80 例纳入符合方案集(per protocol set,PPS)。
2.2 基线期与治疗后两组肺功能指标比较
基线期,两组FEV1、FEV1 predicted、FEV1/FVC比较,差异无统计学意义(P>0.05);治疗后,观察组FEV1、FEV1 predicted、FEV1/FVC 显著高于对照组,差异具有统计学意义(P<0.05)。见表1。
2.3 基线期与治疗后两组血清EOS、CRP、IL-2水平比较
基线期,两组血清EOS、CRP、IL-2 水平比较,差异无统计学意义(P>0.05);治疗后,观察组血清EOS、CRP 水平显著低于对照组,观察组血清IL-2 水平显著高于对照组,差异有统计学意义(P<0.05)。见表2。
2.4 基线期与治疗后两组T细胞亚群比较
基线期,两组血清血清CD3、CD4、CD8、CD4/CD8 水平比较,差异无统计学意义(P>0.05);治疗后,观察组血清CD3、CD4、CD8、CD4/CD8 水平显著高于对照组,差异有统计学意义(P<0.05)。见表3。
3 讨论
慢性阻塞性肺疾病是一种以持续气流受限为特征的疾病,疾病发展过程伴有不完全可逆的气流受限,气流受限的病理学基础是气道对不同有害颗粒和气体刺激引发的异常炎症反应[11-12]。硫酸特布他林雾化液通过雾化器给药,其活性成份为特布他林,特布他林通过选择性兴奋β2受体,从而扩张支气管、增加黏液纤毛清洁功能、加速黏液分泌物的清除,进而减轻气流阻塞、气道高反应性,续而发挥治疗慢性阻塞性肺疾病的作用[13]。由此,本试验经过多方面考量,最终选取已被临床广泛用于治疗慢性阻塞性肺疾病的支气管舒张药、黏液溶解剂——特布他林作为常规用药,与布地奈德作对照。
表1 基线期与治疗后两组肺功能指标比较
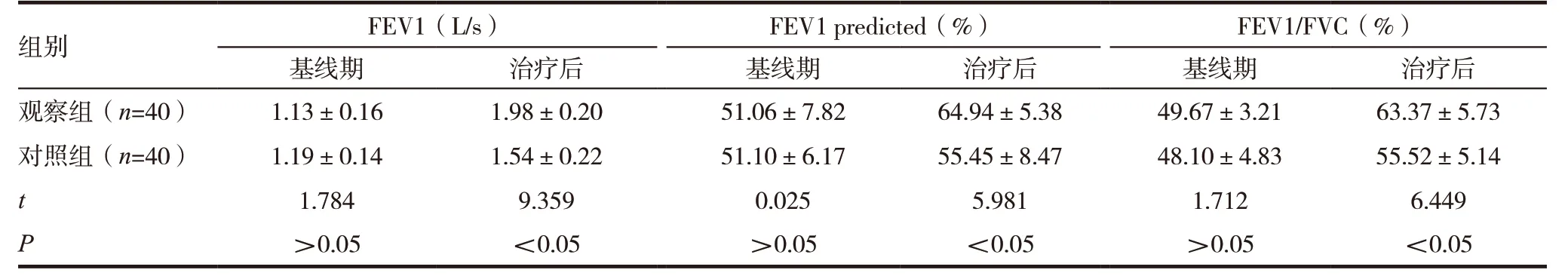
表1 基线期与治疗后两组肺功能指标比较
组别 FEV1(L/s) FEV1 predicted(%) FEV1/FVC(%)基线期 治疗后 基线期 治疗后 基线期 治疗后观察组(n=40) 1.13±0.16 1.98±0.20 51.06±7.82 64.94±5.38 49.67±3.21 63.37±5.73对照组(n=40) 1.19±0.14 1.54±0.22 51.10±6.17 55.45±8.47 48.10±4.83 55.52±5.14 t 1.784 9.359 0.025 5.981 1.712 6.449 P>0.05 <0.05 >0.05 <0.05 >0.05 <0.05
表2 基线期与治疗后两组血清EOS、CRP、IL-2水平比较

表2 基线期与治疗后两组血清EOS、CRP、IL-2水平比较
组别 EOS(×109/L) CRP(mg/L) IL-2(pg/mL)基线期 治疗后 基线期 治疗后 基线期 治疗后观察组(n=40) 0.72±0.13 0.22±0.06 27.17±4.53 9.27±3.89 29.59±7.76 38.35±6.05对照组(n=40) 0.75±0.15 0.50±0.03 27.10±6.29 14.45±4.26 30.30±5.67 32.71±4.78 t 0.955 26.398 0.057 5.679 0.467 4.626 P>0.05 <0.05 >0.05 <0.05 >0.05 <0.05
表3 基线期与治疗后两组T细胞亚群比较

表3 基线期与治疗后两组T细胞亚群比较
组别 CD3(%) CD4(%) CD8(%) CD4/CD8基线期 治疗后 基线期 治疗后 基线期 治疗后 基线期 治疗后观察组(n=40) 54.60±7.27 65.08±5.02 26.09±4.87 39.46±8.76 27.57±4.50 30.77±3.41 0.98±0.19 1.42±0.16对照组(n=40) 54.51±6.30 60.25±5.13 26.71±5.42 33.10±5.39 27.58±3.12 27.91±2.80 0.97±0.16 1.12±0.12 t 0.059 4.256 0.538 3.910 0.011 4.099 0.254 9.486 P>0.05 <0.05 >0.05 <0.05 >0.05 <0.05 >0.05 <0.05
复习文献发现,慢性阻塞性肺疾病的发生、进展的免疫学机制已经逐步明确[14-15]:(1)T 细胞亚群、中性粒细胞及其他细胞因子等炎症因子及炎症介质在引发、维持、加重慢性阻塞性肺疾病过程中起了重要作用。(2)炎症因子及炎症介质的浸润和失调引起慢性阻塞性肺疾病患者气流阻塞、气道高反应性,从而导致慢性阻塞性肺疾病患者表现出气急、气短及咳嗽等症状。由此可见,炎症因子及炎症介质在慢性阻塞性肺疾病中作用机制已经逐步明确,上述一系列机制推进了慢性阻塞性肺疾病的免疫治疗。
本研究结果显示,基线期,两组FEV1、FEV1 predicted、FEV1/FVC 比较,差异无统计学意义;治疗后,观察组FEV1、FEV1 predicted、FEV1/FVC 显著高于对照组,差异有统计学意义。提示,与单纯特布他林相比,特布他林联合布地奈德可更有效改善慢性阻塞性肺疾病患者肺功能指标。本研究结果显示,基线期,两组血清EOS、CRP、IL-2、CD3、CD4、CD8、CD4/CD8 水平比较,差异无统计学意义;治疗后,观察组血清EOS、CRP 水平显著低于对照组,观察组血清IL-2、CD3、CD4、CD8、CD4/CD8 水平显著高于对照组,差异有统计学意义。提示,与单纯特布他林相比,特布他林联合布地奈德可调控慢性阻塞性肺疾病患者血清炎症因子及炎症介质水平。复习文献发现,吸入用布地奈德混悬液其活性成份为布地奈德,布地奈德能通过增强内皮细胞、平滑肌细胞和溶酶体膜的稳定性来抑制炎症因子及炎症介质等活性物质的生成。因此,笔者有理由认为特布他林联合布地奈德具有协同作用,二者通过调控慢性阻塞性肺疾病患者血清炎症因子及炎症介质水平来减轻气流阻塞、减轻气道高反应性、改善肺通气功能,从而发挥治疗慢性阻塞性肺疾病的作用。
综上所述,本研究探讨了特布他林联合布地奈德治疗慢性阻塞性肺疾病对炎症因子及炎症介质的影响。

