脉冲电场促进黑曲霉生长提高产酶活性
刘振宇,宋艳波,高瑞梅,李林葳,杨 政,贾丽艳
(1.山西农业大学信息科学与工程学院,晋中030801;2.山西农业大学生命科学学院,晋中030801;3.山西农业大学工学院,晋中030801;4.山西农业大学食品科学与工程学院,晋中030801)
0 引 言
黑曲霉(Aspergillus niger)是国际公认的生物技术中最重要的微生物之一。从1919 年黑曲霉生产柠檬酸被工业化开发,首次获得实际应用开始,至今黑曲霉一直是工业应用中重要的研究对象[1]。目前,黑曲霉发酵产生的多种代谢产物在发酵饲料、食品添加配料、工业酶制剂以及医药方面都有重大作用[2-4]。黑曲霉是多种酶的来源,成为众所周知的外源蛋白和酶的细胞生产工厂,其生产的糖化酶已经实现了规模化工业应用[5]。而且,柠檬酸和许多黑曲霉的酶被美国食品和药物管理局(Food and Drug Administration,FDA)认为是GRAS(Generally regarded as safe)产品,此外,黑曲霉还可用于生物转化和废物处理[1]。因此研究黑曲霉菌种特性、培养环境、发酵体系,采用物理、化学和生物技术等手段改造黑曲霉菌种,提高菌株对目标代谢物的生产能力成为目前国内外研究的热点。研究黑曲霉菌丝生长形态和特异性蛋白酶活性与高水平葡萄糖淀粉酶活性关系[6],优化生产工艺提高黑曲霉中壳聚糖产量和功能活性[7],采用60Co射线和紫外辐照结合处理黑曲霉孢子获得环氧化物水解酶(epoxide hydrolase,EH)高产菌株[8]。这些技术本身具有一定限制,如产生不需要的化学残留物和需要很长时间培养等。而脉冲电场作为非热处理技术,以其绿色环保,节约能源和可提高某些微生物细胞活性和发酵能力,有望发展为解决这些问题的可替代技术。
脉冲电场(pulsed electric field,PEF)处理是一种新型的细胞电穿孔技术[9]。在外加PEF 作用下,细胞膜上形成小孔的过程即为电穿孔。在一定条件下形成的电穿孔是不可逆的,使细胞死亡,可以有效杀灭食品中的多种食源性,腐败性和致病性微生物,广泛用于果汁等流动和果酱等半流动及鲜果和肉类保鲜贮藏及品质改善[9-12];在医学中作为联合治疗技术和直接治疗方法进行肿瘤细胞杀灭[13-14]。在某些条件下,形成了可逆的膜电穿孔,细胞是活的,但细胞透性增大,这利于组织中活性化合物和基因提取[15];利于果蔬干燥时水分散失,提高干燥速率[16]。近年来PEF 对活细胞的刺激越来越受到广泛关注,用于促进植物种子萌发[17-19]和改良菌种等,如用PEF 处理酵母,既可改变酿酒酵母的培养周期,促进细胞分裂同步化[20],也可增加酵母细胞生长和酒精生产率[21],改善酵母发酵特性,提高酵母菌的代谢,成为刺激微生物反应(即发酵)的积极工具[22]。目前,关于PEF对黑曲霉作用报道较少,本研究以黑曲霉糖化酶高产菌株为作用对象,探讨脉冲工作参数对黑曲霉生长和产糖化酶性能影响,力求获得两者间的互作规律,为黑曲霉生产效能的提高提供一种新的技术和方法。
1 材料与方法
1.1 试验材料
试验菌株:黑曲霉AS3.4309,购买于中国科学院微生物研究所。
试验试剂:马铃薯葡萄糖(PDA,potato dextrose agar)液体培养基:马铃薯200 g切成小块,加适量水煮沸30 min过滤,滤液中加20 g 蔗糖,用蒸馏水补至1 000 mL;培养基加入20 g 琼脂即为固体培养基。察氏培养基:蒸馏水1 000 mL,硝酸钠3 g,蔗糖30 g,磷酸氢二钾1 g,硫酸镁(MgSO4·7H2O)0.5 g,氯化钾0.5 g,硫酸亚铁0.01 g,琼脂20 g,加热溶解。蛋白胨:1 g蛋白胨,蒸馏水溶解,定容至1 000 mL,灭菌备用。
试验仪器:SW-CJ-2G 型超净台,苏州江东精密仪器有限公司;ECM830 型脉冲发生器,美国BTX 公司;JS-2000W-A 型交流电源电压转换器,上海景赛电子科技有限公司;SPX-300-F 生化培养箱,上海龙跃仪器设备有限公司;血球计数板(QIUJING,25 格×16 格),上海求精生化试剂仪器有限公司;E100 型显微镜,上海维翰光电科技有限公司;Megafuge 8R 台式高速冷冻离心机,Thermo Fisher 美国公司;DH5000-AB 干燥箱,德州市昊诚实验仪器有限公司;THZ-98A 恒温振荡培养箱,上海一恒科学仪器有限公司;UV752N 紫外可见分光光度计,上海佑科仪器仪表有限公司;HH-42 水浴锅,福州精科仪器仪表有限公司;DYCZ-24A 电泳仪,北京市六一仪器厂;Chemixrsf化学发光凝胶成像仪,美国Bio-Rad伯乐公司等。
1.2 试验方法
1.2.1 黑曲霉的活化和孢子悬液制备
黑曲霉接种于斜面培养基上,28 ℃培养7 d,4 ℃保存。向上述培养物加适量无菌蛋白胨,用接种针刮下培养物,无菌纱布滤去菌丝体,使孢子分布均匀,用血球计数板计量3 次孢子数,求其平均值,得到孢子浓度为4.2×106个/mL的菌悬液。
1.2.2 菌悬液的PEF处理及培养
吸取150 μL 孢子悬液于电击杯(聚碳酸酯材质,两电极间距2 mm)中进行脉冲处理:取100 μL 放入装有25 mL PDA 液体培养基离心管中,28 ℃、150 r/min培养60 h,测定菌丝干质量;另取10 μL 接于装有30 mL PDA 液体培养基的锥形瓶中培养108 h,测定糖化酶活性;取2 μL 进行微室培养(察氏培养基)10~12 h,显微镜下观察孢子萌发;取1 μL 接于PDA 固定平板中央,观察菌丝生长,以未进行PEF 处理的黑曲霉为对照。所有试验重复3次。
1.2.3 指标测定方法
1)菌丝干质量测定[23]:用定量滤纸过滤培养物,70 ℃烘干至恒质量。
2)糖化酶活性的测定:培养后的菌液,4 ℃5 700 r/min离心20 min,上清液即为粗酶液[24],酶活性测定采用3,5-二硝基水杨酸法[25]。
酶活性单位为pH值5、40 ℃和15 min反应时间分解淀粉产生1 μmol 葡萄糖(0.18 mg)所需酶量[24]。
3)黑曲霉孢子萌发测定[26-27]:菌丝长度比孢子直径一半长时,认为孢子已萌发。
孢子萌发率=已萌发孢子数目(/已萌发孢子数+未萌发孢子数)×100%。
4)同工酶测定
孢子悬液接于装有25 mL PDA 液体培养基的锥形瓶中培养72 h,过滤并收集菌团,蒸馏水冲洗,吸干。称菌丝团放入预冷的研钵,加适量石英砂和0.1 mol/L pH值8.0 Tris-HCl提取液(1 g菌丝/2 mL提取液)冰浴研磨,低温浸提0.5 h或过夜。12 000 r/min 4 ℃离心15 min,上清液用于酯酶(EST)同工酶分析[28]。
聚丙烯酰胺凝胶电泳:分离胶质量分数12%,pH值8.9;浓缩胶5%,pH 值6.8,电泳缓冲液为Tris-Gly pH 值8.3 系统;初始电压160 V,分离胶电压为240 V。染液配制参考文献[29]稍作修改:50 mg固蓝B盐(氯化四氮邻二甲氧基苯胺),溶于150 mL 0.1 mol/L pH 值6.2磷酸缓冲液,过滤;50 mg α-乙酸萘酯和50 mg β-乙酸萘酯溶于1 mL 丙酮,倒入固蓝溶液中,边倒边搅拌。电泳结束后将胶转移至染色液中,37 ℃黑暗染色至褐色条带清晰,水漂洗,7%的醋酸固定,用凝胶成像仪拍照。
1.2.4 试验设计
依据脉冲仪器性能、菌液承受能力和前期试验研究结果选择脉冲参数和参数范围。采用三因素五水平中心组合设计(central composite experimental design,CCD)确立脉冲强度(5~15 kV/cm)、脉冲持续时间(10~100 μs)和脉冲数(50~99)3 个脉冲参数组合,以黑曲霉菌丝干质量和产糖化酶活性为主要响应指标,研究这些指标在不同脉冲参数下的变化规律,优化脉冲工艺。各变量的编码值和实际值如表1。
1.2.5 统计分析
所有结果用平均值表示。数据统计分析和建模均由Design Expert 10.0.7 统计分析软件(Stat-Ease 公司,明尼阿波里斯市,美国)完成。试验数据进行多元回归和显著性分析(P<0.05)。从回归模型中生成响应面图,直观反映响应值与自变量之间的关系,确定最优条件。
2 结果与分析
PEF 处理技术可以产生多种生物学效应,如杀灭食源性和腐源性致病菌,从而被广泛用于液态食品加工中;增加植物和肉类等固态食品传质,改善加工中的传质品质;促进植物种子的代谢活动,提升种子活力;提高物料干燥速率;增加细胞内活性物质提取率;生物大分子改性和刺激酵母细胞生长等。而要达到以上某种特定效应的前提是执行相应的PEF 加工参数[30]。研究获得了PEF 工作参数对黑曲霉生长和产糖化酶活性关系。

表1 试验设计与实测结果Table1 Experimental design and measured results
2.1 PEF 参数对黑曲霉菌丝干质量和产糖化酶活性影响规律
2.1.1 PEF作用对黑曲霉菌丝干质量和产糖化酶活性影响
PEF 处理对黑曲霉菌丝干质量和产糖化酶性能有明显影响,不同参数效果不同。未经PEF 处理的黑曲霉菌丝干质量和糖化酶活性分别为(16.67±1.25)mg 和(15.70±0.31)U/mL;PEF 处理后,菌丝干质量和糖化酶活性最大达(34.58±0.94)mg 和(19.70±1.61)U/mL,比对照分别增加了107%和25.47%(见表1)。在个别参数下菌丝干质量和糖化酶活性比未处理低,从表1 不难看出,在低电场强度处理下菌丝干质量未增反而下降;而脉冲数较高的处理下,产酶活性下降。Zhao 等采用20 kV/cm、100 和200 ms 的短时间PEF 处理酿酒酵母细胞,发现α-葡萄糖苷酶、N -乙酰-β-糖苷酶和α-甘露糖苷酶活性增加;当PEF 处理时间超过200 ms 时,观察到了蛋白团聚体的形成,同时发现这些酶活性降低甚至完全丧失[31]。在本研究中,脉冲处理个数高,脉冲作用时间积累效应导致黑曲霉产糖化酶活性的下降,与上述研究结果一致。
因此,寻求脉冲参数及参数间相互作用对响应指标影响规律,确立脉冲参数与响应指标间的量化关系尤为重要。
2.1.2 PEF作用参数与两响应指标回归方程建立与分析
用统计分析软件对表1 结果进行回归分析和显著性检验,建立了脉冲强度、脉冲时间和脉冲数3 个自变量和黑曲霉菌丝干质量、产糖化酶活力2 个响应指标关系的二阶多项式方程:

式中X1,X2,X3分别为脉冲强度、脉冲持续时间和脉冲数的编码水平;Y1为黑曲霉菌丝干质量,mg;Y2为糖化酶活力,U/mL。
采用方差分析评价两模型的充分性和适合度,以相应的P 值评价模型的显著性(表2)。黑曲霉菌丝干质量(Y1)F 值为6.89,糖化酶活性(Y2)F 值为12.02,F 值较大,说明了模型的正确性;P<0.01,模型均显著;两模型失拟项均不显著,且决定系数R2分别为0.861 2 和0.915 4,值较高,表明该模型可用。方程能反映和预测试验选定参数范围内3 个脉冲参数与2 个响应指标间的关系。
回归系数检验显示:对黑曲霉菌丝干质量影响最大的因素是脉冲强度(P<0.01),其次是脉冲数和脉冲持续时间。根据回归模型方差结果绘制3D 效果图:从图1a
可以看出,曲面比较陡,表示脉冲强度与脉冲数互作时,对黑曲霉菌丝干质量影响显著(P<0.01)。而脉冲强度与脉冲宽度互作、脉冲宽度与脉冲数互作对黑曲霉菌丝干质量的影响不显著(表2)。
与菌丝干质量略有不同,影响糖化酶最大的因素是脉冲数(P<0.01),其次是脉冲强度(P<0.05)和脉冲宽度。综合响应曲面图和测定结果表,只有脉冲强度和脉冲数的互作效应3D响应曲面图的凸起幅度较强,互作效应显著P<0.05,与对黑曲霉干质量作用结果一致(图1b)。综合脉冲参数对2 个响应指标影响可知,脉冲强度对两指标影响显著,这与当前研究认为PEF 的作用主要取决于电场强度[32]结果一致。另外,脉冲数与脉冲强度的互作也显著影响两指标变化,应用时也需重点考虑。

表2 PEF参数对黑曲霉菌丝干质量和产糖化酶活性影响的方差分析Table 2 Variance analysis from influence of PEF parameters on Aspergillus niger mycelium dry weight and activity of glucoamylase
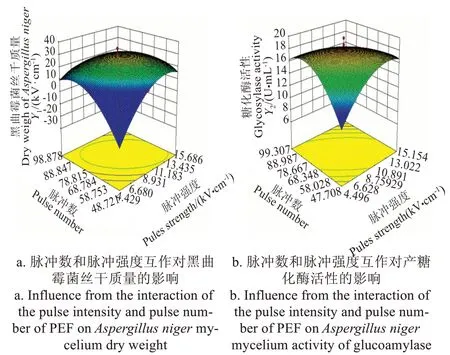
图1 PEF脉冲数和脉冲强度两参数互作对黑曲霉菌丝干质量和产糖化酶活性的影响Fig.1 Influence from the interaction of the pulse intensity and pulse number of PEF on Aspergillus niger mycelium dry eight and activity of glucoamylase
2.2 PEF对黑曲霉菌落形态特征的影响
PEF 处理对黑曲霉菌落生长形态产生了明显影响(图2)。在表1脉冲参数处理下,所有菌落虽然都呈圆形生长,但未处理的菌落(图2 中0)可见清晰的菌落圈;而PEF 处理后,有些菌落圈隆起高,出现星状褶皱,菌落圈较难分辨,孢子数量显著增加,孢子颜色没变但孢子周围出现明显不同的深黄色(图2 中PEF-7 和PEF-11 分别为表1 中序号7 和11 处理)。说明,PEF 不但刺激了黑曲霉生长,也影响其代谢。

图2 PEF对黑曲霉菌落形态特征的影响Fig.2 Influence of PEF on Aspergillus niger colony shape feature
2.3 PEF对黑曲霉孢子萌发的影响
显微镜下观察和统计黑曲霉孢子萌发情况(图3)。未经PEF 处理的黑曲霉孢子萌发率为14.06%±0.59%,采用表1 中PEF 工作参数处理后,孢子萌发率为25.00%±0.33%~46.54%±0.55%,比对照增加了77.8%~231%。据此认为PEF促进菌丝生长原因之一是刺激了孢子萌发。
图3 PEF对黑曲霉孢子萌发的影响(×400)Fig.3 Influence of PEF on Aspergillus niger spore germination(×400)
2.4 PEF对EST同工酶的影响
PEF处理在某些条件下可能对菌株产生诱变作用[33],为了检测PEF处理后的黑曲霉是否发生质变,基于菌落形态特征观察,对生长褶皱、颜色和疏密度等表现出差异的处理和对照同时收获孢子,进行酯酶同工酶酶谱分析。
由图4a 和4b 可知,黑曲霉的EST 同工酶出现了10条谱带,标记为EST-01~EST-10,其迁移率为0.267~0.750。EST-01~EST-05 条带强度明显强于其他条带,说明这5条条带对EST 活性贡献较大。而EST-08~EST-10条带最弱,对EST活性贡献最小。同工酶是基因表达产物,是遗传与变异的重要指标;而酯酶同工酶由于易于检测,且具有高度多态性,被作为遗传研究中常见的标记物,广泛用于微生物、昆虫和植物物种鉴定及分类与进化研究中[34-36]。本文,PEF 处理组与对照组的EST-01~EST-08 的迁移率都相同。说明PEF处理并未对黑曲霉的EST同工酶形成明显遗传变异。另外,酯酶活性可作为微生物细胞代谢性能的指标,图中编号7~9 样本EST-01 和EST-02条带颜色比对照深,11~16 号样本与对照无明显差异,而其他样本比对照浅。这一结果表明PEF 影响了黑曲霉的代谢性能。

图4 PEF对黑曲霉酯酶同工酶影响Fig.4 Influence of PEF on esterase isozyme of Aspergillus niger
2.5 工艺参数的优化验证
黑曲霉菌丝干质量和黑曲霉糖化酶活性在相应约束条件下都应达到最大值,即Y1max和Y2max确立为目标函数,经Design Expert 10.0.7 统计分析软件对两个回归模型分别优化求解。在此基础上,利用多目标决策理论及非线性优化方法,综合目标函数采用线性加权法进行规划求解,由于糖化酶活性是主要目标,其加权系数K2取0.6,则黑曲霉菌丝干质量的加权系数K1为0.4[16]。获得综合优化条件为脉冲强度12.974 95 kV/cm、脉宽为53.517 μs、脉冲数66.052,相应的黑曲霉菌丝干质量为28.662 mg,糖化酶活性为17.746 U/mL。经修正,选择脉冲强度为12.975 kV/cm、脉宽为54 μs、脉冲数66,获得黑曲霉的菌丝干质量和糖化酶活性分别为28.05 mg和18.01 U/mL,与预测值基本一致,表明优化结果合理可靠,比对照提高了68.27%和14.71%,可以作为进一步试验研究的指导。
3 讨论
3.1 PEF对黑曲霉作用机理分析
PEF 处理影响黑曲霉分生孢子活力,增加柠檬酸产量[37]。在本研究中,PEF 处理后产糖化酶能力增强,菌丝干质量增加,这与PEF刺激孢子萌发有关,与对萌发中和萌发后代谢刺激也有关。PEF 处理酵母细胞研究中发现,PEF 处理促进细胞中锌离子、镁离子和钙离子积累[38-39],促进果糖等物质吸收,刺激酵母细胞代谢[22]。以及造成细胞代谢过程中酶的变化,如PEF 处理新鲜蓝莓提高了花青素浓度,改变了其在蓝莓中的分布,可能通过影响反应动力学中涉及的分子,如酶,改变花青素降解的机制[11]。作为一种丝状真菌,黑曲霉孢子萌发常需要较长的延滞期,因此缩短孢子萌发时间,可以提高发酵效率,而PEF处理可以通过改变细胞膜组分排列,产生电穿孔,增加细胞膜渗透性或激活转运蛋白质[40],增加对水分、离子和有益营养物质的吸收运转,活化代谢过程中的酶,促进细胞代谢,从而促进生长,提高其产酶性能。
3.2 PEF参数优化
PEF 可以刺激细胞代谢,也可以杀死细胞。这主要取决于脉冲工作参数。研究认为PEF的作用主要取决于电场的强度,Sotelo 等研究了中、轻度PEF(电场强度0.3和2.5 kV/cm,脉冲频率100 Hz,脉冲宽度20 μs)处理樱桃提高了其可食品质且不影响益生菌的生长[41]。电场强度5.0 kV/cm,脉冲宽度20 μs,电场频率1 Hz下处理酵母细胞15 min 后培养20 h,镁和锌的积累比对照分别增加了1.5 倍和2 倍[38],过高电场强度会使细胞损伤严重,甚至死亡。因此,高的电场强度(10~80 kV/cm)常被用于巴氏杀菌,使微生物膜破坏到无法修复的程度,最终死亡[42]。影响果汁质量最重要的电学参数不只电场强度,还有处理时间[10],用于有机物提取研究中,使细胞膜发生可逆穿孔,增加细胞渗透性的脉冲强度范围在1~10 kV之间,脉冲数在5~50 之间[42-43]。可见,PEF 作用中脉冲工艺参数确立的重要性。本文研究同样得出脉冲强度对黑曲霉生长和产糖化酶活性能力影响最突出,并且与脉冲个数互作效应明显。因此,在对不同类型,不同发育时期等不同特点细胞进行PEF 处理时,对参数进行选择和优化是首要任务,研究为该技术在今后工厂化应用中提供理论基础。
4 结论
1)PEF处理黑曲霉孢子,不同的电场强度、脉冲宽度以及脉冲数会导致黑曲霉菌丝干质量和生产糖化酶的能力有所改变,电场强度和脉冲数及其相互作用是影响两指标的主要参数。电场处理后的黑曲霉,其细胞膜通透性和酶活性会增大,代谢速度变快,可以更好的促进孢子萌发。脉冲强度为12.975 kV/cm、脉宽为54 μs、脉冲数66,获得黑曲霉的菌丝干质量和糖化酶活性分别为28.05 mg和18.01 U/mL。
2)酯酶同工酶分析未发现PEF对黑曲霉有诱变的作用,只是通过刺激黑曲霉生长,影响细胞代谢而影响其生长和产糖化酶能力,可见PEF技术是不破坏黑曲霉本质,且处理过程简单,生产效率高,是一种有前景的用于提高生物工程菌发酵效率的有力工具。

