猪流行性腹泻病毒单克隆抗体的制备及胶体金免疫层析检测方法的建立
贾宇旻,徐 飞,边洪芬,王 娟,贾爱卿,唐 勇,贾杏林
(1.湖南农业大学动物医学院,湖南长沙410128;2.广东海大畜牧兽医研究院有限公司,广东广州511400;3.暨南大学生物工程学系/ 广东省抗体药物与免疫检测工程技术研究中心,广东广州510632)
猪流行性腹泻(Porcine epidemic diarrhea,PED)是由猪流行性腹泻病毒(PEDV)引起的一种急性胃肠道传染病。不同年龄段的猪均可以感染,对仔猪危害更严重。患病仔猪主要症状有呕吐、水样腹泻和脱水等,新生仔猪死亡率可高达90 %。我国于1976年首次报道该病,2010年冬季数省持续暴发PED,至今多地仍有该病的发生,给我国养殖业造成了较大的经济损失[1]。PED 的临床症状和病理变化与猪传染性胃肠炎等其它以呕吐、腹泻为特征的猪传染病较为相似,临床上难以鉴别。目前常见的检测PEDV 的方法有RT-PCR[2]和ELISA[3]等,其灵敏度高、特异性强,但检测耗时较长,对操作人员和设备条件要求较高,多用于实验室,不适合现场快速检测。因此建立一种使用方便、快速准确的检测方法,对PED 的诊断和防控尤为重要。胶体金免疫层析技术(GICA)具有准确性高、使用简便、快速等优点,目前已被广泛应用于生物医药等领域。本研究以PEDV 中国南方分离株CHYJ130330 株[4]为基础制备抗PEDV 的单克隆抗体(MAb),并以此初步建立检测PEDV 的GICA,为研制商品化的PEDV快速检测胶体金试纸条奠定基础。
1 材料与方法
1.1 主要实验材料Vero 细胞、传染性胃肠炎病毒(TGEV)疫苗株(TGEV H 株)由广东海大畜牧兽医研究院提供;PEDV CHYJ130330 株(KJ020932)由广东海大畜牧兽医研究院分离鉴定;猪繁殖与呼吸综合征病毒(PRRSV)疫苗株(JXA1-R)、猪伪狂犬病毒(PRV)疫苗株(Bartha-K61)和猪瘟病毒(CSFV)兔化弱毒株(CVCC AV1412)均由广东永顺生物制药股份有限公司提供;SP2/0 骨髓瘤细胞购自上海细胞生物学研究所;SPF 级BALB/c 小鼠(6 周龄)购自南方医科大学实验动物中心。
胎牛血清(FBS)、DMEM 培养基、RPMI-1640 培养基购自 Gibco 公司;PEG-50 % (1450)、HAT、HT、弗氏不完全佐剂均购自Sigma 公司;MONTANIDE GEL 01 佐剂购自 SEPPIC 公司;鼠 MAb 亚类鉴定试剂盒购自Proteintech 公司;Protein G 亲和层析柱购自GE 公司;山羊抗小鼠IgG-HRP、山羊抗小鼠IgG-FITC 购自KPL 公司;BCA 蛋白定量试剂盒购自Thermo 公司;HRP 标记抗体试剂盒购自北京泰天河生物技术有限公司;核酸提取试剂盒购自Omega 公司;反转录试剂盒购自TaKaRa 公司;PCR 引物由上海生物工程有限公司合成;硝酸纤维素膜(NC 膜)、样品垫、结合垫,购自Millipore 公司;吸水垫购自上海捷宁生物科技有限公司;O-leyl-PEG-NHS 偶联剂由本实验室合成。
后备母猪及育肥猪粪便样品39 份、未断奶仔猪粪便及小肠内容物样品76 份,于2017年 ~2018年采集自广东、广西6 个大型发生腹泻病的猪场。样品分装后-40 ℃冻存。
1.2 MAb 的制备参照文献[5]的方法,用PEDV免疫BALB/c 小鼠,制备免疫脾细胞。计数后按5.6∶1 的比例与 SP2/0 细胞混匀,在 PEG-50 %作用下融合后静置培养5 d~7 d[6]。
将PEDV 与Oleyl-PEG-NHS 偶联剂偶联。弃去上述细胞孔中培养上清,将偶联复合物与山羊抗小鼠IgG-FITC 混合,稀释后按每孔100 μL 滴加到细胞孔中,37 ℃静置孵育1h 后洗涤3 次,每孔加入200 μL 1640 培养基。SP2/0 细胞孔同法处理后作为阴性对照孔。参照文献[7]采用表面荧光吸附法(CSFIA)筛选杂交瘤细胞。将镜下观察到荧光信号的细胞孔标记为阳性,并转移扩大培养。
将PEDV 按100 ng/孔包被酶标板,以杂交瘤细胞培养上清为一抗,以HRP 标记山羊抗小鼠IgG 抗体为二抗,以PEDV 免疫小鼠血清为阳性对照,未免疫小鼠血清为阴性对照,PBS 为空白对照,利用间接ELISA 方法筛选杂交瘤细胞。采用有限稀释法将抗体阳性孔的细胞多次克隆纯化,将能够稳定分泌抗PEDV 抗体的杂交瘤细胞株扩大培养[8]。
用两种方法筛选克隆后得到的细胞株制备腹水并通过间接ELISA 检测杂交瘤细胞培养上清和腹水的效价[5]。
1.3 MAb 的鉴定将腹水利用PBS 2 倍倍比稀释(1∶800~1∶128 000),参照 1.2 中 ELISA 方法测定其效价,空白小鼠腹腔注射SP2/0 细胞所得腹水为阴性对照,PBS 为空白对照。同时,参照MAb 亚型鉴定试剂盒说明书检测MAb 的Ig 亚型及轻链类型。分别以PEDV、TGEV、PRV 包被酶标板,以MAb为一抗,参照1.2 的间接ELISA 法检测MAb 的特异性。
1.4 MAb 的纯化及配对取效价较高的腹水经辛酸- 硫酸铵方法沉淀后再经Protein G 亲和层析柱纯化。用HRP 标记的抗体试剂盒标记纯化MAb 并通过间接ELISA 检测其效价[8],参照文献[9]中双抗体夹心ELISA 对MAb 进行方阵法配对。其中HRP 标记的MAb 作为检测抗体,未标记的另外一株MAb作为俘获抗体。
1.5 胶体金免疫层析试纸的制备参照文献的方法制备抗PEDV 的免疫胶体金溶胶(AuNPs-MAb),并采用双抗体夹心法制备胶体金免疫层析试纸条[10]。
1.6 PEDV 胶体金免疫层析检测法的优化参照文献[10]对胶体金微粒的大小、样品垫的种类、结合垫的种类、NC 膜的种类、吸水垫的类型及Tween-20 的用量和AuNPs-mAb 的喷涂量等条件进行优化试验。
1.7 PEDV 胶体金免疫层析检测法评价
1.7.1 特异性试验 采用优化后的胶体金免疫层析试纸条对PEDV、PRV、CSFV、PRRSV、TGEV 进行检测,以PBS 为空白对照,每份样品重复检测2次。评价该方法的特异性。
1.7.2 敏感性试验 将10 g/mL (1.2×105TCID50/mL)PEDV经 PBS 2 倍倍比稀释(0、0.625 g/mL、1.25 g/mL、2.5 g/mL、5 g/mL、10 g/mL)后,采用优化后的胶体金免疫层析试纸条检测,每份样品重复检测2 次。评估该方法的敏感性。
1.7.3 重复性试验 随机选取猪粪样品8 份,向样品中加入等量PB 溶液混合后静置5 min,离心10 min后取 80 mL 上清检测;再取 PEDV 病毒液 1 份、PBS 溶液1 份。选取同批次试纸条同时对每份样品重复检测3 次;选取3 个不同批次的试纸条对上述样品进行检测,观察结果,评价试纸条的重复性。
1.8 临床样品检测将猪粪样品参照1.7 处理后待检;小肠内容物离心10 min 后取上清待检。采用本研究建立的PEDV 胶体金免疫层析试纸条对115 份临床处理的样品进行检测;同时将上述处理样品用RT-PCR[2]同时检测,比较二者的检测结果,计算二者的符合率。
2 结 果
2.1 MAb 的筛选与鉴定结果通过间接ELISA 法筛选、有限稀释法3 次克隆纯化得到11 株阳性杂交瘤细胞;通过CSFIA 法筛选得到22 株阳性杂交瘤细胞。33 株细胞根据原始孔编号命名,结果见表1。
采用间接ELISA 方法检测杂交瘤细胞培养上清的效价,效价高于 1∶160 的有 15 株(13H9、8G12、9D12、 6D10、 3C11F9、 3C11F5、 4H7、 12D12、2F3、3A11、5A10、3G10、3G9、5H9、5A9);同法测定腹水效价,结果见表1。

表1 33 株PEDV MAb 效价检测结果Table 1 Detection of the titers of 33 strain MAbs against PEDV
MAb 亚型鉴定结果显示,效价均高于1∶1.6×104的 21 株 MAb 中 , 11B11、 13H9、 8G12、 12D12、2F3、3A11、5A10 为 IgG1;其余的 MAb 亚型均为IgG2a;所有抗体的轻链类型均为kappa 链。
MAb 特异性检测结果显示效价高于1∶1.6×104的21 株被检MAb 除了与PEDV 反应外,均不与TGEV 和 PRV 结合(图1),表明这些 MAb 均具有较强的特异性。
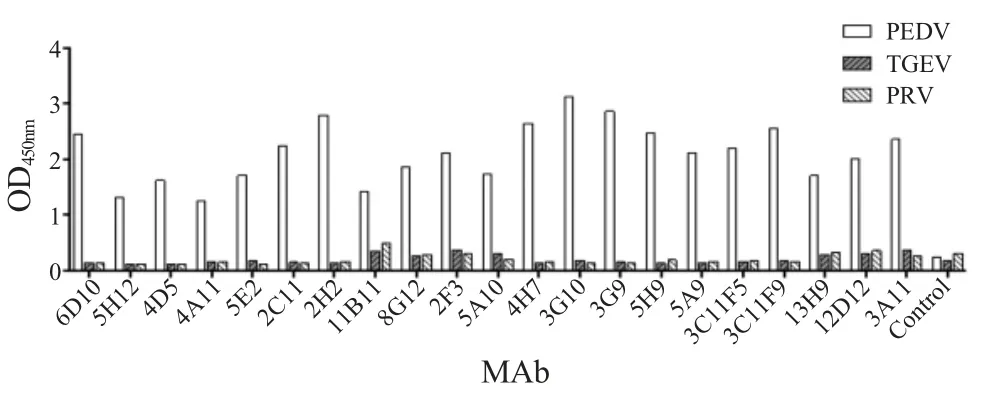
图1 21 株PEDV MAb 特异性鉴定结果Fig.1 Specificity assay results of 21 strain MAbs against PEDV
2.2 MAb 夹心 ELISA 配对结果共有 5 株 MAb(2H2、4A11、4H7、5A9、5H9)通过夹心 ELISA 配对成功。选取效果最佳的4H7 为检测抗体,5A9 为俘获抗体制备胶体金免疫层析试纸条。
2.3 PEDV 胶体金免疫层析检测法的建立胶体金免疫层析试纸条条件优化结果:胶体金颗粒为40 nm,样品垫、结合垫、NC 膜、吸水垫的类型分别为GL-B04、聚酯膜、MILLIPORE135 和 H-2,样品垫封闭缓冲液Tween-20 的使用量为10 μL/mL,金标垫 AuNPs-mAb 喷量为 5 μL/cm。
免疫层析试纸条的特异性试验结果显示,除PEDV 的检测结果为阳性外,该试纸条对PRV、CSFV、PRRSV、TGEV、PBS 的检测结果均为阴性(图2)。表明该胶体金免疫层析试纸条具有较强的特异性。
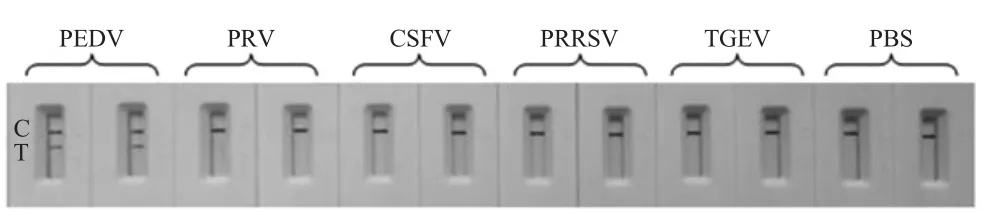
图2 PEDV 胶体金试纸条特异性试验结果Fig.2 Specificity assay results of colloidal gold immunochromatographic strip of PEDV
试纸条敏感性试验结果显示,PEDV 含量等于或大于0.625 μg/mL 时,该试纸条T 线可见显色条带(图3),可判定其最低检出限(LOD)为 0.625 μg/mL (7.8×103TCID50/mL)。表明该方法的敏感性较高。
使用同批次制备的试纸条对10 份样品重复检测3 次,结果均相同;使用3 个不同批次的试纸条对上述样品进行检测,结果均相同;表明该胶体金免疫层析试纸条具有较好的重复性。
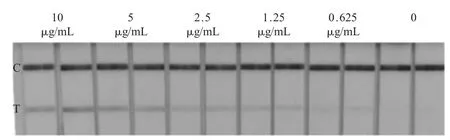
图3 PEDV 胶体金试纸条敏感性试验结果Fig.3 Sensitivity assay of colloidal gold immunochromatographic strip of PEDV
2.4 临床样品的检测结果分别通过GICA 和RT-PCR[2]对115 份临床样品进行平行检测,结果显示GICA 阳性检出率为55.6 %,RT-PCR 的阳性检出率为53.9 %,两者符合率为93 % (表2)。结果表明本研究所制备的MAb 可以应用于临床检测PEDV的胶体金免疫层析试纸条的开发。

表2 临床样品检测结果Table 2 Detection results of clinical samples
3 讨 论
本研究以中国分离的PEDVCHYJ130330 株免疫小鼠,通过ELISA 法和CSFIA 法一共筛选了33 株稳定分泌抗PEDV MAb 的杂交瘤细胞株。在筛选阳性克隆及后续克隆纯化的过程中本研究发现,CSFIA 从细胞融合至得到稳定分泌PEDV MAb 的细胞株,所需时间较少,间接ELISA 方法耗时13 周,是 CSFIA 的 3 倍。CSFIA 的另一优势是比间接ELISA 获得的阳性细胞株数量更多。在阳性杂交瘤细胞克隆过程中,新型的CSFIA 筛选法阳性信号更直观、观察更及时,降低了在多次克隆纯化过程中丢失阳性克隆的几率,明显提高了MAb 制备的效率,是一种更高效的筛选方法。
检测PEDV 的方法有病毒分离鉴定、免疫荧光法(IFA)、ELISA[3]、GICA[11]、RT-PCR[2,12]、Q-PCR[13]、环介导等温核酸扩增技术(LAMP)[14]等。GICA 与其它方法相比,在保证准确率且能够与猪的其它腹泻类传染病鉴别检测的同时,其样品处理、检测、结果判定等环节更为简便快捷,对设备条件和专业人员的依赖较小,检测成本较低,在猪场大量临床样品的筛查方面有着较大的优势。RT-PCR 常用于PEDV 的实验室检测,有着更高的灵敏度和准确率,且在PEDV 的分子流行病学调查方面发挥着重要的作用[2,12]。本研究以PEDV 为免疫原制备了抗PEDV MAb 并以此建立了检测PEDV 的GICA,该方法与RT-PCR 对临床样品的检测结果显示,二者符合率达到93 %,前者检测出的阳性率略高于后者,且存在假阳性结果,提示在后续工作中,还需要通过优化条件、改进试纸条制备工艺、探究新的示踪物等方面进一步提高该方法的检测准确度、灵敏度。PEDV GICA 的初步建立,为开发PEDV 快速检测胶体金试纸条奠定了扎实的基础。

