H5和H7亚型高致病性禽流感病毒新型冻干微芯片双重荧光定量RT-PCR方法的建立和初步应用
高晓艺,韩 焘,王乃迪,王传彬,杨 林,王新杰,高姗姗,孙晓明,胡祥钰,石玉祥,刘玉良*
(1.中国动物疫病预防控制中心,北京102618;2.河北工程大学生命科学与食品工程学院,河北邯郸056021;3.北京亿森宝生物科技有限公司,北京100025)
高致病性禽流感(Highly pathogenic avian influenza,HPAI)是由部分H5 或H7 亚型禽流感病毒(Avian influenza virus,AIV)引起多种禽类急性感染和死亡的一种烈性传染病,被世界动物卫生组织(OIE)列为法定报告动物疫病,在我国被列为一类动物疫病。在国务院发布的《国家中长期动物疫病防治规划(2012~2020年)》 中,将其列为优先防治和重点防范的5 种一类动物疫病之一。AIV 基因组为分节段单股负链 RNA,目前已发现其有 16 种 H 亚型(H1~H16)和 9 种 N 亚型(N1~N9)[1],研究发现,HPAIV 包含H5 和H7 两种亚型,对禽类具有高致病力,可引起禽流感的暴发和流行[2-3]。在我国,H5N1 亚型禽流感于1996年在广东首次报道后,每年均引发数起疫情[4]。该亚型病毒于1997年在中国香港首次直接感染人并发生致人死亡事件,之后一直备受广泛关注[5]。流行病学监测结果表明,近年来以H5N6 亚型HPAIV 为主的2.3.4.4 分支病毒在我国为优势流行株,分离率高,造成多起疫情,危害十分严重[6]。而且,测序结果分析表明,该亚型病毒已发生变异,导致目前所用的H5 (Re-8)+H7(Re-1)二价疫苗不能提供充分保护(未发表数据)。2013年,我国首次报道H7N9 亚型AIV 致人死亡事件,引发高度关注[7]。截止目前,高致病性H7N9亚型AIV 已在我国不同类型和不同规模的养禽场中造成14 起疫情,经济损失严重[8-9]。
本实验室前期监测结果显示,H7N9 AIV 部分毒株的HA 裂解位点与以往毒株相比,插入了多个碱性氨基酸(如PEVPKRKRTAR/GL),表明该病毒已突变为HPAIV (数据未发表),另外,国家禽流感参考实验室和其它多家单位也已监测和分离到多株H5和H7 亚型HPAIV 毒株。精准快速的检测和鉴别诊断是有效防控动物疫病的前提和基础。目前,对于H5 和H7 亚型AIV 检测,利用SPF 鸡胚分离和增殖病毒的方法存在耗时长、生物安全风险大、SPF 鸡胚来源受限等缺点;而ELISA 方法特异性和灵敏度较低,容易出现假阴性;普通RT-PCR 方法是AIV检测的重要手段[10],但是,该方法存在操作繁琐、检测时间长且易污染等弊端。目前,市场上缺乏对以上两种亚型HPAIV 毒株鉴别检测的成熟技术。鉴于此,本研究通过优化反应条件,建立了快速、精准、灵敏度高、便携、可用于基层现场检测,并且可有效鉴别检测H5 和H7 两种亚型HPAIV 的新型冻干微芯片“双重”荧光定量RT-PCR 检测方法。
1 材料与方法
1.1 主要实验材料H5N1 亚型HPAIV、H5N1 亚型LPAIV、H7N9 亚型HPAIV、H7N9 亚型低致病性禽流感病毒(LPAIV)、H9N2 亚型AIV、H6N1 亚型AIV、H1N1 甲型流感病毒、H3N2 亚型AIV,鸡传染性贫血病毒(Chicken infectious anemia virus,CIAV)、禽传染性喉气管炎病毒(Infectious laryngotracheitis virus,ILTV)、鸡滑液囊支原体(Mycoplasma synoviae,MS)、鸡毒支原体(Mycoplasma galliscepticum,MG)、禽腺病毒(Avian adenovirus,AAV)、沙门氏菌(Salmonella),均由中国动物疫病预防控制中心实验室保存,其中H5N1 和H7N9 亚型HPAIV均已灭活;新城疫病毒(Newcastle disease virus,NDV)、禽传染性支气管炎病毒(Infectious bronchitis virus,IBV)、传染性法氏囊病毒(Infectious bursal disease virus, IBDV)、禽脑脊髓炎病毒(Avian encephalomyelitis virus,AEV)均购自中国兽医药品监察所中国兽医微生物菌种保藏管理中心。Dream-TaqTMHot Start DNA Polymerase、Maxima H Minus Reverse Transcriptase 购自 Thermo Scientific 公司;海藻糖购自北京百奥莱博科技有限公司;RNA 提取试剂盒和AriaYSB 微芯片、总DNA 提取试剂盒均购自北京亿森宝生物科技有限公司。30 份组织、血清和咽肛拭子临床样品分别采自湖北省(样品编号A1~C1)、重庆市(样品编号C2-C11)和湖南省(样品编号C12-C21)3 个养鸡场。8 份AIV 阳性样品由本实验室鉴定保存。
1.2 引物、TaqMan-MGB 探针的设计根据已报道 的 H5 (MK046067.1)和 H7 亚 型 (MF455308.1)HPAIV HA 基因 ORF 序列及 HA 基因裂解位点序列,设计多对引物和探针。经过反复比对筛选,确定一组最佳引物和一条TaqMan-MGB 探针(表1)。其中H5 亚型的探针报告基因为FAM,H7 亚型的探针报告基因为ROX。
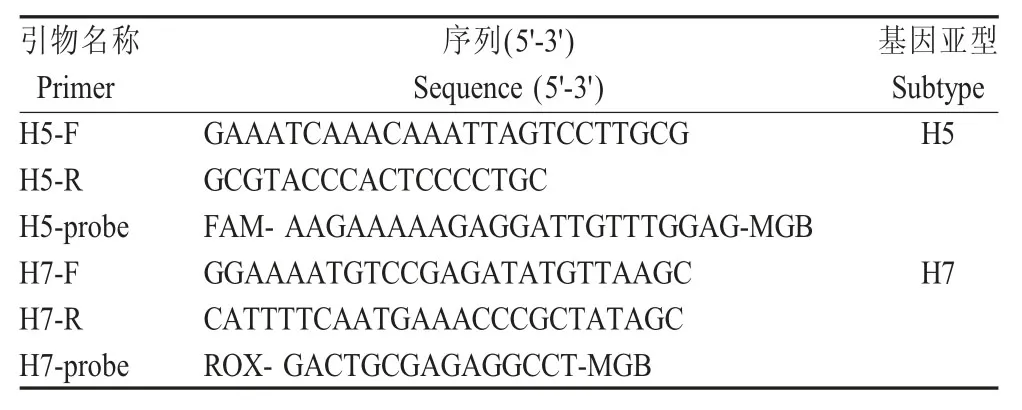
表1 扩增HA 基因所用引物和探针Table 1 Primers and probes used for amplification of HA gene
1.3 病毒基因组的提取利用总RNA 提取试剂盒提取病毒基因组RNA,病毒包括:H5N1 亚型HPAIV、H5N1 亚 型 LPAIV、H7N9 亚 型 HPAIV、H7N9 亚 型 LPAIV、H9N2 亚型 AIV、H6N1 亚 型AIV、H1N1 甲型流感病毒、H3N2 亚型AIV、NDV、IBV、IBDV、AEV。利用总DNA 提取试剂盒提取病原基因组DNA,病原包括: CIAV、ILTV、MS、MG、AAV、Salmonella。将提取的核酸置于冰上立即用于荧光RT-PCR 扩增,或暂放于-20 ℃备用。
1.4 冻干微芯片反应体系的优化采用方阵法对反应体系的引物和探针浓度(0.1 μmol/L、0.2 μmol/L、0.3 μmol/L、0.4 μmol/L、0.5 μmol/L)、Mg2+浓度(1 mmol/L、2 mmol/L、3 mmol/L、4 mmol/L)、反转录酶及HotStartTaqDNA 聚合酶终浓度(0.3 U/μL、0.5 U/μL、1 U/μL、2 U/μL)等进行了优化。扩增反应体系和程序优化如下:反转录温度设为50 ℃,时间分别为5 min、10 min、20 min、30 min;预变性设为95 ℃,时间分别为1 min、3 min、5 min 及10 min;循环次数分别为35 个循环、40 个循环、45个循环。预变性温度为95 ℃,时间分别为3 s、5 s、10 s、15 s,随后设置退火及延伸温度为55 ℃和60 ℃,时间分别为15 s、30 s、45 s、60 s,在此步骤收集荧光信号。利用上述不同参数,对冻干微芯片体系进行优化。冻干微芯片上样孔为30 个,将所有反应试剂充分混匀后以1.2 μL/ 孔加入微芯片孔。根据样品量情况,在配制反应液时需多配制2~3 个样品的反应液母液,以保证反应液足够。将加有有RT-PCR 反应试剂的微芯片先置于-80 ℃冷冻1 h,然后冻干:先将隔板温度下降至-55 ℃,预冻1 h;然后设备开启抽真空,保持冷冻干燥1 h;解析干燥阶段,将隔板温度升至-25 ℃保持1 h;然后将隔板温度升至37 ℃并保持2 h;最后将隔板降至25 ℃并保持1 h。
1.5 冻干微芯片特异性试验利用优化后的冻干微芯片双重荧光RT-PCR 反应条件和程序检测H5 和H7 亚型 HPAIV、H5 和 H7 亚型LPAIV,利用相同反应条件同时检测H9N2 AIV、H6N1 AIV、H1N1甲型流感病毒、H3N2 AIV、NDV、IBV、IBDV、AEV、CIAV、ILTV、MS、MG、AAV 和沙门氏菌。以无核酸酶灭菌双蒸水作为阴性对照。每个循环延伸结束时,采集荧光信号,分析本研究所建立的方法的特异性。
1.6 冻干微芯片敏感性试验将1×107TCID50/mL的 H5 和 H7 亚型HPAIV 10 倍倍比稀释后,取 1×100TCID50/mL~1×106TCID50/mL 共 7 个不同浓度分别提取基因组RNA 作为模板,以无核酸酶灭菌双蒸水作为阴性对照,采用建立的冻干微芯片双重荧光定量RT-PCR 方法检测。同时,根据本实验室摸索建立的条件,用同样稀释的相同模板进行常规荧光定量RT-PCR 扩增(表2),以确定和比较两种检测方法的敏感性。
常规荧光定量RT-PCR 反应:50 ℃30 min,95 ℃5 min、95 ℃ 15 s、60 ℃ 45 s,40 个循环,每个循环结束时进行荧光信号采集和检测。
1.7 重复性试验利用本研究所建立的方法初步组装成试剂盒,选用同一批次的8 个检测试剂盒对8份AIV 阳性样品常规处理后进行检测,评价其批内重复性;选用3 个不同批次的试剂盒对同样8 份阳性样品进行检测,评价其批间重复性。样本标准差代表所采用的样本X1、X2...Xn 的均值;变异系数CV=(标准差SD/平均值)×100 %。
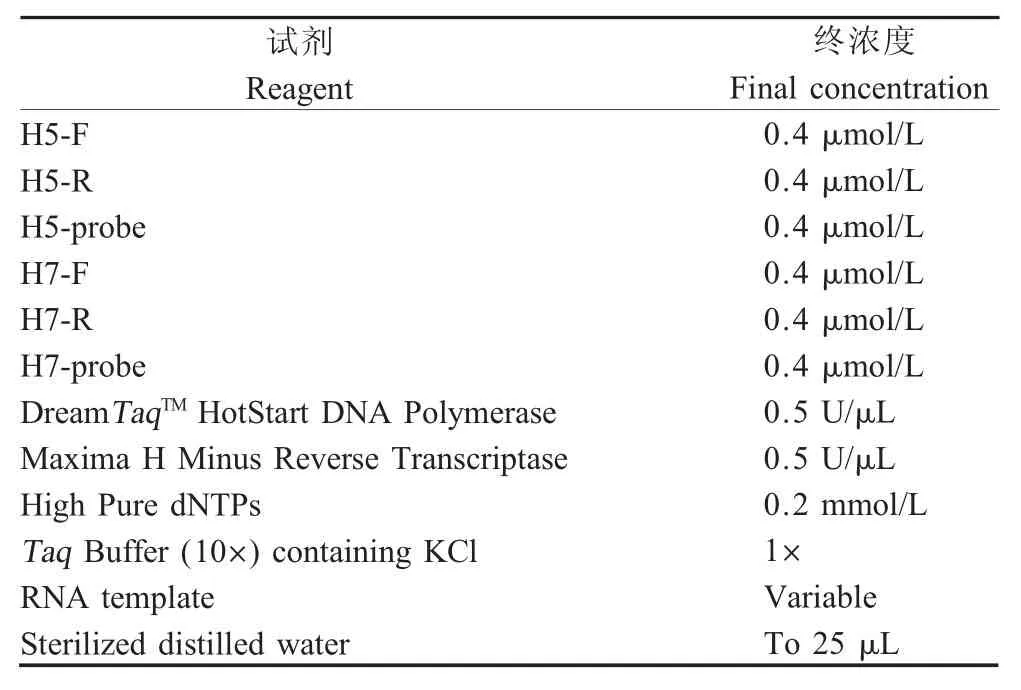
表2 常规荧光定量RT-PCR 反应体系配制表Table 2 Preparation of conventional real-time RT-PCR reaction system
1.8 临床样品的检测将采自湖北省(样品编号A1~C1)、重庆市(样品编号C2-C11)和湖南省(样品编号C12-C21)3 个养鸡场共30 份组织、血清和咽肛拭子临床样品经常规处理后利用上述1.3 中核酸提取方法提取总RNA 为模板,利用本研究所建立的冻干微芯片双重荧光RT-PCR 方法对提取的总RNA 进行扩增检测和比较分析。同时,利用本实验室建立的常规荧光定量RT-PCR 方法对HA 基因进行扩增鉴定和测序验证。样品信息见表5。
2 结 果
2.1 检测体系优化结果通过比较,确定本研究冻干微芯片检测方法的最佳反应条件如表3 所示。
反应最佳条件为:50 ℃ 10 min;95 ℃ 1 min;95 ℃ 5 s,60 ℃15 s,40 个循环,每个循环延伸结束时,采集荧光信号和检测。
2.2 特异性检测结果利用本实验建立的方法检测H5 和H7 亚型HPAI HA 基因,同时应用该方法检测其它禽病病原。结果显示,仅在H5 亚型HPAIV及H7 亚型HPAIV 出现特异性扩增曲线峰,Ct 值分别为18.86 和25.96,而其它亚型AIV 和禽病病原,以及阴性对照均未有扩增曲线出现(图1)。表明该方法具有较强的特异性。
2.3 敏感性检测结果将H5 亚型HPAIV 10 倍倍比稀释后,利用本研究建立的方法进行敏感性检测,结果显示,该方法检测下限为病毒浓度为1×101TCID50/mL,Ct 值为 32.79 (图2A);而常规荧光定量 RT-PCR 检测的最低病毒浓度为 1 ×102TCID50/mL,Ct 值为30.97 (图2B)。表明冻干微芯片双重荧光定量RT-PCR 方法敏感性比常规荧光定量RT-PCR 约高10 倍。H7 亚型HPAIV 敏感性结果同H5 亚型(图略)。
通过绘制标准曲线图分析结果显示,冻干微芯片双重荧光定量RT-PCR 扩增效率为107.00 % (A),而常规荧光定量RT-PCR 扩增效率为89.96 % (B),表明本研究所建立的方法的扩增效率比常规荧光定量RT-PCR 高。两种方法所对应的标准曲线公式及相关系数均较接近,两种方法的相关系数均为0.997 (图3)。H7 亚型 HPAIV 结果相似(图略)。

表3 冻干微芯片双重荧光定量RT-PCR 反应体系Table 3 The lyophilized microchip duplex real-time RT-PCR reaction system
2.4 重复性检测结果利用所建立的方法进行批内和批间重复性检测,结果显示,批内(0.42%~0.92%)及批间(0.08 %~1.45 %)变异系数均<2 % (表 4),表明该试剂盒具有较好的重复性。
2.5 临床样品检测结果利用所建立的冻干微芯片双重荧光RT-PCR 方法,对采集的经常规方法处理后的30 份临床样品提取基因组进行检测,结果显示有15 份样品为H5 和H7 亚型HPAIV,15 份样品为阴性。样品信息和检测结果分别见表5 和图4。所有30 份样品均用普通RT-PCR 扩增HA 基因ORF,然后将扩增产物电泳和纯化后,测序验证(结果略)。结果显示,冻干微芯片双重荧光RT-PCR 方法检测结果与普通RT-PCR 检测结果以及测序结果完全一致。表明本研究建立的冻干微芯片双重荧光RT-PCR 方法可用于H5 和H7 亚型HPAIV 临床鉴别检测。
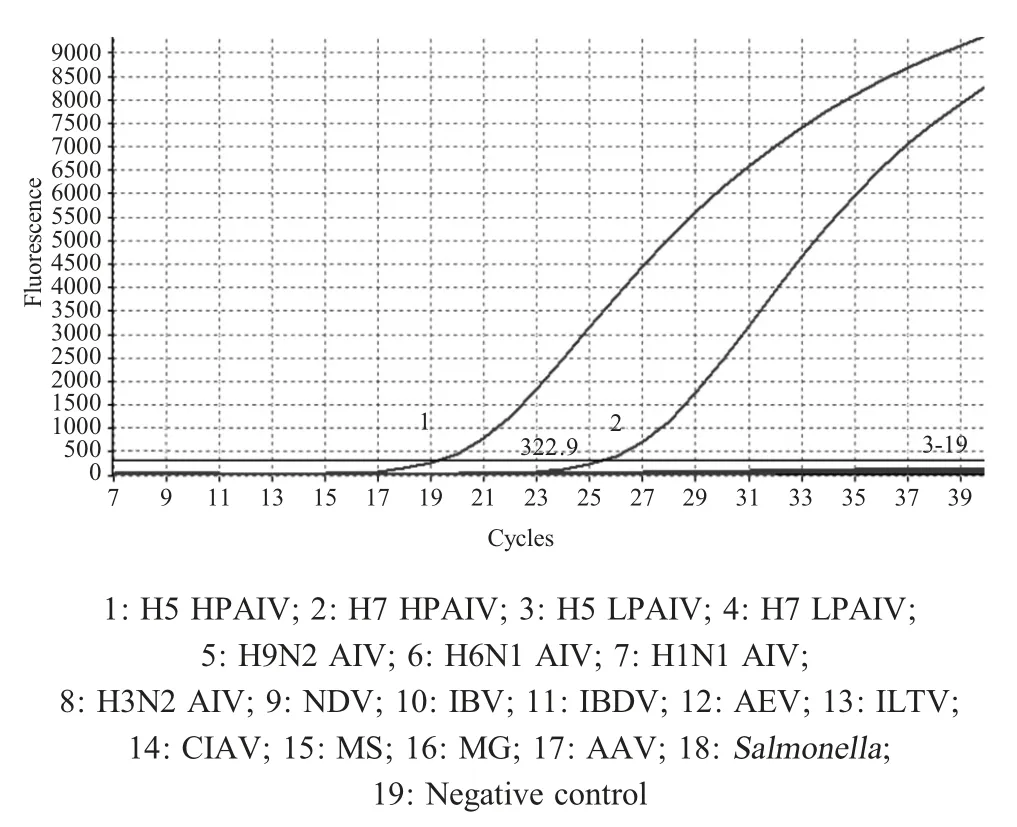
图1 H5 和H7 亚型HPAIV 特异性检测结果Fig.1 Specificity of H5 and H7 HPAIV detection
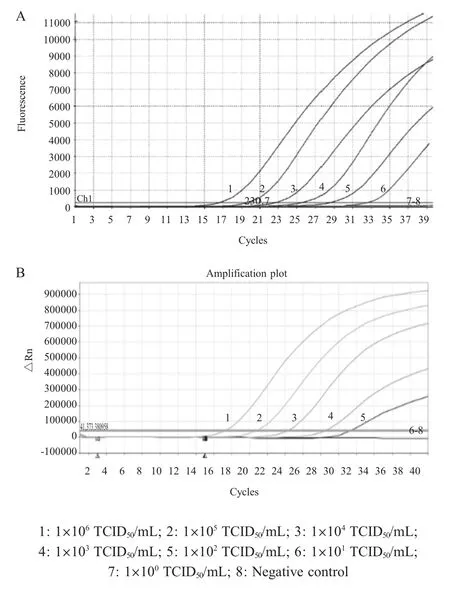
图2 冻干微芯片荧光RT-PCR(A)和常规荧光定量RT-PCR (B)敏感性检测结果Fig.2 Sensitivity test of the lyophilized microchip duplex real-time RT-PCR (A)and conventional real-time RT-PCR (B)
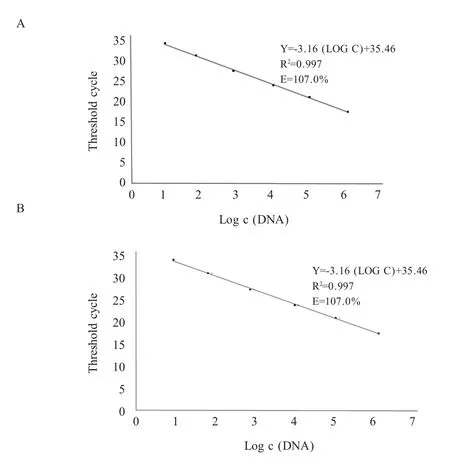
图3 两种方法检测H5 亚型HPAIV 标准曲线Fig.3 Standard curve of H5 HPAIV detection by lyophilized microchip duplex real-time RT-PCR and conventional real-time RT-PCR

表4 批内和批间重复性检测结果Table 4 Results of repeatability test
3 讨 论
目前,荧光定量RT-PCR 方法在H5 和H7 亚型AIV 检测中得到广泛应用,但所报道的常规荧光定量RT-PCR 方法一般只检测H5 或H7 亚型,不能同时检测两种亚型。另外,所用试剂需在冷冻或低温条件下保存运输,所用仪器设备体积大,沉重不便携带,价格昂贵,这些缺点均限制了该方法的现场检测和应用。基于以上现实情况,本研究设计合成了 H5 和 H7 亚型 HPAIV 特异性引物和TaqMan-MGB 探针,首先建立双重荧光定量RT-PCR 方法,并采用本实验室已建立成熟的冻干技术,将PCR 反应试剂冻干在微芯片上,最终首次摸索建立了冻干微芯片双重荧光定量RT-PCR 检测方法。该方法可同时检测H5 和H7 两种亚型HPAIV,为“双重”荧光定量RT-PCR 检测方法。
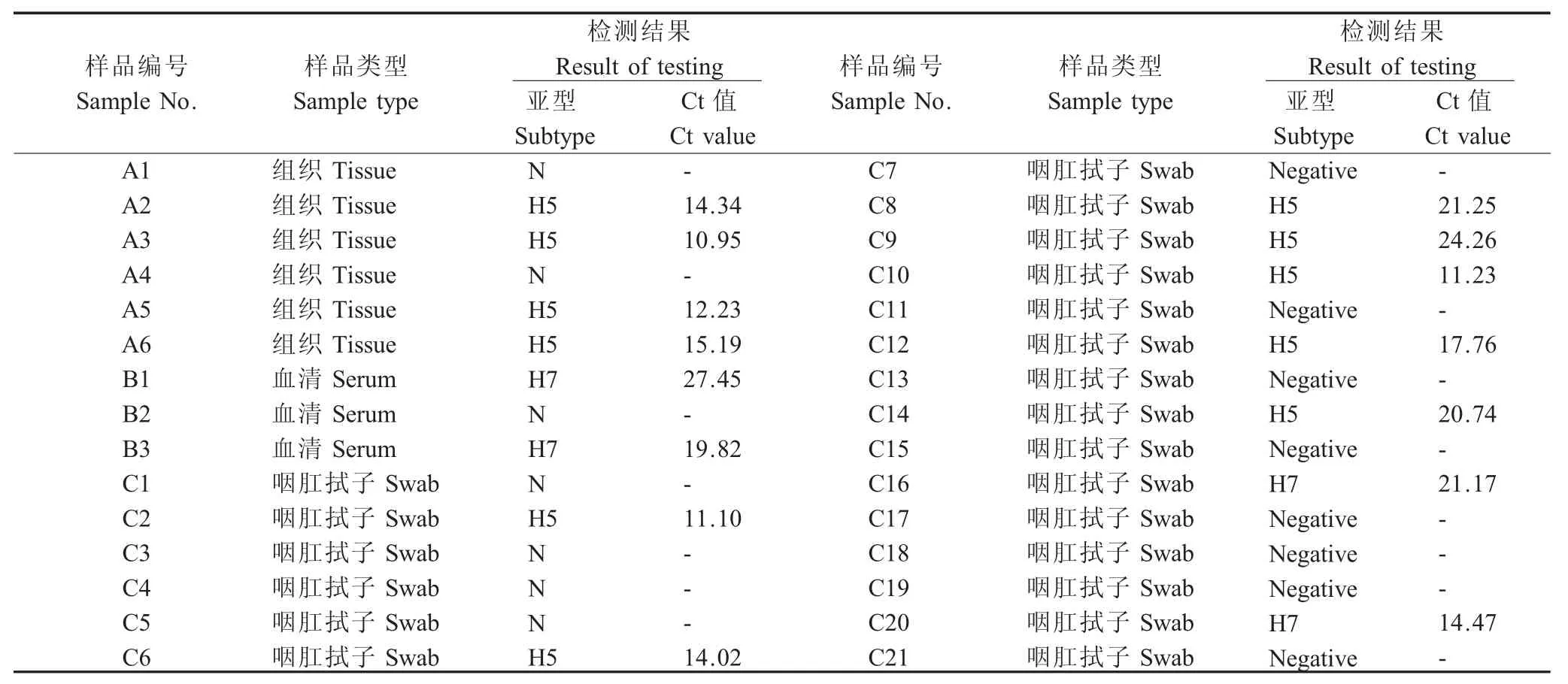
表5 临床样品信息和检测结果Table 5 Clinical samples and result of testing

图4 临床样品检测扩增峰图Fig.4 Results of clinical sample detection
应用本研究所建立的方法,对HPAIV、LPAVI、NDV、IBV、IBDV 等15 种常见禽病病毒以及MS、MG、沙门氏菌等病原体进行检测,结果显示,所建立的方法可特异性检测出H5 或H7 亚型禽流感病毒,可见特异性扩增曲线峰,而对其它所有病原体检测结果均为阴性,无任何特异扩增曲线峰。因此,该方法具有较强的特异性。王振全等建立了可同时检测H5 亚型HPAIV、狂犬病病毒、猪链球菌2 型等6 种病原的杂交基因芯片检测方法,检测的灵敏度在 1.38×10-5pg/μL~151 pg/μL 之间,略高于常规荧光定量RT-PCR 方法[11]。本研究建立的方法最低可检测到1×101TCID50/mL 的AIV,比常规荧光定量RT-PCR 检测方法高约10 倍,因此本研究建立的方法与已报道的基因芯片检测方法在敏感性上类似或略高,完全达到常规检测的要求。推测本研究方法因扩增反应体积非常小(<2 μL),而且 PCR 反应室的芯片为特制材料,不同于普通塑料,反应时升降温迅速,温控好,芯片内温度均匀,因此,在反应中酶的活性能更充分地发挥,最终使得反应体系的扩增效率和敏感性更高,反应过程也更稳定。此外,本研究选取8 份阳性样本,利用同一批次和不同批次的试剂盒,对阳性样本进行检测,分析检测结果,评价其批内和批间重复性检测情况。结果显示,批内和批间重复性检测的变异系数均<2 %,表明该方法的重复性好。最后,本研究对30 份临床样品进行了检测,结果与普通RT-PCR 和测序结果完全一致,证实该方法可在基层用于临床样品现场检测。因此,该检测方法克服了传统检测方法的缺点,具有单管封闭操作防污染、自动化程度高、特异性强、灵敏度高、操作简便、耗时少、可实时监控等优点。
核酸分析是微芯片在热循环期间同时读取在每个反应器上由PCR 产物产生的荧光信号,本研究采用的微芯片技术不同于目前常用的塑料PCR 管作为载体盛载PCR 反应体系,而是采用金属载体微芯片,反应体系及样本直接加到金属载体上进行RT-PCR 扩增。金属载体热传导效率和升降温速率快,可大幅度缩短反应时间,而且,一次反应可同时检测30 个样品。本研究结果显示,所建立的检测方法运行时间不到40 min,而常规荧光定量RT-PCR 反应时间一般约为120 min,因此,该方法大大缩短了反应时间,将运行时间缩短约2/3;另外,该检测方法所需的反应体系最少仅为1.2 μL,只需微量试剂和病毒核酸即可检测,而常规荧光定量RT-PCR 反应体系一般为20 μL 左右,因此,与常规荧光定量RT-PCR 相比,反应体系缩小了近20倍;所需的扩增反应试剂因已冻干,无需冰冻,可方便地进行常温保存和运输至基层应用,解决了常规方法中试剂需低温保存运输以及试剂反复冻融可能会影响检测结果的问题,因此,该方法非常适用于基层养殖场现场检测。另外,该方法可同时检测H5 和H7 亚型AIV,大大减少了成本和人力。所配套的荧光RT-PCR 循环仪体积小、重量轻,仅约2.5 kg,便于随身携带进行现场检测。
综上所述,本研究通过设计和优化特异性引物和探针,巧妙地将双重荧光RT-PCR 技术、冻干技术以及微芯片技术相结合,最终建立了可有效鉴别检测H5 亚型和H7 亚型HPAIV 的新型检测方法。应用该技术对临床采集的样品进行检测后证实,该方法敏感、特异、简便、快速,具有广阔的市场开发和应用前景。

