持续性内切纤维素酶高效催化的研究进展
陶 敏, 王振兴, 陈晓艺, 李宪臻
(大连工业大学 生物工程学院,辽宁 大连 116034)
纤维素的生物降解通常需要3种酶的协同作用,包括内切纤维素酶(Endoglucanase,EC3.2.1.4)、外切纤维素酶(Cellobiohydrolase,EC3.2.1.91)和β-葡萄糖苷酶(β-glucosidase,EC3.2.1.21)[1]。其中,外切纤维素酶主要作用于纤维素的结晶区域,被认为是纤维素生物降解过程不可或缺的关键酶[2]。但已知有些微生物,如Cytophagahutchinsonii、Saccharophagusdegradans等,能够高效降解纤维素,但基因组序列中却不含有外切纤维素酶的编码基因[3-4]。研究发现,这些菌株能够编码产生一类特殊的内切纤维素酶,同时具备内切酶和外切酶活性,与β-葡萄糖苷酶协同作用即可高效降解纤维素。近年来,在其他纤维素降解菌株中也陆续发现了一些具有上述催化特性的“双功能酶”,这类特殊的内切酶被定义为持续性内切纤维素酶(Processive endoglucanase)[4],围绕它们的结构与功能已展开了许多研究,取得了一定的进展。
1 持续性内切纤维素酶的分布与归类
目前已报道的持续性内切纤维素酶基本上分布在GH5和GH9两大糖苷水解酶家族。GH9家族的持续性内切纤维素酶常见于梭菌属,如热纤梭菌(Clostridiumthermocellum)、解纤维梭菌(Clostridiumcellulolyticum)、食纤维素梭菌(Clostridumcellulovorans)和植物梭状芽胞杆菌(Clostridiumphytofermentans)等[5-8],其他微生物来源还包括嗜热单胞菌(Thermobifidafusca)、类芽胞杆菌(Paenibacillusbarcinonensis)和赭曲霉(Aspergillusochraceus)等[9-11]。这些酶蛋白除了含有GH9催化结构域外,通常还含有一个或多个碳水化合物结合模块(CBM),CBM对于酶蛋白的持续性降解能力起到至关重要的作用,一旦去除CBM,它们的催化能力则与普通内切酶无异。
GH5家族持续性内切酶的微生物来源则比较广泛,结构也更为多样性。来源于Volvariellavolvacea的纤维素内切酶EG1含有一个CBM1模块和一个GH5催化结构域,其中CBM1对整个酶蛋白的持续性降解能力是不可或缺的[12]。相反,来源于Saccharophagusdegradans2-40的持续性内切酶Cel5H,虽然含有一个CBM6模块,但该模块结构的去除并不影响酶蛋白原有的催化性质[4]。此外,根据已有报道,来源于褐腐毛叶担子菌(brown-rot basidiomyceteGloeophyllumtrabeum)的Cel5A和来源于哈氏噬纤维菌(Cytophagahutchinsonii)的CHU_2103,这两个酶蛋白同样属于持续性内切纤维素酶,但结构中却并不含有碳水化合物结合模块,它们的持续性降解能力只取决于催化结构域[13-14]。由此可见,与GH9家族蛋白不同,CBM模块对于GH5家族持续性纤维素内切酶的催化功能并非是必需的。
2 持续性内切纤维素酶的表征
普通内切酶在水解纤维素底物时,通常是从纤维素长链的内部随机切割β-1,4-糖苷键,产生长度不等的纤维寡糖。外切纤维素酶则是从纤维素分子或者内切酶作用生成的寡糖链末端开始,依次对两个葡萄糖单元进行水解,水解产物为纤维二糖。这种连续切割底物并释放产物的作用方式是外切酶水解模式的典型特征,也即酶的持续性催化(Processivity)[15]。
区分一个纤维素水解酶是内切酶还是外切酶,有以下几种判断方法:首先,内切酶作用于CMC时,能够使底物的黏度迅速下降,而外切酶通常不具备这一能力[16];其次,外切酶能够水解pNPC释放出pNP,这一反应常被用来测定外切酶的酶活力,而内切酶大多不能够以pNPC为底物进行反应[17];第三,水解不溶性底物(如滤纸、微晶纤维素等)时,内切酶能够产生30%~50%的可溶性还原糖或者30%~40%的不可溶性还原末端,而外切酶一般会生成超过90%的可溶性还原糖或<10%的不可溶性还原末端[16,18]。
持续性内切纤维素酶是近年来被发现的一类特殊的双功能酶,既表现出内切酶的特征,同时又具有外切酶的持续水解能力。作用于CMC时可使其黏度迅速降低,能够水解pNPC生成pNP[19];作用于滤纸、微晶纤维素等不溶性底物时,产物以纤维二糖为主,同时含有少量单糖、三糖等其他小分子糖;能够与外切酶或普通内切酶协同作用,提高纤维素的水解效率[9]。此类酶的催化特征介于内切酶和外切酶之间,水解不溶性底物时所释放出的可溶性还原糖比例远大于普通内切酶。例如,来源于BacillussubtilisBS-5的EG5C (BsEG5C),水解磷酸溶胀纤维素(PASC)可生成69.6%的可溶性还原糖[20];来源于Thermobifidafusca的Cel9A(TfCel9A)作用于滤纸时,生成的可溶性与不可溶性产物的比例分别约为87%和13%[9];而来源于Cytophagahutchinsonii的CHU_2103 (ChCHU_2103)作用于再生无定形纤维素(RAC)时,经过3 h反应,能够生成80%左右的可溶性还原糖[14]。
持续性内切纤维素酶的持续催化能力通常用水解不溶性纤维素底物时所生成的可溶性与不可溶性还原糖(末端)的比例(Processive ratio)来表征。其中,可溶性还原糖存在于反应液上清中,可用DNS法进行测定;不可溶性还原糖指的是剩余底物中所包含的还原性末端,一般用BCA法来定量,需注意的是,底物上结合的酶蛋白需事先用盐酸胍(6 mol/L)去除,以免影响测量的精确度[21]。上述方法虽被广泛用于持续性内切纤维素酶水解能力的表征,但有一定的局限性,即实验结果在很大程度上依赖于所选用的纤维素底物。常用的不溶性底物包括滤纸(Whatman)、微晶纤维素(Avicel)、磷酸溶胀纤维素(PASC)和再生无定形纤维素(RAC),底物的聚合度不同,游离末端数量的差异,都会影响酶反应所生成可溶性糖的数量,进而导致测量结果的差异[22],因此在比较不同来源酶的催化能力时,应注意所用底物的差异。
3 持续性内切纤维素酶的模块化结构
如上所述,目前已报道的持续性内切纤维素酶主要分布在GH5和GH9两个家族,它们大多数都由多个结构域组成,除了催化结构域外,还常常与CBM相连。对具有模块化结构的纤维素酶来说,CBM的功能普遍认为是帮助酶蛋白识别并结合不溶性底物分子,从而增强酶对底物的亲和力,提高酶促反应效率[23-24]。在持续性内切纤维素酶分子结构中,尤其是多模块化组合的酶蛋白,CBM除了影响酶的底物特异性和催化活性,也对酶的持续催化能力表现出多样性的影响。
GH9家族持续性内切纤维素酶的模块化组合较为稳定,绝大多数催化结构域与CBM3c相连,有的还额外连接多个CBM,如CBM2、CBM3b或CBMX2。ThermobifidafuscaCel9A(TfCel9A)是第一个被发现的持续性内切纤维素酶,其催化结构域位于成熟蛋白的N端,后面分别连接有一个CBM3c、一个纤连蛋白Ⅲ(Fibronectin type 3,Fn3)和一个CBM2模块。Li等[9]通过实验证实,CBM3c对TfCel9A的纤维素水解以及底物结合能力是必不可缺的,去除CBM3c后酶蛋白几乎失去纤维素水解能力。但是,在对CBM3c结构域中6个关键氨基酸残基进行了单/双突变(Y520A、D513A、I514H、R557A/E559A、F476A和R563A)后,绝大多数突变体蛋白的持续催化能力非但没有下降,反而有所提高,说明CBM3c并不直接影响酶的持续催化能力。与TfCel9A模块化组合相似的另外一个持续性内切酶是PaenibacillusbarcinonensisCel9B (PbCel9B),区别在于CBM3b取代了TfCel9A中的CBM2。CBM3c或CBM3b的缺失都在很大程度上影响PbCel9B对结晶纤维素的水解能力,但酶蛋白与底物的结合则主要取决于CBM3b,与CBM3c无关[10]。
Gilad等[5]在研究ClostridiumthermocellumCelI时发现,CBM3c的缺失会导致酶几乎失活,而去除CBM3b时,酶对结晶纤维素的水解能力降低,但CMC酶活力(CMCase)反而有所升高,由此也进一步证实CBM3b对结晶纤维素具有较强的吸附结合能力。此外,ClostridiumcellulosiCel9A(CcCel9A)含有5个CBM,在催化结构域之后依次连接着CBM3c、CBMX2、CBMX2、CBMX2和CBM3b。去除CBM3c,该酶的持续催化能力以及水解结晶纤维素的能力完全丧失,而CBM3b和CBMX2也在一定程度上影响酶的催化活性以及底物结合能力[25]。总体而言,CBM3c对GH9家族酶蛋白具有持续催化能力并水解结晶纤维素是至关重要的,其他CBM如CBM3b、CBMX2等,则通常与酶的底物结合特异性或者持续催化能力有一定的关联。
GH5家族持续性内切纤维素酶的序列差异性较大,模块化组合多样。菌株Saccharophagusdegradans2-40(SdCel5H)含有3个持续性内切酶CelG、Cel5H和Cel5J,它们的催化结构域(N端)均与CBM6(C端)相连,研究表明,缺失CBM6并不影响上述酶蛋白原有的活性和持续催化能力[4]。HahellachejuensisCel5的结构与SdCel5H非常相近,同样CBM6对于该蛋白保持纤维素水解活性以及持续催化能力并非是必需的[26]。与之相反,对于VolvaviellavolvaceaEG1来说,其催化结构域N端连接的CBM1则显著影响酶的活性,去除CBM1后,酶的持续催化能力大大减弱[12]。Pan等[27]在FomitiporiamediterraneaFmEG(本身不含CBM)催化结构域的N端融合了一个CBM1后发现,CBM1的加入大大提高了重组蛋白对结晶纤维素的结合和水解能力,同时也使得酶具有了很高的持续催化能力。由此可见,CBM对GH5家族内切纤维素酶的持续催化能力表现出了截然相反的两种影响。
此外,目前还发现有两个特殊的持续性内切纤维素酶,分别是GloeophyllumtrabeumCel5A[13]和CytophagahutchinsoniiCHU_2103[14],它们不含CBM,序列结构中仅有一个催化结构域,但却有很强的持续催化水解纤维素的能力。与之类似,Wu等[20]在研究来源于BacillussubtilisBS-5的内切酶BsEG5C时发现,该酶蛋白由一个催化结构域和一个CBM3模块组合而成,本身不具备持续催化能力,但去除CBM3的突变体蛋白EG5C-1(BsEG5C-1)却表现出高效的持续性催化能力。与BsEG5C相比,BsEG5C-1对滤纸等不溶性底物的水解能力大大提高,且热稳定性也有所提升,推测可能与CBM3自身的热不稳定性有关。综上所述,模块化结构对于GH5家族内切酶的持续催化能力并不是必需的,也可能与CBM的种类及其在序列结构中的位置有关。随着更多持续性内切酶的发现及对序列结构的深入研究,或许能够有助于发现其内在的规律,从而更好地理解CBM对内切酶持续催化能力的影响。
4 持续性内切纤维素酶催化中心的架构及关键催化位点
外切纤维素酶的活性中心通常具有封闭的孔道结构,允许单根纤维素链进入孔道中并逐步被水解,产物为纤维二糖。例如,来源于里氏木霉(Trichodermareesei)的Cel7A是一个典型的外切纤维素酶,该酶蛋白的催化位点位于一个由β-片层和长环(Loop)结构形成的通道中,Loop环位于催化通道的顶端,呈现袋状结构,只允许纤维素链的末端进入通道中进行水解。Loop环结构有助于酶蛋白牢固地与底物结合,并持续水解作用[28]。内切酶与外切酶结构上最重要的区别在于,内切酶的活性中心通常位于一个开放的裂隙(凹槽)中,允许整条纤维素链进入,但由于没有Loop结构,酶与纤维素的结合力也较弱[29](图1)。尽管具有外切酶催化活性,持续性内切纤维素酶在结构上却与普通内切酶更为接近,其催化结构域也呈一个开放的凹槽,没有Loop结构[25]。这类酶分子能够持续性降解结晶纤维素的催化机制目前并不十分清楚,根据已有的一些报道,可能与催化中心的某些关键氨基酸残基有关。
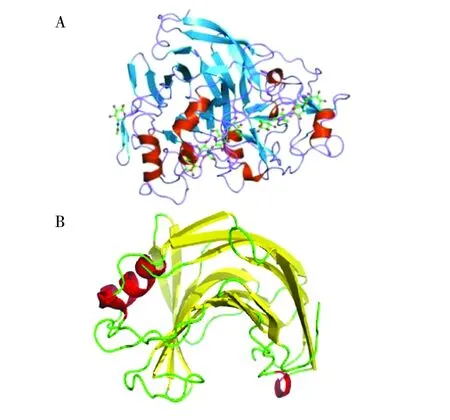
图1 外切酶(A)和内切酶(B)催化结构域的立体结构示意图[35]Fig.1 Schematic diagram of catalytic domain of CBH (A )and EG (B)[35]
Zhou等[30]研究了TfCel9A的催化结构域序列,发现催化活性中心的H125和Y206是两个关键催化位点,它们与D55、D58以及底物的Glc(-1) O1共同形成一个氢键网络,对酶蛋白具有催化活性起至关重要的作用。除R378外,实验中所有催化中心的氨基酸突变(W128、F205、W209、W256、D261、W313、R317)都导致酶蛋白的持续催化能力显著降低甚至完全丧失,而CBM3c结构域的氨基酸突变则对酶的持续催化能力几乎没有影响,说明TfCel9A的持续催化功能主要取决于活性中心与纤维素底物的相互作用,而CBM3c并不直接影响酶的持续催化能力。同样,Zhang等[25]在研究CcCel9A时发现,该酶蛋白的催化中心包含3个高度保守的氨基酸残基(Y203、D258和R374),它们分别位于底物结合位点的-1、-4和+1/+2位,双突变体蛋白Y203A/Y424A、Y253A/D258A以及R374A/Y415A的催化活性大大降低,而与底物结合位点相关的其他氨基酸残基突变同样导致酶活力及持续催化能力的下降或丧失。研究表明,+1和+2两个底物结合位点通过与纤维素分子强烈的疏水相互作用,在底物结合以及催化降解过程中起着重要作用。
CytophagahutchinsoniiCel5A(ChCel5A)是不含有CBM的持续性内切纤维素酶,其活性中心入口处的2个色氨酸残基(W61和W308)突变,导致酶蛋白对滤纸的降解能力显著降低,而CMC的活性几乎不受影响[31]。随后,Zhang等[14]研究同样来源于Cytophagahutchinsonii的ChCHU_2103酶蛋白时发现,其催化中心的保守氨基酸残基W197突变,直接影响酶与底物的结合以及酶的持续催化能力。将BacillussubtilisBS-5内切酶BsEG5C的CBM3去除后得到的突变体蛋白BsEG5C-1,其催化中心含有7个芳香族氨基酸残基(W69、Y70、Y96、W207、Y231、F238和W291),将它们分别突变为丙氨酸,结果发现除F238A外,其他所有突变体蛋白的纤维素降解能力均显著下降或完全丧失,但与底物的结合能力不受影响。F238A蛋白的CMC酶活较原始蛋白基本不变(>90%),但对滤纸、微晶纤维素以及pNPC的酶活力却大大降低,持续催化能力也显著减弱。由此说明,F238残基对BsEG5C-1酶蛋白持续催化降解结晶纤维素的能力至关重要[20]。很多研究也证实,持续性纤维素酶催化活性中心的芳香族氨基酸往往与酶的底物结合能力以及持续催化能力密切相关。
5 展 望
纤维素质原料生物转化的主要屏障在于缺乏具有高效水解能力的纤维素酶,往往需要多个酶的协同作用才可以将纤维素降解为可发酵的小分子糖,从而导致酶的成本十分高昂,难以满足工业化生产的需求。持续性内切纤维素酶是新近发现的一类同时具备内切酶和外切酶功能的双功能纤维素降解酶,可以高效降解纤维素为纤维二糖等小分子,与β-葡萄糖苷酶协同作用即可完成纤维素糖化过程。诸如BsEG5C-1、ChCHU_2103等不含CBM的持续性内切纤维素酶不但有很高的降解活力,且与纤维素底物的结合能力较弱,有助于在催化过程中对酶蛋白进行回收再利用,在一定程度上可大大节约酶的使用成本。此外,持续性内切纤维素酶对产物纤维二糖的反馈抑制作用不敏感,也可用以生产纤维二糖等非膳食性纤维寡糖(COS)[32]。体外实验证实,纤维二糖作为一种益生元,能够提高培养液中双歧杆菌、乳酸细菌以及短链脂肪酸的浓度[33-34]。由此可见,持续性内切纤维素酶由于其特殊的催化能力以及优异的转化性能,在能源、化工、食品等领域均有着良好的应用前景。
与纤维素外切酶不同,持续性内切纤维素酶虽具有持续催化水解纤维素的能力,但其催化中心的结构却与普通内切酶更为相近。CBM模块被普遍认为与纤维素酶的持续催化能力密切相关,但根据已有报道,CBM对于持续性内切纤维素酶的催化活性似乎并不是必需的,相反,催化活性中心的某些芳香族氨基酸残基对酶的持续催化能力则至关重要。目前,有关持续性内切纤维素酶的研究仍然较少,它们的持续催化机制也未得到解析。在现有研究基础上,进一步挖掘催化活性中心的序列信息,深入探讨酶蛋白结构与功能的关系,将有助于阐释此类酶的特殊催化机制,便于理性改造酶蛋白以提高其催化效率,为纤维素质原料的工业化生物转化提供新的可行性。

