林杆菌SK200a-9的重金属铊积累与钾离子的关系
刘姣姣, 刘菊梅, 张 笛, 木其尔, 袁 浩,赵 吉,2, 郭 永, 太田宽行, 包智华,2*
(1.内蒙古大学 生态与环境学院,内蒙古 呼和浩特 010021;2.内蒙古大学 内蒙古自治区环境污染控制与废物资源化重点实验室, 内蒙古 呼和浩特 010021;3.日本茨城大学 农学部,茨城县阿见町 300-0393)
1 材料与方法
1.1 材料
1.1.1 供试菌株 实验菌株Alsobactermetallidur-
ansSK200a-9和重金属污染沉积物分离菌株Bacillussp. HK1均由日本茨城大学太田宽行教授提供,-80 ℃冰箱保藏。
1.1.2 培养基及主要试剂 ①PY培养基(g/L)用于菌株复壮:酵母提取物2.0,蛋白胨10,MgSO4·7H2O 1.0;②AA合成培养基[15](g/L):Tris(50 mmol/L) 6.05,Na2SO40.5,KH2PO40.2,MgCl2·6H2O 0.4,NaCl 1.2,NH4Cl 0.3,KCl 0.3,CaCl20.11,酵母提取物 (Difco) 1,CH3COONa 20,微量元素溶液A 10 mL,微量元素溶液B 10 mL,刃天青溶液(0.1%) 10 mL,其中微量元素溶液A、微量元素溶液B及刃天青溶液(0.1%)需单独配制;③微量元素溶液A(g/L):EDTA(2Na)·2H2O 1,FeSO4·7H2O 2.5,ZnSO4·7H2O 0.2,H3BO30.05,CoCl2·6H2O 0.15,CuSO4·5H2O 0.15,NiCl2·6H2O 0.025,(NH4)6Mo7O24·4H2O 0.1,Na2WO4·2H2O 0.05;④微量元素溶液B(g/L):Na2SeO3·5H2O 0.05;⑤50 mmol/L的Tl储备液:准确称取2.60 g TlNO3,溶解于超纯水中,定容至200 mL;⑥ 256 mmol/L的KNO3储备液:准确称取5.18 g KNO3,溶解于超纯水中,定容至200 mL。
1.1.3 仪器与设备 高压灭菌锅(Auto clave-G136D,美国 ZEALWAY),恒温振荡培养箱(HZQ-F160,中国 HDL APPARATUS),高速冷冻离心机(ROTINA 380R,德国 Labsun),超微量紫外分光光度计(Nano Photometer P-class P360,德国 IMPLEN),原子吸收光谱仪(iCETM3300 AAS,美国 Thermo)。
1.2 方法
1.2.1 菌株生长曲线的测定 用无菌移液器吸取250 μL制备好的细胞悬液于10 mL含1 mmol/L Tl+的PY液体培养基中,以未添加Tl+的液体培养基作为空白对照,每组实验2个平行样,所有样品置于试管中,恒温振荡培养箱中30 ℃、160 r/min培养。在不同时刻取样,用紫外分光光度计测定660 nm处的光密度,绘制菌株生长曲线。
1.2.2 菌株对重金属铊的吸附实验 吸取20 mL用AA培养基制备好的细胞悬液于500 mL含1 mmol/L Tl+的AA液体培养基中,将培养基转移至恒温振荡培养箱中30 ℃、160 r/min培养,以未接种的培养基作为空白对照,每组实验2个平行样。在对数生长期将培养液离心(4 000 r/min,15 min),吸取5 mL上清液作为待测值,收集菌体。用5 mL 0.5 mmol/L EDTA洗脱菌体5次,每次洗脱之后4 000 r/min离心15 min,取上清液5 mL作为待测样品。将所有待测样品用0.22 μm滤膜过滤,原子吸收光谱仪测定样品中的Tl含量。
1.2.3 添加Tl对细胞内Tl+积累量的影响 在K+浓度为AA培养基中的原始浓度0.04 mmol/L的条件下,将菌株SK200a-9和HK1分别接种于装有500 mL AA培养基的锥形瓶中,设置Tl+最终浓度为0.05、0.1、0.5、1.0 mmol/L,选取未添加Tl+的培养液作为空白对照,每组实验2个平行样,30 ℃、160 r/min恒温培养。在对数生长期离心收集菌体,5 mL 0.5 mmol/L PIPES洗脱菌体5次后再次收集菌体。加入2 mL 60%浓硝酸,80 ℃消解3 h;冷却后加入500 μL H2O2,90 ℃水浴1 h;最后用1%浓硝酸补足至5 mL。0.22 μm的滤膜过滤,测定溶液中Tl+和K+的浓度。收集菌体80 ℃烘干8 h,用于细胞内离子浓度及生物量的计算。
1.2.4 添加K对细胞内Tl+积累量的影响 控制Tl+的浓度为1 mmol/L,调节K+的浓度为0、1、5、10 mmol/L,设置1组不加Tl+和K+的空白对照,每组实验2个平行样,30 ℃、160 r/min恒温培养。按照1.2.3方法考察添加K+对细胞内Tl+积累量的影响。
1.2.5 静止细胞实验 为测定细胞内积累的Tl+能否被K+逐出细胞外,在含有1 mmol/L Tl+培养基中培养菌株,在静止生长期取菌液5 mL作为待测样品(0时刻),向培养液中添加最终浓度为1 mmol/L的K+,待培养液静置5、10、30 min时分别取5 mL菌液作为待测样品。将所有待测样品按照1.2.2方法洗脱细胞外吸附的铊,测定细胞中的Tl+和K+浓度。
1.2.6 样品中元素的测定 使用原子吸收光谱仪测定溶液中Tl+和K+的浓度。0.22 μm 滤膜过滤所有待测样品,采用火焰原子吸收光谱法测定细胞中Tl+和K+的浓度。
1.2.7 细胞中离子浓度的计算公式c=ε×5÷η
式中:c为细胞中的离子浓度,ng/mg DW(DW指干重);ε为待测样品中的离子浓度,ng/mL;η为菌体干燥重量,mg。
2 结果与分析
2.1 菌株在不同培养条件的生长曲线
从图1可以看出菌株SK200a-9生长比较缓慢,在培养1 d后进入对数生长期,72 h的菌体光密度已接近峰值,OD660为0.97,进入稳定期;与空白对照相比,菌株SK200a-9在1 mmol/L Tl+胁迫下的生长基本不受抑制,说明该菌株对Tl具有较强的耐性。而对照菌株HK1生长较快,在培养12 h后进入对数生长期,培养24 h后进入稳定期;在1 mmol/L Tl+胁迫下的生长也基本不受抑制,说明该菌株对Tl也具有较强的耐性。

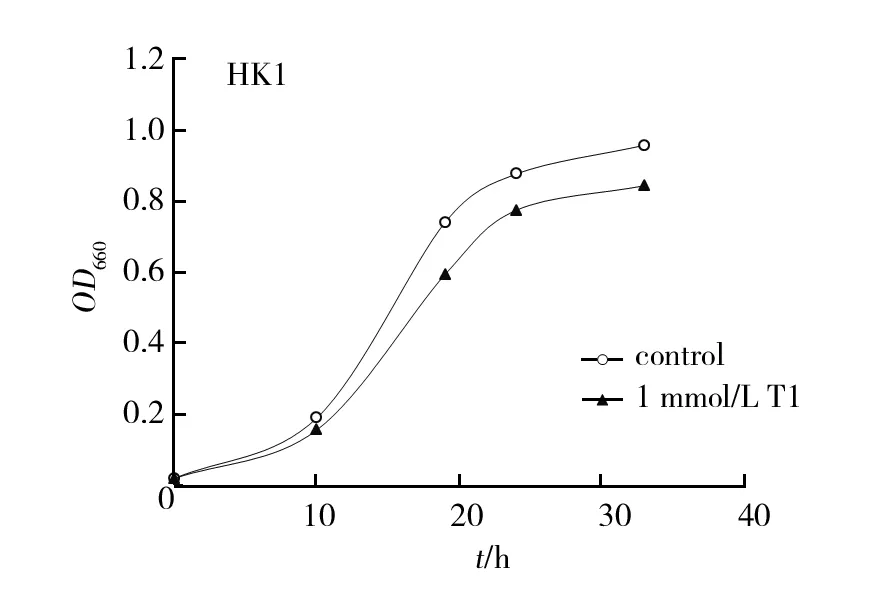
图1 菌株的生长曲线Fig.1 Growth curve of strains
2.2 菌株对Tl+的体外吸附
为了准确测定细胞内Tl+的积累量,进行了完全去除菌株SK200a-9和HK1细胞外吸附的Tl+的预实验。添加Tl+浓度为1 mmol/L,用0.5 mmol/L EDTA对细胞外吸附的Tl+进行洗脱。根据表1可知,洗脱4次才能将细胞外吸附的Tl+全部去除。所以在后续的细胞内Tl+的积累实验中,选择洗脱次数为5次,以保证实验结果的准确性。
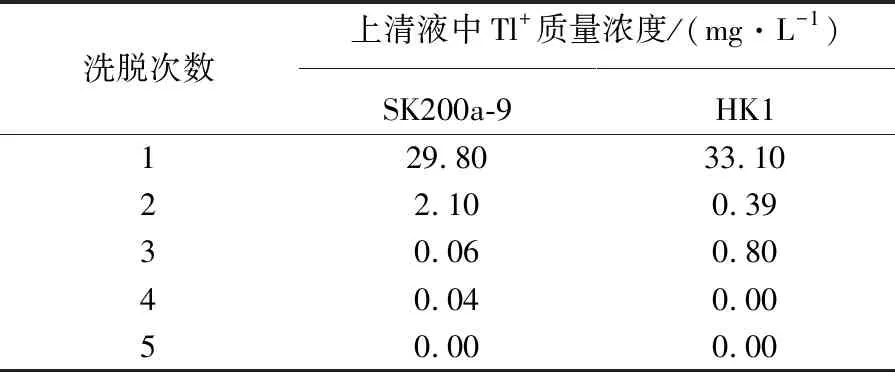
表1 洗脱次数与上清液中Tl+的质量浓度
2.3 不同浓度Tl+对细胞内Tl+积累量的影响
由图2可知,K+浓度为培养基内的原始浓度时(0.04 mmol/L),当Tl+浓度<1 mmol/L时,与空白对照组相比,随着培养基内Tl+浓度的增加,SK200a-9细胞内Tl+浓度增加的同时细胞内K+浓度减少,这可能是由于Tl的离子半径和K的离子半径相似,从而使Tl+通过K+运输系统代替K+进入细胞内。当Tl+浓度为1 mmol/L时,细胞内Tl+浓度达到最大量255.5 ng/mg DW,细胞内K+的浓度降到最低,为50.71%。而Tl+在对照菌株HK1细胞内最大积累量仅为41 ng/mg DW。此结果表明SK200a-9细胞内积累的Tl+远高于HK1,且细胞内的K+可能被Tl+代替。
2.4 K+添加对细胞内Tl+积累量的影响
由图3可知,当培养基内的Tl+浓度为1 mmol/L时,随着K+浓度的增加SK200a-9细胞内Tl+浓度增加(图3A)。当K+浓度为5 mmol/L时,细胞内Tl+的积累量达到最大值419.0 ng/mg DW,说明K+促进了Tl+在细胞内积累,可能是K+进入细胞时Tl+也随之进入,这些结果暗示了Tl+使用K+转运系统进入细胞内的可能性;当K+浓度>5 mmol/L时,随着K+浓度的增加细胞内Tl+的浓度开始降低,这可能是K+对Tl+在细胞内的积累产生了竞争。而菌株HK1在添加K+浓度为1 mmol/L时,细胞内Tl+的积累量达到最大值48 ng/mg DW,远低于SK200a-9细胞内的积累量。同时,在只添加Tl+或同时添加Tl+和K+的培养基内,菌株SK200a-9的最大生长量相对值基本没有变化(图3A),这说明1 mmol/L Tl+并不会对菌株SK200a-9的生长产生抑制作用,菌株SK200a-9对重金属铊具有较强的耐性;菌株HK1的最大生长量稍有降低(图3B),说明其对铊也具有较强的耐性。
2.5 静止细胞实验
由图4可知,在添加K+之前向培养基中添加1 mmol/L Tl+,30 ℃、160 r/min振荡培养,在对数生长期时菌体细胞内Tl+的积累量为100%,随后向培养基中加入终浓度为1 mmol/L的K+,在细胞的静置时间为5~30 min内,与对照菌株HK1相比(图4B),SK200a-9细胞内的Tl+浓度由于K+的添加而随时间明显降低,细胞内K+浓度由于K+的添加而明显升高(图4A)。结果表明由于K+的加入,SK200a-9细胞内积累的Tl+向外排出,同时细胞外的K+进入细胞内。
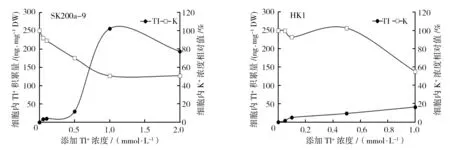
图2 Tl+的添加对菌株细胞内Tl+积累量及K+相对浓度的影响Fig.2 Effect of Tl+ addition on Tl+ accumulation and relative abundance of K+ in cells of strains
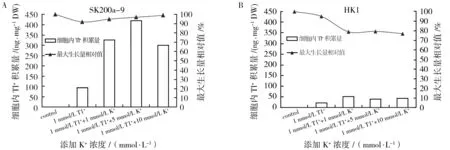
图3 K+添加对菌株细胞内Tl+积累量及生长量的影响Fig.3 Effect of K+ addition on Tl+ accumulation in cells and relative biomass of strains
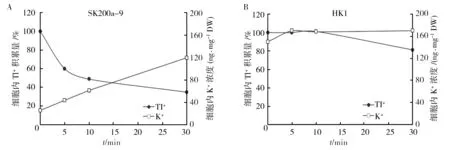
图4 菌株静止细胞在不同时刻细胞内Tl+的积累量Fig.4 The accumulation of Tl+ in static cells of strains at different time
3 讨 论
不同的微生物对铊的敏感程度、耐性机制有所差异。Norris等[19]进行了铊对微生物毒性的研究,耐性较低的巨大芽胞杆菌KM(MIC,0.015 mmol/L)、大肠埃希菌 (0.9 mmol/L) 和酿酒酵母 (0.75 mmol/L) 的铊毒性研究显示,巨大芽胞杆菌KM比酿酒酵母和大肠埃希菌对重金属Tl更敏感。本研究中使用的供试菌株SK200a-9(MIC,4.4 mmol/L)和HK1(MIC,3.9 mmol/L)铊耐性较强(Bao et al.,2006),在1 mmol/L Tl+胁迫条件下生长不受抑制。但是SK200a-9细胞内Tl+的最大积累量(255.5 ng/mg DW)远大于对照菌株HK1的积累量(41 ng/mg DW),说明SK200a-9菌体内的Tl+容许度大于HK1。这种差异可能是由于两株菌对Tl+的耐性机理不同造成的。培养基中1 mmol/L Tl+存在时SK200a-9细胞内Tl+基本达到饱和,但并没有产生毒性,原因可能有以下几个方面:①通过细胞表面吸附抑制其进入细胞内;②进入细胞后又排到细胞外降低对细胞的毒害作用;③进入细胞后与某些蛋白质结合失去其毒性;④转换成毒性较低的价态降低对细胞的毒害。
本研究中,培养基中K+和Tl+的浓度对菌株SK200a-9细胞内Tl+的积累量有很大影响,但对HK1基本没有影响。这与静止细胞实验结果比较类似:SK200a-9细胞内积累的Tl+被K+置换比较明显,而HK1不明显。添加K+明显促进了SK200a-9细胞内Tl+的积累,但对HK1的促进作用要小得多。这可能是由于两种生物体对K+和Tl+摄取的相对亲和力不同,Tl+作用的位点不同。Tl+和K+的比值增加到1∶5时细胞内Tl+浓度也最高(419 ng/mg DW),但对相对生物量几乎没有影响,说明K+的添加促进了细胞内Tl+的积累,而且Tl+优于K+保留在细胞中。已知研究表明Tl+在细胞内的积累与K+的运输系统有关[19],随培养基中Tl+浓度增加,其在细胞内积累量增加,K+浓度减少,这与本研究结果一致。而 Damper等[20]的研究表明大肠埃希菌对Tl+的积累主要通过Kdp(一种K+转运系统)或者Trk进行,而且细胞内积累的Tl+也被K+置换出细胞外。K+添加的SK200a-9静止细胞实验结果也暗示了Tl+在SK200a-9细胞内的积累是通过K+运输系统的可能性。
综上所述,铊耐性菌株SK200a-9细胞内Tl+积累量远大于菌株HK1。K+浓度为培养基中的原始浓度(0.04 mmol/L)时,由于Tl+的添加SK200a-9细胞内Tl+浓度增加,K+的浓度下降,表明SK200a-9细胞内的K+可能被Tl+代替,但无毒害作用;Tl+浓度为1 mmol/L时SK200a-9细胞内积累量达到255.5 ng/mg DW。K+的添加促进SK200a-9细胞内Tl+的积累。SK200a-9细胞内积累的Tl+,由于K+的加入而降低。根据以上结果初步判断,SK200a-9的铊耐性机理可能是Tl+代替K+进入细胞内积累,而K+也能使其排到细胞外。本研究中Tl+在细胞内积累过程中膜蛋白的变化等有待进一步研究。

