Survivin-shRNA对视网膜母细胞瘤HXO-RB44细胞增殖、凋亡、侵袭性及凋亡蛋白的影响
秦 静 张 坚 段大鹏 张 乐
视网膜母细胞瘤(retinoblastoma,RB)原发于视网膜,好发于儿童,是1种眼内的恶性肿瘤,危害性极大[1]。视网膜母细胞瘤治疗手段虽多,但多数患者预后仍差[2-3]。既往研究已证实Survivin基因与恶性肿瘤的发生、发展有密切关系,因此本实验通过构建重组腺病毒载体Survivin-shRNA并转染至HXO-RB44细胞后,检测细胞增殖活性、凋亡指数、侵袭性以及PCNA、CAS-3蛋白的表达水平,从而评估其对视网膜母细胞瘤的影响,研讨其可能机制。
1 材料与方法
1.1 主要实验细胞株
视网膜母细胞瘤HXO-RB44细胞(购自中科院上海细胞库)。
1.2 主要实验试剂及仪器
胎牛血清、双抗,美国Gibco公司;CAS-3、PCNA,美国Sigma公司;凋亡试剂盒,北京索莱宝科技有限公司;流式细胞仪,美国Becton Dickinson公司;显微镜成像系统,德国Leica公司。
1.3 HXO-RB44细胞培养
从液氮中取出先前冻存的活细胞,置水浴箱中,使其快速融化。吸出细胞悬液后加入培养液中,离心、吹打后移至含10%~15%胎牛血清、100 μg/ml双抗的培养液中培养。80%~90%细胞贴壁时传代。
1.4 Survivin-shRNA构建及转染
shRNA序列由上海吉凯公司设计合成,采用腺病毒介导,构建Survivin-shRNA载体,在6孔板中接种HXO-RB44细胞,待60%~80%细胞生长融合时转染。重组Survivin-shRNA转染HXO-RB44细胞后以1∶5的比例传代。按照不同处理方法分为Survivin-shRNA组、GFP组和CON组。
1.5 HXO-RB44细胞增殖抑制率检测
对数生长期的HXO-RB44细胞计数后接种于96孔培养板中,重复4孔,同时设对照组。培养24 h后加20 μlMTT,再继续培养4 h,每孔加150 μl DMSO。在平板震荡器中震荡10 min。应用酶联免疫检测仪,于490 nm波长处测定吸光度(OD)值,以空白对照孔OD值调零。按照公式计算细胞增殖抑制率:(1-实验组OD值/对照组OD值)×100%。
1.6 细胞凋亡率检测
应用Annexin V-FITC/PI双染色流式细胞术,检测HXO-RB44细胞凋亡率。取对数期生长的HXO-RB44细胞接种于细胞培养板,细胞密度约为105/ml。HXO-RB44细胞用胰酶消化后,1 500 rpm离心5 min。收集细胞用PBS重新悬浮细胞并调节细胞浓度。取100 μl HXO-RB44细胞悬液,在1 500 rpm离心5 min,然后加入500 μl的1×Binding Buffer、5 μl Annexin V-FITC及10 μl PI,室温下避光反应5~10 min后上流式细胞仪分析。
1.7 Transwell侵袭小室实验测细胞侵袭力
将Matrigel胶铺于培养小室滤膜上,每孔20~30 μl,37 ℃过夜凝胶,在膜的另一面涂上纤维粘连蛋白,约5×105细胞/ml 200 μl加入小室内,培养24 h后擦去膜上层细胞,将膜取下,甲醛室温固定30 min,苏木精染色,乙醇逐级脱水,二甲醛透明后,用刀片裁下膜,置于载玻片上,镜下计数。
1.8 Western blot检测HXO-RB44细胞PCNA、CAS-3蛋白表达
培养的HXO-RB44细胞同步化后,提取HXO-RB44细胞蛋白,BCA法测定蛋白浓度。SDS-PAGE电泳至溴酚蓝抵达分离胶底部结束电泳,入电转缓冲液平衡5 min后转膜。然后抗原抗体反应,并用辣根过氧化物酶化学增强剂显色反应。采用GAPDH进行标化,然后通过软件进行灰度扫描及定量。
1.9 统计学处理
应用SPSS 18.0软件包进行数据统计,多组样本比较采用单因素方差分析检验。
2 结果
2.1 Survivin-shRNA对HXO-RB44细胞增殖的影响
MTT结果表明,Survivin-shRNA对HXO-RB44细胞的生长有明显抑制作用。如图1所示,在24 h时,CON组的增殖抑制率为(7.69±1.12)%,GFP组的增殖抑制率为(8.06±1.26)%,而Survivin-shRNA组的增殖抑制率为(24.90±4.55)%,差异有显著性(P<0.05)。在48 h和72 h也有相同的趋势。另外,在CON组及GFP组中,72 h增殖率与24 h、48 h相比,差异无统计学意义 (P>0.05),而Survivin-shRNA组中,72 h时细胞增殖抑制率可达到(43.92±6.18)%,明显高于24 h的(24.90±4.55)%和48 h时的(27.35±5.23)%,差异均有显著性(P<0.05)。
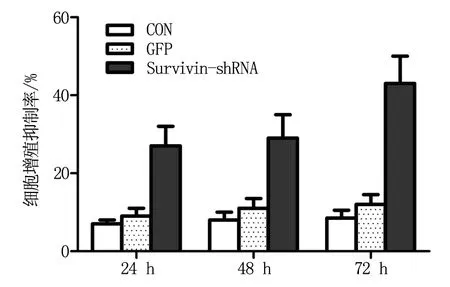
图1 各组HXO-RB44细胞增殖抑制率
2.2 Survivin-shRNA对HXO-RB44细胞凋亡的影响
流式细胞术检测发现,与Control组和GFP组相比,Survivin-shRNA组HXO-RB44细胞早期凋亡率增高,差异有显著性(P<0.05),见图2。

图2 流式细胞术检测各组HXO-RB44细胞凋亡率
2.3 Survivin-shRNA对HXO-RB44细胞侵袭性的影响
transwell侵袭小室实验结果发现,与对照组相比较,Survivin-shRNA组穿膜细胞数明显减少,差异具有统计学意义 (P<0.05),提示Survivin-shRNA能抑制HXO-RB44细胞的侵袭能力(图3)。
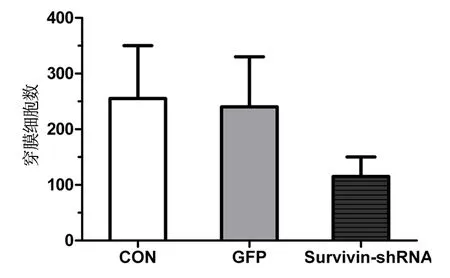
图3 各组HXO-RB44细胞穿膜细胞数比较
2.4 Survivin-shRNA对HXO-RB44细胞蛋白表达的影响
Westtern blot结果发现,Survivin-shRNA可降低PCNA蛋白的表达水平,并提高CAS-3的表达水平,见图4。
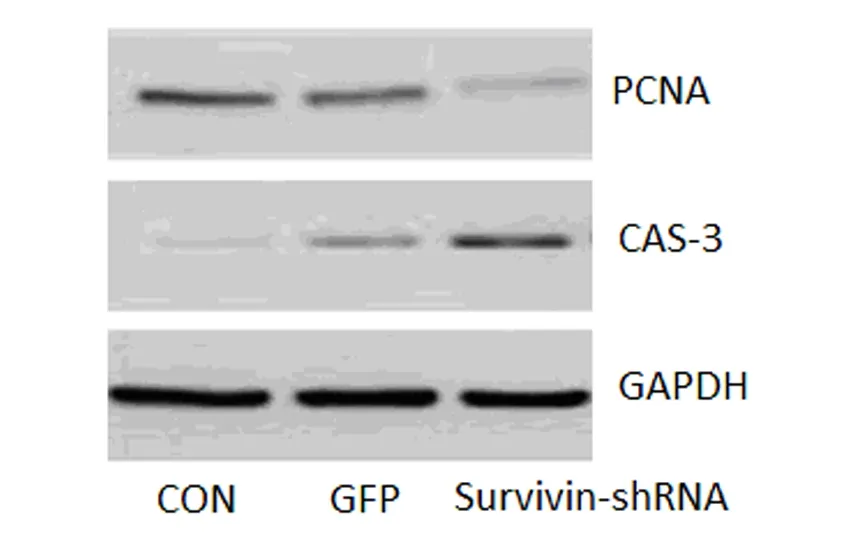
图4 各组HXO-RB44细胞蛋白表达水平
3 讨论
视网膜母细胞瘤在全世界发病率约为1∶20 000[4],其发病率有逐年上升的趋势[5],最早由Pawius报道。目前趋向于个性化综合治疗包括手术摘除眼球、化学减容法、外照射、激光、温热疗法、冷冻疗法及针对转移肿瘤的全身化疗等[6-7]。随着医学的进步,患者的生存率得到了极大地提高,但总体生存率仍低于50%[8-9]。
既往研究表明,Survivin在视网膜母细胞瘤中的特异表达,并与肿瘤的发生发展密切相关,国内外许多学者对Survivin基因与恶性肿瘤关系进行了深入研究,因此Survivin靶向治疗有可能会是1种有效的尝试[10]。基因治疗中,RNA干扰技术是其中的1种常用的方法靶向Survivin的基因干扰可阻断Survivin表达,从而抑制肿瘤细胞发生、发展及侵袭、转移[11]。靶向基因治疗具有特异性强等优点,一般不产生严重反应。
本研究结果显示,Survivin-shRNA可明显抑制HXO-RB44细胞的增殖,并且具有时间依赖性。Annexin V-FITC/PI双染色流式细胞术检测结果发现,Survivin-shRNA组细胞凋亡率较Control组和GFP组明显减少。transwell侵袭小室实验结果发现,与对照组相比,Survivin-shRNA组穿膜细胞数明显减少。以上表明,Survivin-shRNA可抑制视网膜母细胞瘤细胞增殖,诱导细胞凋亡,并抑制细胞的侵袭性生物学行为。
研究表明,细胞增殖与凋亡之间的平衡失调与肿瘤的发生发展密切相关,当细胞增殖增加或凋亡减少,则易致肿瘤发生发展。Caspase家族是研究细胞凋亡最常见的细胞因子,是细胞凋亡的执行者,决定了细胞凋亡的形态和生物化学改变[12]。当caspase受到抑制,使细胞凋亡障碍,就可能引起多种肿瘤的发生[13]。PCNA是DNA复制所必需的,并已被证明是肿瘤增殖1个重要的标记,Survivin的表达已被证实与视网膜母细胞瘤中PCNA和CAS-3密切相关[14-15]。我们的研究发现,敲除视网膜母细胞瘤细胞Survivin,可以下调PCNA的表达,上调CAS-3的表达,提示Survivin可能通过调节PCNA和CAS-3的表达参与视网膜母细胞瘤增殖和凋亡。
Survivin-shRNA抑制视网膜母细胞瘤细胞增殖,诱导细胞凋亡,并抑制其侵袭能力,其机制可能是通过调控PCNA、CAS-3蛋白的表达,激活相关细胞凋亡信号通路来完成。

