HPV-DNA联合SCC-Ag、CEA、HE4检测对宫颈癌患者的诊断价值研究
王元元 李 娜
女性高发恶性肿瘤之一为宫颈癌,具有极高发病率,有调查显示,女性恶性肿瘤中,宫颈癌发病率仅次于乳腺癌,严重威胁到患者生命健康[1-2]。我国宫颈癌发生率正呈2%/年~3%/年的速度持续增长[3]。人乳头瘤病毒(HPV)感染筛查属于预防宫颈癌疾病重要措施,已得到国际肿瘤预防机构认可[4]。鳞状细胞癌抗原(SCC-Ag)、癌胚抗原(CEA)、人附睾蛋白4(HE4)均为宫颈癌辅助诊断常用肿瘤标志物。本文以宫颈癌患者、宫颈癌前病变患者、宫颈炎患者各60例以同期健康体检者100例作为研究对象,探讨HPV-DNA联合SCC-Ag、CEA、HE4测定在宫颈癌患者诊断中的价值。现报告如下。
1 材料与方法
1.1 一般资料
选取2017年2月至2018年3月我院宫颈癌患者(宫颈癌组)、宫颈癌前病变患者(宫颈癌前病变组)、宫颈炎患者(宫颈炎组)各60例,并取同期健康体检女性100例纳入对照组。入选标准:病理学检查确诊为宫颈癌、宫颈癌前病变、宫颈炎;具有完整临床资料;入组前未接受任何治疗;心肝肾功能正常;采血时非经期;对研究知情,签署知情同意书;符合伦理委员会相关研究审批标准。排除标准:已经接受手术或者放化疗治疗;合并前列腺、消化系统、卵巢、胆道系统或者乳腺等相关病变;妊娠或者哺乳妇女;拒绝采集静脉血进行肿瘤标志物水平的检测。宫颈癌组患者年龄28~65岁,平均(46.78±4.85)岁;宫颈癌FIGO分期:Ⅰ期16例,Ⅱ期25例,Ⅲ期14例,Ⅳ期5例,包括37例鳞癌与23例腺癌。宫颈癌前病变组患者年龄26~68岁,平均(47.05±4.91)岁;宫颈炎组患者年龄25~67岁,平均(46.45±4.72)岁;对照组年龄20~62岁,平均(45.93±4.61)岁。
1.2 方法
HPV-DNA检测:以基因芯片法检测高危HPV-DNA,应用基因扩增仪(型号:WD-9402C)扩增基因,所用试剂购自北京阅微基因技术有限公司,然后杂交扩增后的基因与基因芯片(购自上海奇芯集团),如若信号灰度与背景灰度之间的差值超过4,则表明基因型阳性,本次共检测22种不同高危型别 (包括HPV16、18、31、33、35、39、42、43、44、51、52、53等)。
肿瘤标志物检测:抽取入选者清晨空腹静脉血大约3~5 ml,采用3000转/min速率离心10 min,然后分离血清;应用电化学发光分析仪(型号:罗氏E170)进行血清SCC-Ag、CEA水平的检测,试剂来自罗氏公司原装配套试剂;以酶联免疫吸附法进行血清HE4检测,其中检测试剂盒来自瑞典康乃格诊断公司。所有检测步骤均需严格参照试剂盒说明书。
1.3 观察指标
观察宫颈癌不同分期与4组SCC-Ag、CEA、HE4、HPV-DNA及联合检测阳性率,比较4组血清SCC-Ag、CEA、HE4表达水平、SCC-Ag、CEA、HE4、HPV-DNA单独检测与联合检测灵敏度、特异度、准确度。
SCC-Ag阳性标准:>1.5 ng/ml;CEA阳性标准:>5 ng/ml;HE4阳性标准:>150 U/ml。灵敏度=阳性检出例数/患者例数×100%;特异度=对照组阴性检出例数/对照组例数×100%;准确度=(患者阳性检出例数+健康对照组阴性检出例数)/总例数×100%[5]。
1.4 统计学分析
2 结果
2.1 4组血清SCC-Ag、CEA、HE4表达水平比较
对照组与宫颈炎组血清SCC-Ag、CEA、HE4表达水平比较无明显差异(P>0.05);宫颈癌前病变组与宫颈癌组各指标水平明显高于对照组与宫颈炎组(P<0.05),且宫颈癌组明显高于宫颈癌前病变组(P<0.05),见表1。

表1 4组血清SCC-Ag、CEA、HE4表达水平比较
注:与对照组比较,#为P<0.05;与宫颈炎组比较,*为P<0.05;与宫颈癌前病变组比较,△为P<0.05。
2.2 4组SCC-Ag、CEA、HE4、HPV-DNA及联合检测阳性率比较
宫颈癌前病变组与宫颈癌组SCC-Ag、CEA、HE4、HPV-DNA及联合检测阳性率均明显高于对照组、宫颈炎组(P<0.05),且宫颈癌组明显高于宫颈癌前病变组(P<0.05),见表2。
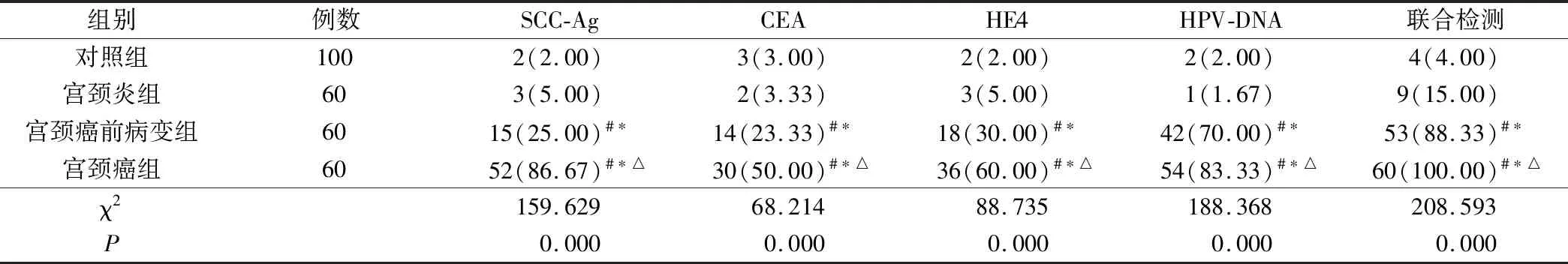
表2 4组SCC-Ag、CEA、HE4、HPV-DNA及联合检测阳性率比较(例,%)
注:与对照组比较,#为P<0.05;与宫颈炎组比较,*为P<0.05;与宫颈癌前病变组比较,△为P<0.05。
2.3 不同分期宫颈癌SCC-Ag、CEA、HE4、HPV-DNA及联合检测阳性率比较
Ⅰ/Ⅱ期患者SCC-Ag、CEA、HE4、HPV-DNA阳性率明显高于Ⅲ/Ⅳ期患者(P<0.05),见表3。

表3 2组不同分期宫颈癌SCC-Ag、CEA、HE4、HPV-DNA及联合检测阳性率比较(例,%)
2.4 SCC-Ag、CEA、HE4、HPV-DNA单独检测与联合检测灵敏度、特异度、准确度比较
联合检测灵敏度、准确度明显高于 SCC-Ag、CEA、HE4、HPV-DNA单独检测(P<0.05),见表4。
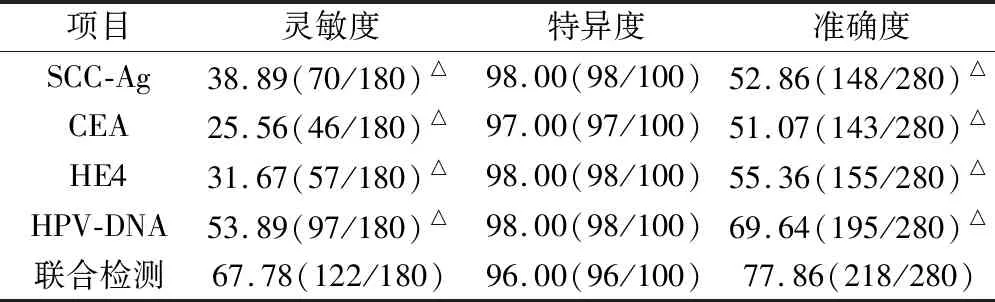
表4 SCC-Ag、CEA、HE4、HPV-DNA单独检测与联合检测灵敏度、特异度、准确度比较/%
注:与联合检测比较,△为P<0.05。
3 讨论
随着医学技术不断发展,医学界已经认识到HPV能引发宫颈癌。相关文献指出,99.8%左右宫颈癌患者产生HPV感染,HPV阴性者基本没有罹患宫颈癌可能性,HPV 属于引发宫颈癌病变直接因素[6-7]。故临床进行HPV-DNA 检测属于宫颈病变首选筛查方式,对HPV-DNA阳性患者采取及时有效治疗措施,为逆转宫颈病变以及防治宫颈癌关键。通常只有持续感染HPV,女性才可能产生宫颈癌,故如果HPV-DNA阴性,则体检者在往后3~5 年内无需再行相同检测[8-9]。
肿瘤标志物为人体细胞癌变出现、发展、浸润以及转移期间形成的或者宿主对肿瘤组织细胞反应性的相应活性物质,一般存在于癌变组织以及宿主体液之内,非肿瘤患者体液里面不存在或表达水平较低。宫颈肿瘤病变早期发展过程中,影像学无法检出,但是血液里面一些肿瘤标志物已产生不同程度升高趋势,故检测血液里面肿瘤标志物表达水平可成为早期诊断并发现肿瘤有效方法。现阶段,多项研究表明,肿瘤标志物可同时存在于正常与肿瘤组织、非肿瘤与肿瘤患者体液之内,但其表达质和量存在非常大的差异,却又具有相互交叉以及界限模糊特点[10-11]。在免疫学、现代分子生物学不断发展的背景下,宫颈癌患者血清里面多种肿瘤标志物逐渐得以被发现。其中,SCC-Ag为临床诊断宫颈癌相对可靠肿瘤标记物之一,已经广泛应用于宫颈磷癌早期诊断、治疗效果与预后判定、肿瘤复发转移监测中,然而其对宫颈腺癌或者腺鳞癌临床诊断价值并不高[12-13]。CEA主要存在于人体胃肠黏膜上皮、部分恶性肿瘤细胞表面上,比如肺癌、结肠癌以及乳腺癌等,其已经在多种肿瘤诊断中得带广泛应用,且开始应用于宫颈癌诊断中。HE4 属于近年来医学界发现的肿瘤标志物,首次发现于人附睾远端相应上皮细胞。相关研究指出,多种妇科肿瘤存在HE4高表达现象,比如子宫内膜癌与卵巢癌等女性腺癌组织[14-15]。
本组研究显示,健康对照组与宫颈炎组血清SCC-Ag、CEA、HE4表达水平比较无明显差异,但宫颈癌前病变组与宫颈癌组各指标水平明显高于其他两组,且宫颈癌组明显高于宫颈癌前病变组,表明随着宫颈病变发展,血清SCC-Ag、CEA、HE4水平亦明显升高。结果还显示,宫颈癌前病变组与宫颈癌组SCC-Ag、CEA、HE4、HPV-DNA及联合检测阳性率均明显高于其他两组,宫颈癌组明显高于宫颈癌前病变组,与潘静等[16]研究结论一致。说明宫颈病变越严重,阳性检出率越高。宫颈癌Ⅰ/Ⅱ期SCC-Ag、CEA、HE4、HPV-DNA阳性率明显高于Ⅲ/Ⅳ期患者,提示随着宫颈癌发展,肿瘤标志物与HPV-DNA阳性率显著升高。此外,联合检测灵敏度、准确度明显高于 SCC-Ag、CEA、HE4、HPV-DNA单独检测,表明相较于单种检测方式,SCC-Ag、CEA、HE4联合HPV-DNA检测能提高检测结果准确性与灵敏度。
综上,与单一检测相比HPV-DNA联合SCC-Ag、CEA、HE4检测可有效增加检测结果准确性与敏感度,宫颈癌分期越大,阳性检出率越高,能有效指导患者临床诊治。

