颈动脉内膜剥脱术治疗高分叉颈动脉狭窄27例报告
冯海宽 梁小龙 卫颖睿 刘爽 高恺明 佟小光
颈动脉内膜剥脱术 (carotid endarterectomy,CEA)被临床上公认为治疗因颈动脉狭窄而诱发的缺血性脑血管病的有效手段,是症状性颈动脉狭窄治疗的金标准[1]。颈动脉分叉的经典描述是位于甲状软骨上缘的水平,大致相当于C3-C4水平[2]。从胚胎发育而言,颈内动脉与颈总动脉起始于同一原始主动脉弓。因此,在胚胎发育过程中,由于颈外动脉发生及其生成时间延迟,可能引起颈总动脉与颈内动脉移行时间延长,导致高位的颈动脉分叉。但是针对病变血管严重钙化、走行迂曲,高度不稳定斑块,支架术后再狭窄以及严重的消化系统溃疡等血管内治疗手术禁忌的高分叉颈动脉狭窄的患者,可以将CEA作为防治脑卒中的首选手术方案。本文回顾分析27例高分叉颈动脉狭窄患者资料,探讨CEA治疗高分叉颈动脉狭窄的安全性及疗效。
1 资料与方法
1.1 一般资料纳入标准:①狭窄的颈动脉分叉均位于C2-C3及以上,符合 KOBAYASHI等[3]所定义的高分叉颈动脉标准;②患者均有行血管内治疗的手术绝对禁忌和/或相对禁忌;③支架后再狭窄;④病变颈内动脉严重迂曲。选取天津市环湖医院自2016年6月至2018年6月符合以上标准的患者27例,男21例,女6例,平均年龄(62.6±6.3)岁。在所有病例中,狭窄程度均采用北美症状性颈动脉内膜剥脱试验(NASCET)合作者的标准血管造影评估[4]。短暂性脑缺血发作(TIA)8例,合并糖尿病5例,高血压25例,冠心病7例。
1.2 辅助检查颈部血管超声提示颈动脉重度狭窄(70%~99%)19例,手术侧颈部血管近端收缩期峰值血液流速>240 cm/s,最高达447 cm/s;颈动脉中度狭窄(50%~69%)8例。颈部血管超声和/或高分辨磁共振示稳定性斑块5例;不稳定斑块22例,其中溃疡斑块17例,斑块内出血5例。颈部血管CTA提示颈动脉重度狭窄19例,中度狭窄8例。
1.3 治疗方法术前给予阿司匹林100 mg/d,口服5~7 d。静吸复合麻醉,垫肩置于颈部,头过伸位,切口延胸锁乳突肌前缘至乳突尖上3~4 cm,以此减轻胸锁乳突肌张力和暴露更佳的术野。钝性分离皮肤以及皮下组织,避免颈丛皮支、颈横神经以及耳大神经损伤。在解剖发育上,颈部的发育常常呈层层发育的特点,因此术中常常采用钝性分离和层层递进的原则。由于腮腺区筋膜与颈部筋膜连续,利用筋膜结构可以保护性的充分游离腮腺后叶并将腮腺后叶外翻,从而增加术野范围。当二腹肌后腹遮挡颈动脉分叉或颈内动脉上端时,可在肌腱处离断并翻向两侧,进一步显露颈内动脉病变部位,术后分别结扎两肌腱断端、固定。必要时可切断二腹肌后腹来更为直接的扩大术野显露。由于舌下神经位于二腹肌后下,因此,处理二腹肌时应注意舌下神经的损伤。必要时可行鼻腔插管,磨除部分下颌骨以获得更清晰的术野。切开病变血管之前,用10支2%利多卡因稀释于250 mL的生理盐水多次冲洗术野,避免牵拉颈动脉窦引起的反射性低血压以及严重的心律失常。尖刀切开血管后,用低分子肝素钠12500 U稀释于250 mL的生理盐水反复冲洗,防止新鲜血栓的形成,剥除增厚的内膜,务必清除剥离面的微小碎皮和浮动组织。7-0 Prolene缝线间断严密缝合颈总动脉及颈内动脉壁切口,按颈总动脉、颈外动脉和颈内动脉顺序依次打开临时阻断夹,恢复颈动脉血流。缝合结束后常规行术中荧光造影,确保上述动脉血流通畅。随后层层原则缝合颈部各层。术后终身口服阿司匹林肠溶片100 mg/d。
1.4 观察指标观察终点为术后1周,术后30 d或随访24个月不良事件的发生,不良事件包括缺血性脑卒中、缺血再灌注、TIA、心肌梗死以及死亡。随访观察患者术后1周、术后30 d、24个月不良事件发生率,并行神经功能评价,比较患者术前及术后的差别。
1.5 统计学方法应用SPSS 22.0行统计分析,CEA术前术后的狭窄程度通过配对样本t检验进行比较;NIHSS 评分采用M(QL,QU)描述,行配对样本比较的秩和检验。检验水准α=0.05。术前术后24个月长期随访,通过NIHSS评分来评价患者神经功能康复情况。
2 结果
2.1 治疗结果全组无手术死亡病例。术后复查颈部CTA (图1A、B),术前患者平均狭窄程度为89%±8%,术后平均狭窄程度7%±5%,差异有统计学意义(t=2.779,P<0.05)。头部磁共振灌注成像提示脑部供血均明显改善(图1C、D)。
2.2 随访效果术后出现短暂性声音嘶哑 2例;术后7 d内出现低血压1例,过灌注导致蛛网膜下腔出血1例。术后24个月随访,术前患者NIHSS评分为 1.89(1.53,2.63)分,术后 24 个月患者 NIHSS评分为 0.92(0.72,1.52)分,患者术后神经功能评价均有所好转或保持相同水平,差异有统计学意义(Z=-4.542,P<0.001)。
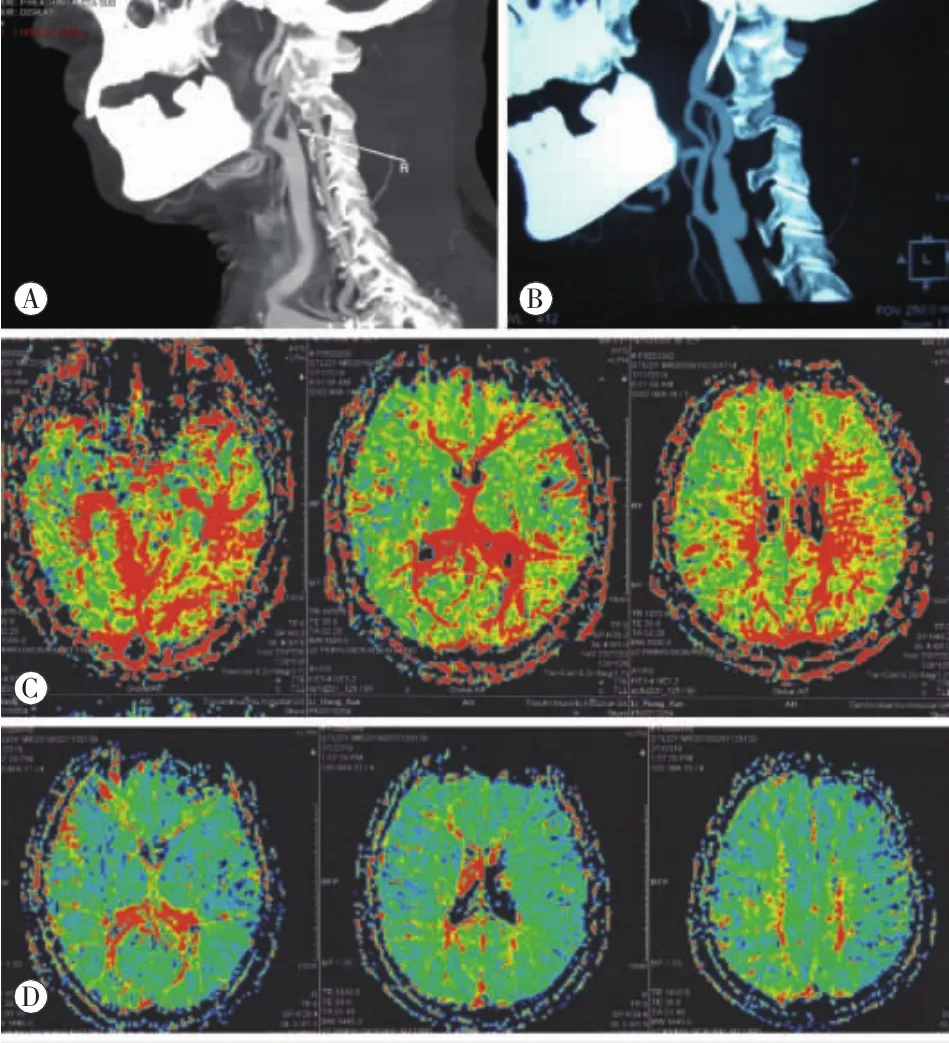
图1 A示患者颈动脉分叉偏高,同时颈内动脉狭窄高达C2,同时伴有严重迂曲;B为图A术后改变;C示术前头部磁共振灌注成像,左侧颞枕、左侧基底节区,左侧额顶低灌注改变;D术后头部磁共振灌注成像低灌注较前显著改善
3 讨论
缺血性脑卒中对健康相关生活质量(healthrelated quality of life,HR-QoL)有着深远的影响[5]。尽管调节动脉粥样硬化药物的应用不断扩大,但动脉粥样硬化性颈动脉狭窄仍然是缺血脑卒中主要危险因素[6]。无论CEA还是颈动脉支架成形术(CAS)均已被证明可以降低脑卒中的风险[7]。由于高位颈动脉分叉位于颅底,从而导致术野非常局限;其次,颈动脉鞘与周围颈部鞘膜联系紧密加之周围肌肉张力较高,手术难以充分暴露,操作空间狭小;舌下神经,舌咽神经以及迷走神经在颅底的走行较为集中。种种原因都致使CEA不是高分叉颈动脉狭窄的首选治疗,常常将血管内治疗作为高分叉颈动脉狭窄的手术治疗方案,但是针对病变血管严重钙化、走行迂曲,高度不稳定斑块,支架术后再狭窄以及严重的消化系统溃疡等血管内治疗手术禁忌的高分叉颈动脉狭窄的患者,可以将CEA作为防治脑卒中的首选手术方案。本次研究纳入的27例高分叉颈动脉狭窄患者中,有3例由于暴露颈动脉分叉时受颈袢神经干扰,从而剪断,缝合颈动脉完毕后再吻合颈袢神经;2例由于二腹肌严重影响颈动脉分叉的暴露,在牵拉二腹肌不佳的情况下,剪断二腹肌后腹,从而达到暴露颈动脉分叉的目的,缝合颈动脉完毕后再缝合二腹肌肌腹。患者术后均未见明显不适及并发症。对于高分叉的颈动脉狭窄就是要充分的暴露以分叉为中心的颈动脉,同时在暴露的过程中尽量减少对周围重要神经及血管的损伤。
本次研究纳入的27例患者中有5例患者颈动脉分叉及颈内动脉重度狭窄并伴有高度钙化,1例患者颈内血管严重迂曲。对于高度钙化或曲折的颈内动脉患者,CEA可能是最佳选择[8]。某些解剖学特征,如严重的同心钙化(3 mm宽,至少2个正交角)或血管曲度(2个弯曲点,在病变5 cm内超过90°),这种情况,支架可能无法在已经狭窄的血管中充分扩张以抵抗严重的钙化。CEA可以对高度钙化斑块进行完整剥离[9]。此外,还能将迂曲的血管进行牵拉,使高分叉下移,对血管的迂曲程度进行重塑,本中心对此类患者行CEA治疗,效果确切。本次研究有22例患者为不稳定斑块。有关研究表明,对于不稳定斑块(斑块内出血、纤维帽脱落,溃疡斑块)的患者,若行血管内治疗,导管反复在血管内操作会引起斑块脱落从而引起脑栓塞,行CEA可能更好[10]。应用CEA治疗颈动脉狭窄合并不稳定斑块,随访期间,所有患者均无再狭窄或卒中[11]。HENRY[12]报告了远端保护装置在169例血管内治疗中的应用,术后3d内的脑卒中发病率为2.7%,3周时有1例大面积脑卒中,1例脑梗死。对于不稳定斑块患者,发生脑卒中的可能性会更高。反之,CEA能够有效的减少这种情况的发生。本中心22例不稳定斑块患者均采用CEA进行治疗,手术顺利,术中及术后均无脑卒中的现象发生,进一步验证了应用CEA治疗此类型患者的安全性。本次研究有2例患者为CAS术后支架内再狭窄(ISR)。相关文献报告:CEA仍是治疗CAS术后ISR的主要手术方法[13]。在一项研究中,CEA摘除支架后,没有复发性狭窄,在接受手术治疗的49例患者中,有4例患者没有随访,其余45例患者平均随访时间为48.5个月[14]。若患者由于各种原因所导致的ISR并出现同侧脑卒中症状时,除了药物干预外,可以进一步选择CEA,从而对狭窄的颈部血管进行重塑。本中心2例ISR患者同时伴有同侧的脑卒中症状,在内科药物保守治疗效果欠佳后选择CEA治疗。这2例患者均在复合手术室行CEA,术后即刻脑血管造影可见病变血管血流增大,同时同侧颅内血管充盈显著改善。进一步证明了CEA治疗此类疾病的有效性。据相关研究报告[15],阿司匹林会引起上消化道出血,阿司匹林和氯吡格雷联合应用使消化道出血的概率会大大增加。若行血管内治疗,需要口服“阿司匹林肠溶片及氯吡格雷”抗血小板治疗,若有严重的消化系统溃疡出血的话,在口服“双抗”时可能会造成消化道大出血,从而危及生命。对于这种患者,行CEA治疗更为安全有效。27例高分叉颈动脉狭窄的患者,行CEA治疗后,血管狭窄均改善或显著改善,无脑梗死发生。
27例高分叉颈动脉狭窄患者中,有1例在术后发生了脑过度灌注综合征(CHS),并引起的蛛网膜下腔出血。该患者高血压病史5年,脑卒中病史2个月,经药物保守治疗1周后康复出院。CHS临床表现有头痛、呕吐、血压急剧升高,脑水肿或脑出血导致的神经功能障碍等症状。CEA后狭窄的血管恢复重塑,血流突然增多,缺血部位的脑组织原本适应的血供平衡被打破,从而产生不可逆的脑损伤。CHS的危险因素主要包括:高血压、糖尿病、严重的颈内动脉狭窄、高龄、既往有脑卒中病史等[16]。通过这项研究我们认识到,CHS总体发生概率很低,但一旦发生就可能导致颅内出血、脑组织水肿、脑血管痉挛甚至死亡的严重并发症,因此严格的控制围手术期血压,适当减少抗血小板药物,尤其对于本例患者,既往2月前存在脑卒中病史,可适当延长手术间隔时间,并将血压控制在相对稳定的水平可能会减少CHS的发生。本次研究中有2例出现短暂性的声音嘶哑,这是术中在暴露颈动脉时牵拉周围迷走神经所致,出院后全部康复。1例出现低血压,考虑这是有术中刺激颈动脉压力感受器所导致,术后立即予阿托品静点,并持续观察患者血压、心率等生命体征变化。术后1周好转出院。
综上所述,从本次研究并结合以往相关文献研究,可以得出结论:CEA治疗高分叉颈动脉狭窄是安全、有效的,尤其对于病变血管走行迂曲以及血管内治疗存在禁忌证的患者。

