糖尿病心肌病患者过氧化物酶增殖物激活受体水平变化的研究
李杰玉,张静,林玉玲,金文波
(郑州大学附属南阳市中心医院 1.内分泌科,2.感染肝病科,河南 郑州 473002)
糖尿病心肌病(diabetes cardiomyopathy, DCM)是一种特异性心肌病,其独立于高血压、冠状动脉粥样硬化性心脏病(以下简称冠心病),增加糖尿病合并心力衰竭的发病率和病死率[1]。目前,DCM 的发生机制尚不明确,可能与心肌细胞周围微小血管病变/血管内皮功能紊乱、细胞因子异常等心肌代谢紊乱因素有关[2-3]。过氧化物酶体增殖物激活受体家族(peroxisome proliferator-activated receptors, PPARs)是调节目标基因的核内受体转录因子超家族成员,具有促进脂肪细胞分化和脂肪生成、增强机体胰岛素敏感性、调节体内糖平衡、保护心血管等多种生物学效应[3]。PPARs受体家族主要包括PPARα、PPARβ/δ、PPARγ 3 种受体,PPARα 和PPARβ/δ 可通过氧化应激、炎症等多种方式参与心血管疾病进程,而激活PPARγ 能增加肝细胞生长因子表达、保护血管内皮功能[3]。目前,关于PPARs 受体家族与DCM 关系的研究仍较少,因此本研究通过观察PPARα、PPARβ/δ、PPARγ 3 种受体在DCM 患者中的表达水平,探讨3种受体对DCM 影响的可能机制。
1 资料与方法
1.1 研究对象
选取2015年10月—2017年10月郑州大学附属南阳市中心医院收治的DCM 患者(DCM 组)74 例。其中,男性44 例,女性30 例;年龄43~75 岁,平均(59.75±10.00)岁,糖尿病病程6~25年,平均(15.50±5.50)年。单纯糖尿病患者(T2DM 组)71例。其中,男性42 例,女性29 例;年龄44~74 岁,平均(59.00±9.80)岁;糖尿病病程5.5~24.0年,平均(15.00±5.00)年。另选取同期健康体检者70 例 作为对照(NC)组。其中,男性35 例,女性35 例;年龄45~75 岁,平均(60.15±10.50)岁。糖尿病诊断符合1999年世界卫生组织诊断标准,DCM 诊断标准为[4]:①明确患2 型糖尿病(type 2 diabetes mellitus, T2DM),糖尿病病程在5年以上;②心脏彩超明确存在心脏扩大伴收缩或存在舒张功能障碍;③除外冠心病、高血压、心肌炎、风湿性心脏病及其他类型心肌病引起的心力衰竭;④有心肌缺血或心力衰竭等症状;⑤冠状动脉造影显示无冠状动脉病变,但有其他微血管病变表现,如视网膜、肾血管病变。其中①②③为必要条件。排除标准:冠心病、高血压性心脏病、心肌炎、明显收缩功能受损等;合并糖尿病急性并发症、急性感染、严重肝肾功能异常、恶心肿瘤、皮质醇增多症,甲状腺功能亢进症等;近2 周内发生感染、服用胰岛素增敏剂、β-受体阻滞剂、阿托品、洋地黄类药物患者。经本院医学伦理委员会审核通过,并签署知情同意书。
1.2 研究方法
1.2.1 一般资料 收集入院后身高、体重、血压(SBP、DBP)、既往病史(高血压、高血脂),计算体重指数(body mass index, BMI)。空腹8~10 h 于次日晨起抽取肘静脉血检测空腹血糖(fasting plasma glucose, FPG)、空腹胰岛素(fasting insulin, FINS)、糖化血红蛋白(hemoglobin A1c, HbA1c)、血脂[低密度脂蛋白胆固醇(low density lipoprotein cholesterol, LDL-C)、高密度脂蛋白胆固醇(high density lipoprotein cholesterol, HDL-C)、甘油三酯(triglyceride, TG)、总胆固醇(total cholesterol, TC)]、C 肽(C-peptide, C-P)及高敏感C反应蛋白(high sensitivity C-reactive protein, hs-CRP)。采用日立7170A 型全自动生化分析仪测定LDL-C、HDL-C、TG、TC 和hs-CRP;葡萄糖氧化酶法测定FPG;放射免疫法测定FINS;高效液相色谱法测定HbA1c;微粒子化学发光免疫分析法测定C-P。
1.2.2 PPARs 受体水平检测 抽取空腹肘静脉血2 ml 置于EDTA 抗凝管中,3 000 r/min 离心10 min 后取上清液,分装置于EP 管中,采用ELISA 检测受体水平,操作步骤严格按照说明书进行,试剂盒购自北京鼎国生物技术有限责任公司,批内、批间变异系数均<10.0%。
1.3 统计学方法
数据分析采用SPSS 19.0 统计软件。计量资料以均数±标准差(±s)表示,两组比较用t检验,多组比较采用单因素方差分析,进一步两两比较采用LSD-t检验;计数资料以构成比(%)表示,比较采用 χ2检验,P<0.05 为差异有统计学意义。
2 结果
2.1 各组一般资料的比较
各组性别、年龄、糖尿病病程、BMI、血压、FINS、LDL-C、HDL-C、TC、C-P 及高血压、高脂血症 患者比例比较,差异无统计学意义(P>0.05)。各组FPG、HbA1c、TG 及hs-CRP 水平,经单因素方差分析,差异有统计学意义(P<0.05);进一步两两比较显示,与T2DM 组和NC 组比较,DCM 组FPG、HbA1c、TG及hs-CRP 均升高(P<0.05);与NC 组比较,T2DM组FPG、HbA1c 及TG 均升高(P<0.05)。见表1。
2.2 各组PPARs 水平的比较
各组PPARα、PPARβ/δ 及PPARγ 水平比较,经单因素方差分析,差异有统计学意义(P<0.05)。进一步两两比较显示,经LSD-t检验,与T2DM 组和NC组比较,DCM组PPARα和PPARγ升高(P<0.05),PPARβ/δ 降低(P<0.05);与NC 组比较,T2DM 组PPARα 和PPARγ 升高(P<0.05),PPARβ/δ 降低(P<0.05)。见表2。
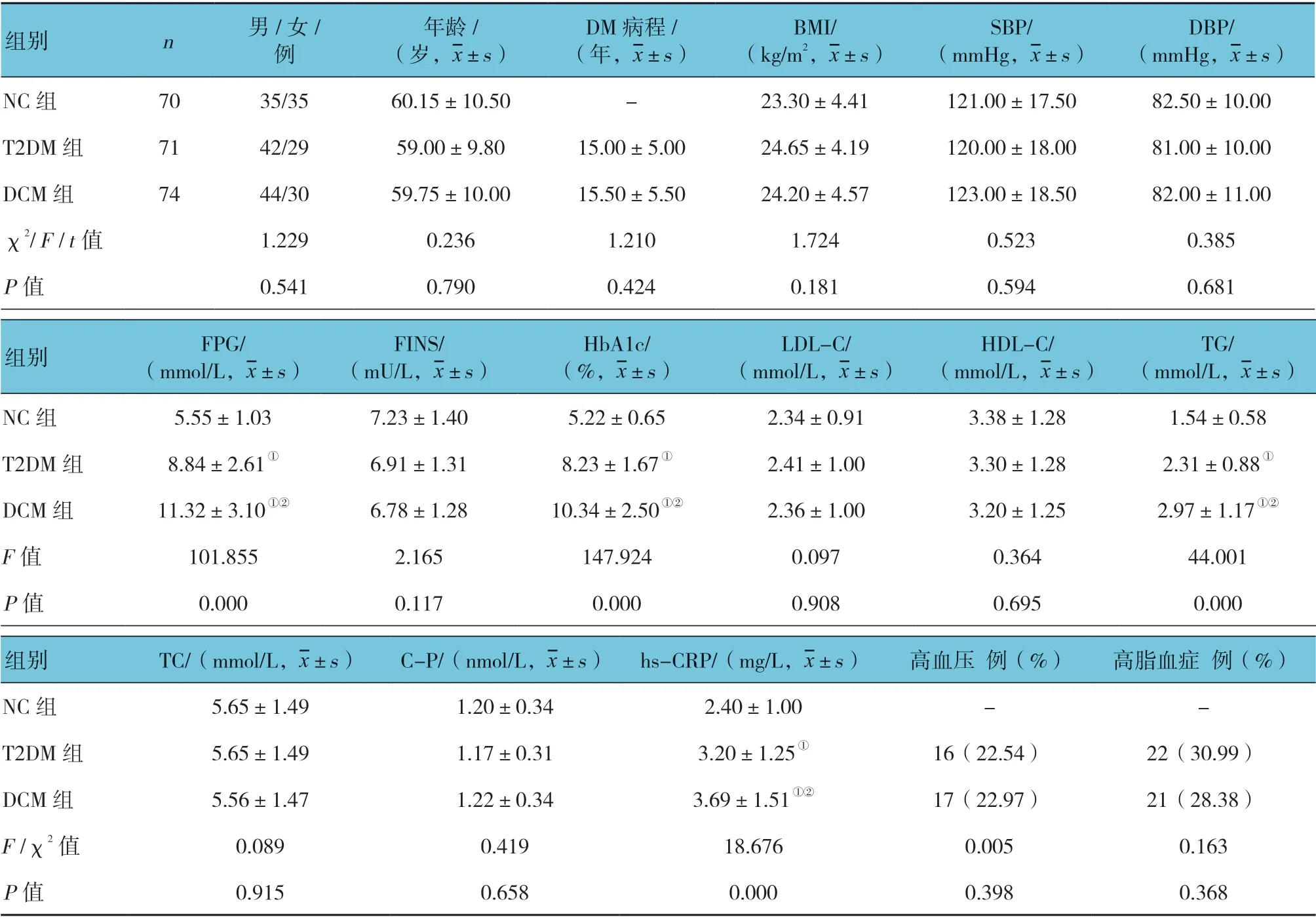
表1 各组一般资料比较
表2 各组PPARs 水平的比较 (ng/L,±s)
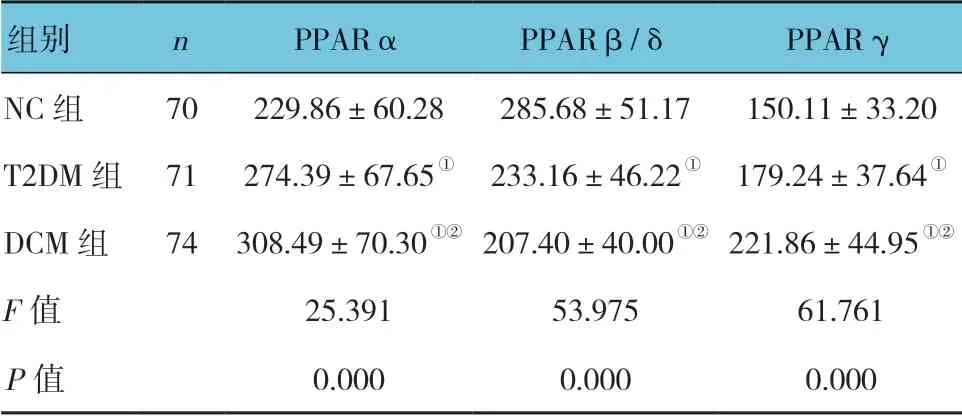
表2 各组PPARs 水平的比较 (ng/L,±s)
注:①与NC 组比较,P <0.05;②与T2DM 组比较,P <0.05。
组别 n PPARα PPARβ/δ PPARγ NC 组 70 229.86±60.28 285.68±51.17 150.11±33.20 T2DM 组 71 274.39±67.65① 233.16±46.22① 179.24±37.64①DCM 组 74 308.49±70.30①② 207.40±40.00①② 221.86±44.95①②F 值 25.391 53.975 61.761 P 值 0.000 0.000 0.000
3 讨论
本研究发现,DCM 组患者FPG、HbA1c、TG 及hs-CRP 高于T2DM 组和NC 组。T2DM 患者心脏中的糖基化终产物主要堆积于动脉中,其通过改变细胞外基质,参与动脉硬化、心肌细胞和内皮细胞功能障碍及动脉粥样硬化斑块形成[5],该情况在合并心血管疾病的T2DM 患者中尤为明显。脂代谢异常是DCM 患者心肌结构和功能改变的重要危险因素,冯然等[6]亦发现,TG 水平升高会增加DCM 发生的危险性。作为急性反应时相蛋白,hs-CRP 水平可作为心衰的预警信号之一,对心血管疾病的发生、发展具有促进作用。
PPARα 是由配体激活的核转录因子受体,属于核受体超家族成员之一,主要表达于心脏、肝脏及骨骼肌等,负责调控脂质氧化代谢,广泛参与多种生物活动。本研究发现,DCM 组PPARα 高于T2DM 组和NC 组,提示在DCM 患者中PPARα 水平升高。维持心功能正常的重要因素是能量代谢的稳态,单一的PPARα 降低和过表达,脂肪酸氧化增加或减少均会打破心脏的代谢稳态,产生不良影响。动物实验[7]发现,心肌组织PPARα 过表达后会导致脂肪酸代谢基因的转录增加,而敲除后其表达增加,同时PPARα 特异性氧化基因下调。由此可见,PPARα 可以调节心脏能量代谢底物由脂肪酸向葡萄糖的转变,进而参与DCM 的发生、发展。另外,心脏组织特异性PPARα 过表达会导致心肌发生脂质过氧化,心脏脂肪酸转运加强,过多的脂质产生脂毒性加重恶化心肌重构,导致类似DCM病变。
PPARβ/δ 广泛分布于心脏、血管、脂肪等组织,参与炎症、氧化应激、胰岛素抵抗等过程。既往研究[8]发现,PPARβ 血管特异性过表达诱导心肌血管快速生成,可发挥急性舒张血管的作用。本研究发现,DCM组PPARβ/δ 低于T2DM 组和NC 组,提示DCM 患者PPARβ/δ 水平降低。笔者考虑PPARβ/δ 对DCM 的 影响可能与多种因素有关。心肌细胞的损伤和凋亡是导致DCM 的根本原因,ZHANG 等[9]研究发现,PPARβ 表达升高可以抑制心肌细胞凋亡、心肌纤维化及心肌肥厚。实验研究[10]证明,PPARβ 可能是通过抑制炎症因子表达,降低氧化应激水平,抑制基质金属蛋白酶表达,进而实现防止心肌细胞的损伤及凋亡的目的。
本研究发现,DCM 组PPARγ 高于T2DM 组和NC组,且T2DM 组高于NC 组,提示DCM 患者和单纯糖尿病患者PPARγ 水平升高。从仅有的研究[11]发现,PPARγ 能够发挥良好的代谢保护作用,通过抑制NFκB、AP-1、蛋白激酶C 信号通路和氧化应激反应抑制促炎症细胞因子和趋化因子的表达,从而降低内皮细胞的活性和炎症反应。心肌线粒体损伤是DCM 的病例特点之一,也是可能的发病机制之一。线粒体是活性氧簇产生的重要场所,线粒体损伤会加重氧化应激反应。王兆君等[12]以临床常用的PPARγ 激动剂吡格列酮实验发现,应用吡格列酮后,高糖介导的血管内皮细胞的氧化应激受到拮抗作用,活性氧簇荧光强度低于未应用吡格列酮细胞,提示PPARγ 对高糖介导血管内皮细胞活性氧簇产生了抑制作用。鉴于此,笔者考虑PPARγ 水平升高可能是机体的一种保护机制,使其易于被内源性配体活化,但具体过程仍有待进一步研究。
综上所述,DCM 患者PPARα 和PPARγ 水平升高,PPARβ/δ 水平降低,PPARs 可能在DCM 的发生发展中起到重要作用,但目前生理机制仍不完善,需进一步研究加以证实。

