siRNA沉默肿瘤坏死因子α诱导蛋白2表达对胶质瘤细胞侵袭及增殖的影响*
程哲,巢青,王大巍,束汉生
(蚌埠医学院第二附属医院 神经外科,安徽 蚌埠 233000)
神经胶质瘤是中枢神经系统最常见的恶性肿瘤,具有高病死率、致残率和复发率,其总体生存率和预后极差[1-2]。肿瘤坏死因子α 诱导蛋白2(tumor necrosis factor alpha induced protein 2, TNFAIP2) 广泛调控各项肿瘤的发生、发展。研究发现TNFAIP2 rs8126 单核酸多态性基因变异成为人类食管鳞状细胞癌易感因素[3];TNFAIP2 可以直接靶向调节KLF5从而促进乳腺癌细胞增殖、迁移和侵袭[4];鼻咽癌中TNFAIP2 是一种促进细胞迁移的蛋白质,其表达可作为远处转移的生物标志物[5]。TNFAIP2 在肿瘤细胞增殖、迁移和侵袭等方面发挥重要作用,可能成为肿瘤诊断的生物标志物和治疗靶点。前期研究发现TNFAIP2 在胶质瘤细胞及组织标本中表达上调[6],然而其对胶质瘤细胞的生物学功能的影响未见报道,本实验采用siRNA 技术沉默胶质瘤细胞U87 和U251 中TNFAIP2 的表达,探讨TNFAIP2 对胶质瘤细胞增殖及侵袭功能的影响。
1 材料与方法
1.1 材料
人脑胶质瘤细胞株U87、U251、U373 和A172,正常人脑星形细胞株1800 购自中国科学院上海细胞库,SHG44 为苏州大学附属医院脑神经研究所惠赠。细胞培养液DMEM 和RPMI 1640 购自美国Thermo公司,胎牛血清(fetal bovine serum, FBS)购自美国Gibco 公司,TNFAIP2 及GAPDH 引物和Custom Real-Time PCR Gene Detection Assay 由上海吉玛制药技术有限公司合成,Lipofectamine 2000、Trizol 均购自美国ABI 公司,CCK-8 购自上海碧云天生物技术有限公司,Matrigel 胶购自美国BD 公司,4%多聚甲醛、DEPC 水 购自北京索莱宝公司。
1.2 实验方法
1.2.1 细胞培养 胶质瘤细胞U87、U373、U251、A172 和SHG44分别用含10% 的FBS 的DMEM 或RPMI 1640 培养基中,于37℃含5%二氧化碳CO2的培养箱 连续培养,每2~3 天换液,以0.25%胰酶+0.02%乙 二胺四乙酸消化传代培养,使细胞维持对数生长。
1.2.2 细胞转染和分组 将处于对数生长期的细胞计数4×104~5×104接种在24 孔板上,细胞汇合达到30%~50%。A 液:在50 μl 的DMEM 无血清培养基加入1.25 μl 20 μmol/L si-RNA(si-TNFAIP2)轻轻摇匀,室温放置5 min;B 液:用50 μl 无血清的DMEM 稀释1 μl Lipofectamine 2000 试 剂,摇 匀室温放置5 min;将A 液与B 液混合摇匀,室温放置20 min;将100 μl A、B 混合液加到含400 μl培养基的培养板孔中,轻轻摇匀;在37℃、5% CO2培养箱中温育4~6 h 后更换新鲜培养基,细胞继续培养24~96 h 后用于实验。实验分为空白对照组(MOCK 组)不予特殊处理、阴性对照组转染无意义序列(si-NC 组)和实验组转染干扰RNA 小分子(si-TNFAIP2 组)。TNFAIP2 小分子干扰RNA(si-TNFAIP2)由Gene Pharma 公司合成,si-TNFAIP2 正向:5'-CAUCAGAGGCAGAGUCAGA-3',反向:5'-UCU GACUCUGCCUCUGAUG-3′
1.2.3 实时荧光定量聚合酶链反应(quantitative real-time polymerase chain reaction, qRT-PCR) 检 测TNFAIP2 mRNA 在多株胶质瘤细胞中的表达及在稳转后U87 和U251 细胞中的表达 提取细胞总RNA,测定RNA 浓度。根据试剂盒中步骤:在每个反应中加入2.0 μg RNA,70℃温浴3 min,取出后冷却至室温,加0.5 μl 逆转录酶后置于37℃水浴60 min。20 μl 反应体系中含2 μl CDNA,在Roche Light Cycler 480 仪器上进行45 个循环反应,按照95℃预变性10 min,95℃变性15 s,60℃退火30 s,72℃延伸10 s。设3 个重复组,结果以2-ΔΔCt值计算。TNFAIP2 及GAPDH 的引物如 下:TNFAIP2 正向,5'-CCTGCTCTCCCTACGC-3',反向,5'-CGTCCAAGATGCTCCG-3';GAPDH 正向,5'-AACGGATTTGGTCGTATTG-3',反向,5'-GGAAGA TGGTGATGGGATT-3',以GAPDH 的mRNA 表达水平作为内参。
1.2.4 细胞划痕检测U87、U251 细胞迁移能力 取转染后对数生长期U251 和U87 细胞,用20 μl 无菌移液枪枪头垂直培养板划出贯穿培养孔的划痕作为0 h 细胞迁移状态。在培养板各孔添加正常含血清培养基常规培养24 h 后再次拍照记录。采用Image J2X软件计算划痕面积灰度值,划痕愈合率=(0 h 划痕面积-24 h 划痕面积)/0 h 划痕面积×100%。
1.2.5 Transwell 检测U87、U251细胞侵袭能力 Matrigel 胶与培养基按1:6 比例稀释以40 μl 每孔铺于Transwell 小室,37℃ 0.5 h;将转染后的U87 和U251 细胞以1×105个/孔接种于Transwell 小室上层,在含5% CO2的培养箱37℃环境下连续培养48~ 72 h 后,擦净小室上层内细胞,经苏木精固定30 min后再用1%结晶紫染色1 min,显微镜下随机选取6 个视野拍照,采用Image J 2X 软件对小室下层细胞计数取均值。
1.2.6 CCK-8 实验检测U87、U251 细胞增殖能力 将稳定转染的U87 及U251 细胞(2×103个/孔)分别接种于96 孔板中,在转染后的24、48 及72h 后再向每孔加入10μl CCK-8 试剂,在5% CO2、37℃培养箱下培养4 h,在450nm 波长处测量吸光度值。
1.3 统计学方法
数据分析采用SPSS 17.0 及GraphPad Prism 4.0 统计软件,计量资料用均数±标准差(±s)表示,采用单因素方差分析或重复测量设计的方差分析,进一步两两比较采用LSD-t检验,P<0.05 为差异有统计学意义。
2 结果
2.1 TNFAIP2 mRNA 在胶质瘤细胞中高表达
不同细胞中TNFAIP2 mRNA 相对表达水平:正常人脑星型细胞1800(1.86±0.25)、U87(5.76±0.47)、U251(4.98±0.34)、U373(6.35±0.52)、A172(5.81± 0.46)、SHG44(5.53±0.32),经单因素方差分析,差异有统计学意义(F=47.072,P=0.000);进一步两两比较,经LSD-t检验,U87、U251、A172、U373 和SHG44 细胞中TNFAIP2 mRNA 的表达高于正常人脑星形细胞1800(P<0.05)。见图1。
2.2 siRNA 沉默U87、U251细胞中TNFAIP2 mRNA 的表达
U87细胞转染后各组TNFAIP2 mRNA 的表达:si-TNFAIP2 组(0.51±0.06)、si-NC 组(6.20±0.40)、MOCK 组(6.05±0.43),经单因素方差分析,差异有统计学意义(F=91.054,P=0.000);进一步两两比较,经LSD-t检验,si-TNFAIP2 组TNFAIP2 mRNA 表达低于si-NC 组、MOCK 组(P<0.05)。见图2。U251 细胞转染后TNFAIP2 mRNA 的表达,si-TNFAIP2 组(0.45±0.07)、si-NC 组(5.13±0.31)、MOCK 组(5.46±0.26),经单因素方差分析,差异有统计学意义(F=142.408,P=0.000)。进一步两两比较,经LSD-t检验,si-TNFAIP2 组TNFAIP2 mRNA 表达低于si-NC 组和MOCK 组(P<0.05)。见图2。
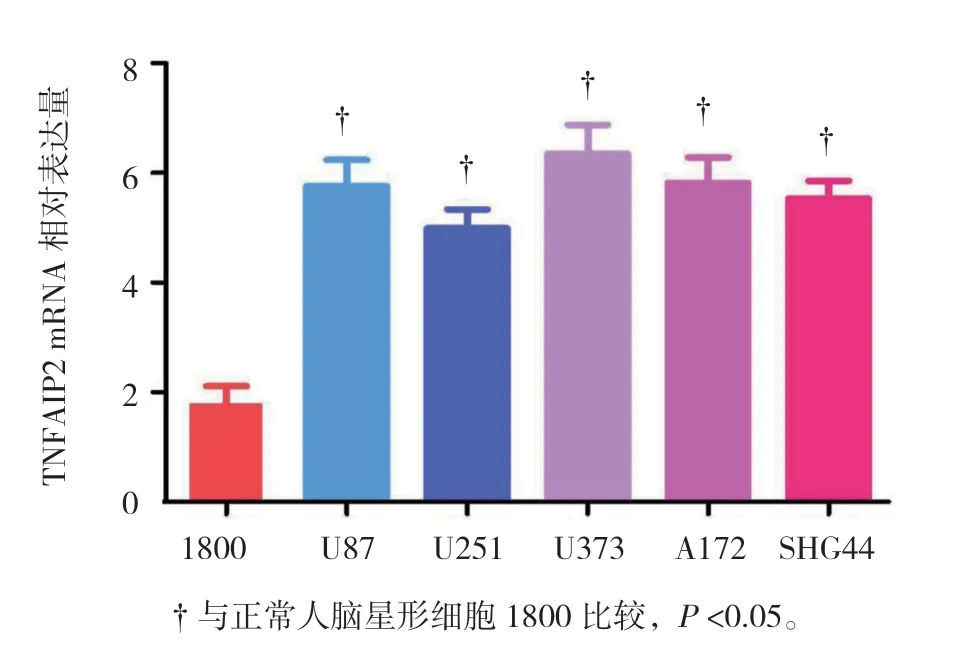
图1 TNFAIP2 mRNA 表达的比较 (±s)
2.3 沉默TNFAIP2 表达抑制U87、U251 细胞迁移
U87 细胞迁移率:si-TNFAIP2 组(19.70±0.95)%、MOCK 组(50.16±2.54)%、si-NC 组(45.01±2.32)%,经单因素方差分析,差异有统计学意义(F=62.661,P=0.000);进一步行LSD-t检验发现si-TNFAIP2 组抑制U87 细胞的迁移能力比MOCK 组、si-NC 组更强(P<0.05)。U251 细胞迁移率:si-TNFAIP2 组(17.68± 1.75)%、MOCK 组(44.56±2.12)%、si-NC 组(50.26± 3.16)%,经单因素方差分析,差异有统计学意义(F=51.631,P=0.000);进一步行LSD-t检验,si-TNFAIP2 组抑制U251 细胞迁移能力比MOCK 组、si-NC 组更强 (P<0.05)。沉默TNFAIP2 表达抑制U87、U251 细胞迁移见图3、4。
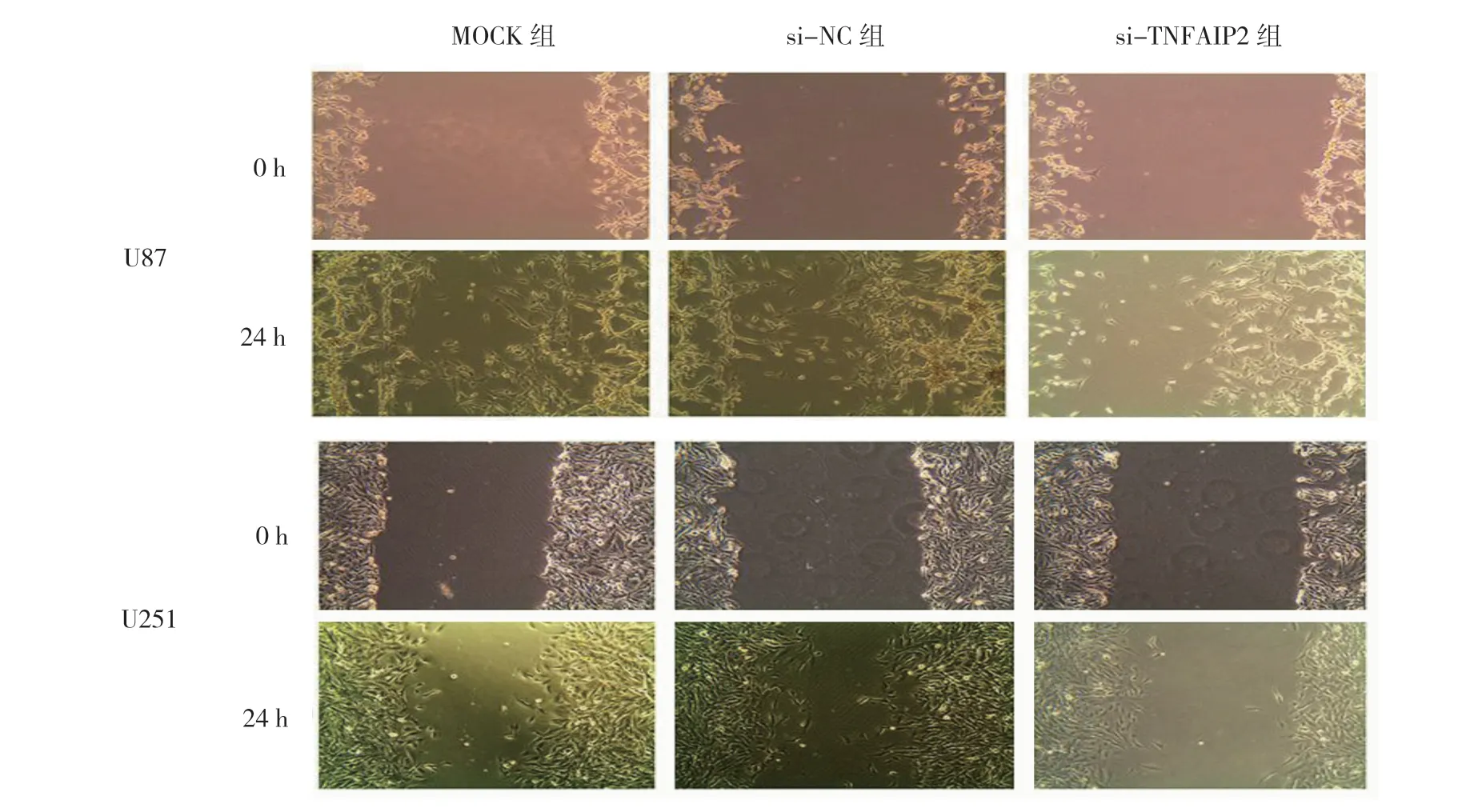
图3 沉默TNFAIP2 表达后U87、U251 细胞迁移能力比较 (×200)
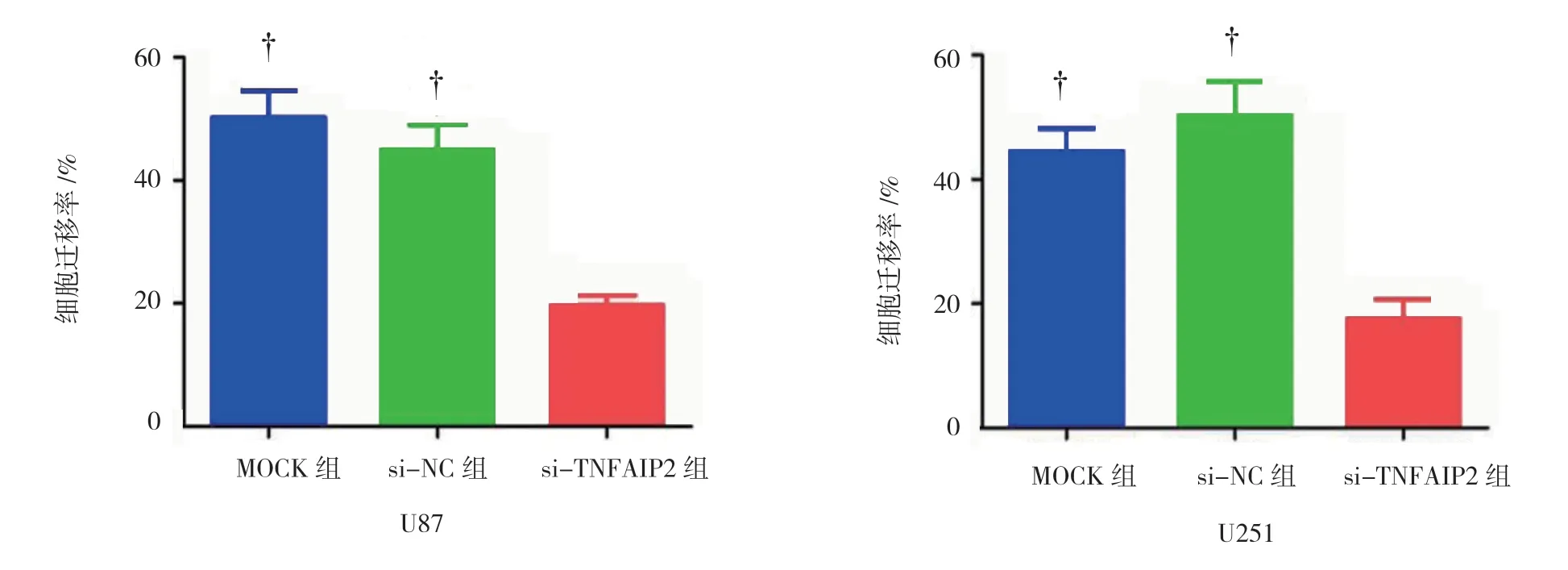
图4 U87、U251 细胞迁移率的比较 (±s)
2.4 沉默TNFAIP2 表达抑制U87、U251 细胞侵袭
U87 细胞穿膜细胞数:si-TNFAIP2 组(45.33± 8.14)、si-NC 组(114.33±8.14)、MOCK 组(102.00± 11.36),经单因素方差分析,差异有统计学意义(F=55.225,P=0.000);进一步行LSD-t检验,si-TNFAIP2 组抑制U87 细胞的侵袭能力比MOCK 组、si-NC 组更强(P<0.05);U251 细胞穿膜细胞数:si-TNFAIP 组(52.33±4.16)、si-NC 组(122.33±5.86)、MOCK 组(113.67±14.57),经单因素方差分析,差异有统计学意义(F=49.641,P=0.000);进一步行LSD-t检验,si-TNFAIP2 组抑制U251 细胞侵袭能力比MOCK 组、si-NC 组更强(P<0.05)。见图5、6。
2.5 沉默TNFAIP2 表达抑制U87、U251 细胞增殖
3 组U87 及U251 细胞24、48 和72 h 的吸光度值比较,采用重复测量设计的方差分析,结果:U87 细胞各时间点的吸光度值有差异(F=532.949,P=0.000),3 组间U87 细胞的吸光度值有差异(F=69.652,P=0.000),3 组间U87 细胞吸光度值的变化趋势有差异(F=69.890,P=0.000);U251 细胞各时间点的吸光度值有差异(F=413.597,P=0.000),3 组间U251 细胞的吸光度值有差异(F=793.612,P=0.000),3 组间U251 细胞吸光度值的变化趋势有差异(F=55.243,P=0.000)。在24h 后si-TNFAIP2 组的吸光度值低于其他两组。与MOCK 组及si-NC 组比较,沉默TNFAIP2 表达可抑制U87 和U251 细胞的增殖。见图7和表1。
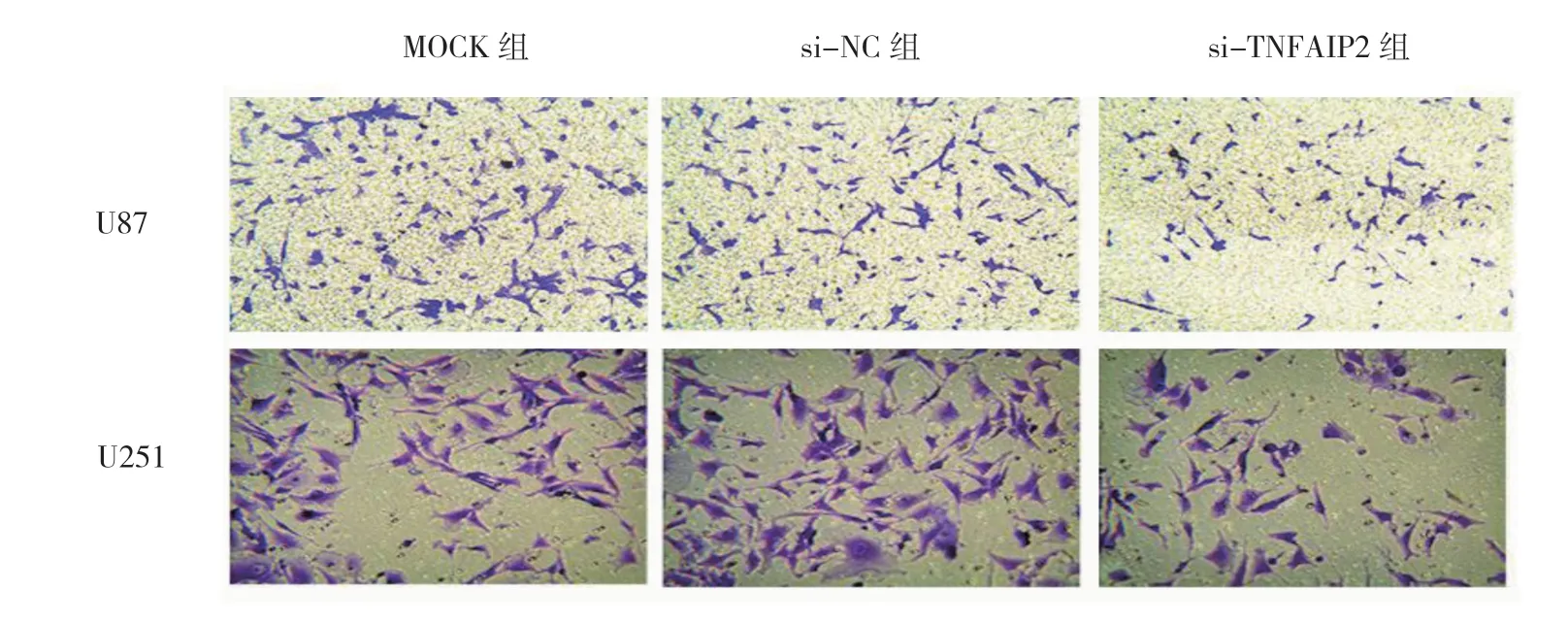
图5 沉默TNFAIP2 表达后U87、U251 细胞侵袭能力比较 (×400)
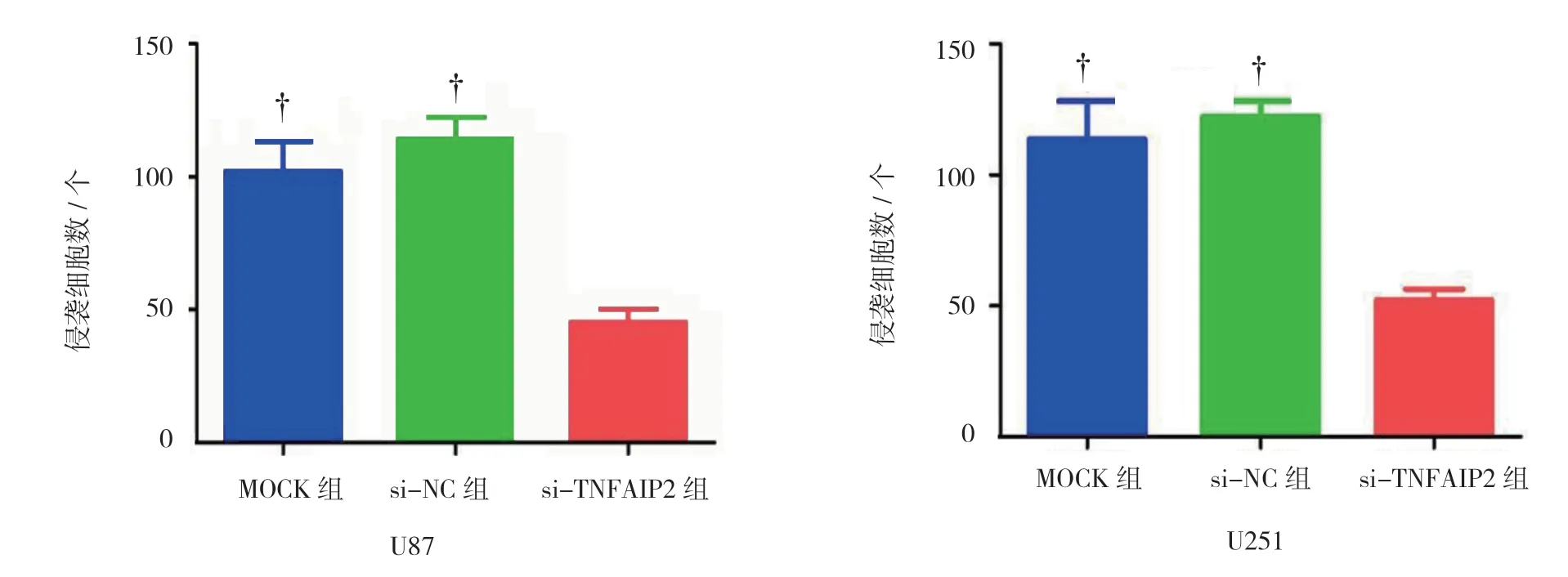
图6 U87、U251 细胞侵袭能力的比较 (±s)
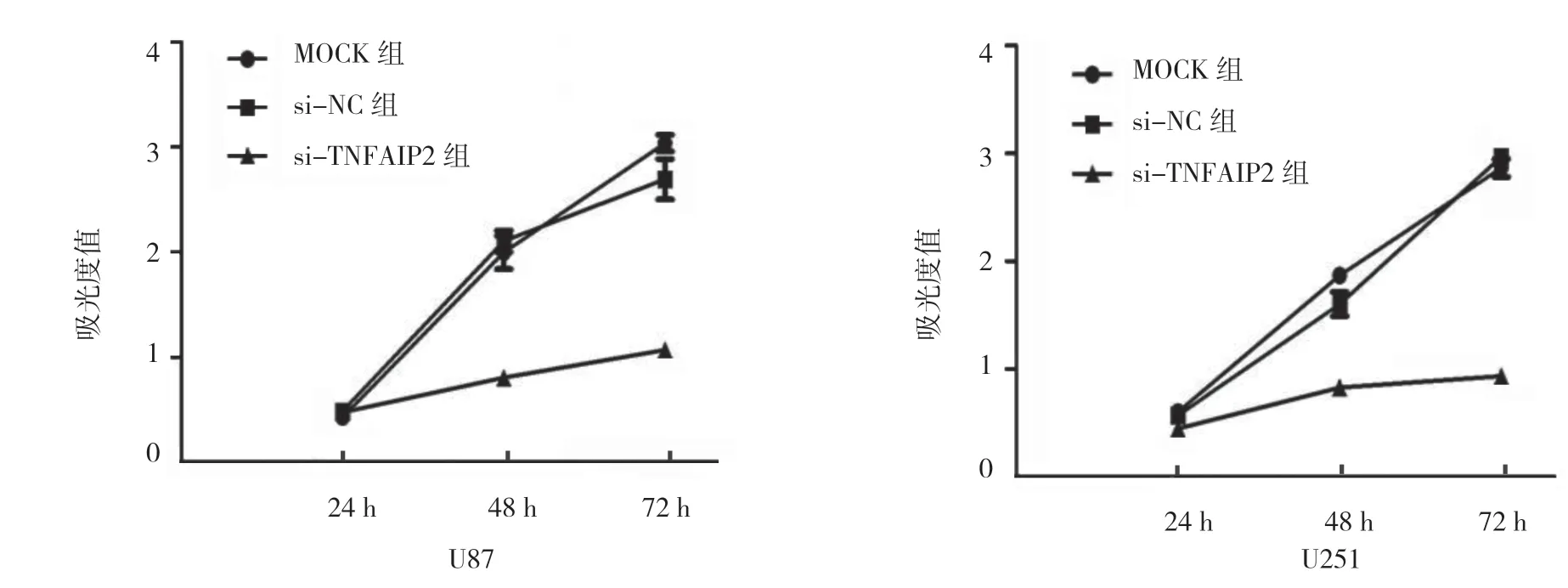
图7 沉默TNFAIP2 表达对U87、U251 细胞吸光度值变化趋势
表1 各组U87 和U251 细胞在450 nm 波长处的吸光度值比较 (±s)
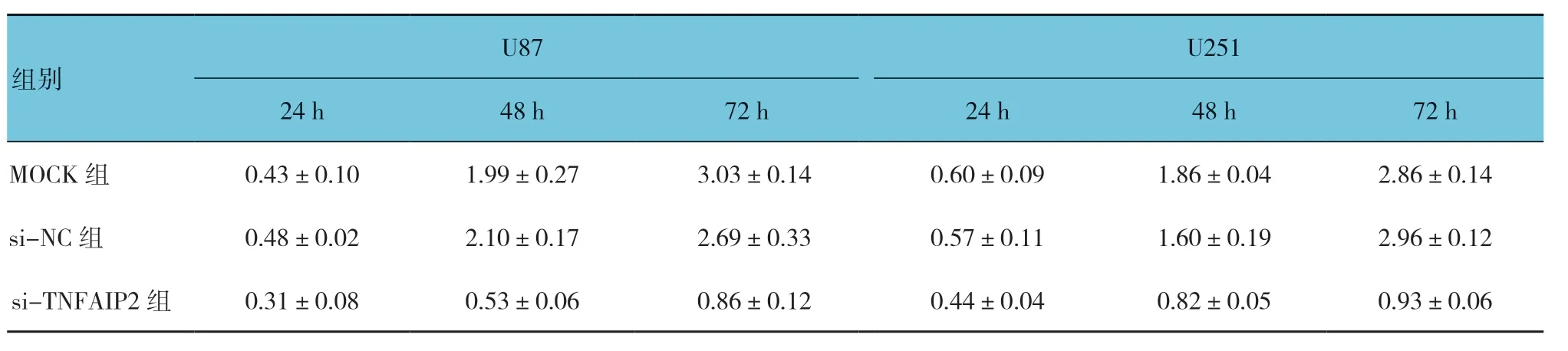
表1 各组U87 和U251 细胞在450 nm 波长处的吸光度值比较 (±s)
组别U87 U251 24 h 48 h 72 h 24 h 48 h 72 h MOCK 组 0.43±0.10 1.99±0.27 3.03±0.14 0.60±0.09 1.86±0.04 2.86±0.14 si-NC 组 0.48±0.02 2.10±0.17 2.69±0.33 0.57±0.11 1.60±0.19 2.96±0.12 si-TNFAIP2 组 0.31±0.08 0.53±0.06 0.86±0.12 0.44±0.04 0.82±0.05 0.93±0.06
3 讨论
胶质瘤细胞较强的增殖及侵袭特性是导致全切率低、术后复发及预后差的主要原因[7-9],胶质瘤的侵袭性与术后复发密切相关[10-11]。目前胶质瘤的治疗主要依赖手术最大范围的切除,术后辅助放疗、化疗及免疫治疗。肿瘤的精准治疗是最近比较热门的话题,脑胶质瘤的单克隆抗体治疗也逐步应用于临床[12],然而寻找调控胶质瘤细胞增殖及侵袭功能相关的基因越来越成为研究的热点,胶质瘤靶基因的研究也为精准治疗提供了基础和依据。
大量研究表明,TNFAIP2 参与调控食管鳞状细胞癌[3]、乳腺癌[4]、胃癌[13]及霍奇金淋巴瘤[14],与癌 症的发生、发展密切相关。食管鳞状细胞癌中TNFAIP2 高表达,下调TNFAIP2 表达后可以通过激活Wnt/β-catenin 信号通路抑制癌细胞的侵袭迁移[15]; TNFAIP2 在乳腺癌标本中高表达,且其表达量与乳腺癌的浸润生长及淋巴转移呈正相关[16];鼻咽癌中NF-κB 可以上调TNFAIP2 蛋白的表达,进而促进癌细胞的迁移[17]。由此推断TNFAIP2 参与调控肿瘤细胞的侵袭迁移。目前,TNFAIP2 在胶质瘤中的表达及调控研究无相关的报道,有实验团队前期工作发现TNFAIP2 在胶质细胞及组织中高表达,是miR-184 在胶质瘤中的直接靶基因[6],然而TNFAIP2 对胶质瘤细胞体外功能的影响不是很明确。
本研究显示,TNFAIP2 mRNA 在多株胶质瘤细胞中处于表达上调状态。而沉默TNFAIP2 可抑制脑胶质瘤细胞的迁移和侵袭;沉默TNFAIP2 表达后可以抑制U87 和U251 胶质瘤细胞的增殖。本研究结果证明下调TNFAIP2 的表达可抑制胶质瘤细胞的迁移、侵袭和增殖。据此笔者推测TNFAIP2 在胶质瘤中可能起到癌基因作用。虽然发现抑制TNFAIP2 的表达可以抑制胶质瘤细胞的侵袭和增殖,但是其具体机制尚不明确,由于实验限制没有对侵袭及增殖、凋亡相关基因如MMP-2、Caspase 及BCL-2 等进行检测。胶质瘤的发生发展涉及到多个靶基因及多个信号通路的异常调控,仅依靠单一的靶基因难以有效达到抑制胶质瘤进展[18-20]。仍需要高通量的基因测序和生物信息学等手段寻找TNFAIP2 可能的信号通路。
综上所述,沉默TNFAIP2 表达可以抑制胶质瘤细胞的迁移、侵袭与增殖能力。TNFAIP2 有可能成为脑胶质瘤治疗的分子靶标,同时还需要进一步的论证及机制研究。

