MicroRNA标志物在早期诊断室间隔缺损中的价值*
纪龙,王小卉,刘雪贞,刘华民,张倩倩,杨伟丽,韩东洋,李栋
[山东第一医科大学(山东省医学科学院),山东 泰安 271000]
先天性心血管病(congenital heart diseases, CHDs)是人类发病率最高的出生缺陷,研究表明活产儿先天性心血管病平均发病率为9.1‰,其中亚洲国家最高,为9.3‰[1]。中国出生缺陷监测数据显示,2000~2011年CHDs 是我国高发的畸形之一,并呈逐年上升趋势。如何提高CHDs 的早期诊断准确率,已成为临床诊断和防治的重点和难点问题。目前包括CHDs 在内的出生缺陷的早期诊断,临床上主要依靠妊娠期的影像学检查,该诊断方法特异性较差。正是由于缺乏针对CHDs 特异性较高并且较为简易的早期检测手段,CHDs 患儿较难被早期发现,因此,需寻找一种新的高敏感性和高特异性的分子标志物,用于CHDs 的早期诊断和病情监测,进而指导疾病预防,这对降低CHDs 的发病风险具有重要意义。
MicroRNA(miRNA)是一类长约22 个核苷酸的非编码小分子RNA。CHEN 等[2]发现人类血浆中存在大量miRNA,并进一歩证明在RNA 酶、酸碱性、高低温度等条件改变和长时间的储存均不会对血浆中miRNA 的含量造成影响,并且易于在外周血中检测,可以便利地运用于临床疾病的诊断,具有临床诊断标志物的重要特质。目前血浆miRNA 作为多种疾病尤其是肿瘤分子诊断标志物的研究已经广泛开展[3-4]。虽然miRNA 在CHDs 发病过程中的作用尚不十分明确,但近年来已有研究提示miRNA 与心脏的形成、发育有关,可能在CHDs 的发生、发展中起重要作用[5]。有关CHDs 患者外周血miRNA 的研究甚少,最近的一项关于室间隔缺损(ventricular septal defect, VSD)合并重度肺动脉高压的小样本研究发现,通过检测对比VSD 合并PAH 患者血浆的86 种miRNA,得出miR-98、miR-19a-3p、let-7f-5p、miR-198 等的表达水平升高,而miR-4312、miR-3943、miR-4284 的表达水平降低[6]。然而miRNA 在CHDs 发生、发展过程中究竟扮演何种角色,究竟有多少miRNA 在发病过程中发生改变,目前仍不清楚。
因此,本研究首先通过miRNA 表达谱芯片技术对VSD 中特定表达的miRNA 进行筛选、鉴定和验证,寻找VSD 分子诊断标志物,为进一步探讨miRNA的异常表达与CHDs 的关系提供依据,进而评估血浆miRNA 作为新的分子标志物用于临床VSD 筛查诊断的价值和应用前景,建立VSD 早期临床诊断模型,对现有CHDs 早期诊断方法进行有效补充,进一步提高CHDs 的诊断效率,改善患者预后,减轻疾病负担。
1 资料与方法
1.1 研究对象
选取2012年6月—2015年11月分别在济南市儿童医院、泰安市妇幼保健院心血管外科就诊和治疗的4 个月~6 岁单纯性VSD 患者作为VSD 组(85 例);选取同期于上述医院体检中心健康体检儿童作为对照组(80 例),无CHD 家族遗传史并且与VSD 组来自相同地区。
本研究选取的对象通过3 个阶段的对照性实验筛选、鉴定血浆有差异的miRNA,并建立VSD 血浆miRNA 早期诊断模型。初始筛选阶段,按照1:1匹配收集VSD 组和对照组研究对象各3 例,采用miR CURYTMLNA Array(v.18.0)(Exiqon, Vedbaek, Denmark)全基因组表达谱芯片技术进行差异miRNA表达谱检测,初步筛查VSD 血浆差异miRNA;验证阶段扩大样本量,选取表达量差异(上调或下调)1.5 倍以上的8 种 重要的miRNA,在20 例VSD 组和15 例对照组血浆中采用实时荧光定量聚合酶链反应(qRT-PCR)进行检测,验证芯片的检测结果;在VSD 诊断模型的建立阶段,选取新的独立组(62 例VSD 组VS 62 例对照组)样本再次对上述已验证的差异血清miRNA 进行qRT-PCR 检测,分析其表达水平与VSD 的相关性,建立VSD 早期诊断模型,进一步探讨血浆miRNA 在VSD 临床诊断中的价值。
本研究经相关医院医学伦理委员会批准,所有研究对象由监护人签署知情同意书,血液标本仅用于本研究实验。
1.2 血浆标本采集和保存
采集病例组和对照组研究对象空腹静脉血标本4 ml,2 ml 全血静置10 min,4 000 r/min 离心10 min,上层透明淡黄色液体即为血浆,收集后分装入无RNase 的EP 管中,置入-80℃冰箱冷冻备用。另外2 ml 用乙二胺四乙酸(EDTA)抗凝,于-20℃冰箱冷冻保存,用于基因组DNA 提取。
1.3 血浆RNA 提取
应用Trizol and miRNeasy mini kit(美国Qiagen 公司)试剂盒提取血浆总RNA,具体操作参见试剂盒说明书。琼脂糖凝胶电泳法检测RNA 质量,紫外分光光度计测定总RNA 在260 nm 和280 nm 处的光密度(OD)值(A260/A280)衡量RNA 的纯度,OD 值在1.8~ 2.1,认为质量合格。
1.4 血浆miRNA 芯片检测
将提取的血浆总RNA 送上海康程生物技术服务公司进行miRNA 芯片检测。
1.5 qRT-PCR 检测miRNA
Rever Tra Ace qPCR-RT Kit 逆转录试剂盒和miscrip SYBR Green PCR Kit 定量试剂盒购自上海Toyobo 公司。U6 内参引物,let-7e-5p、miR-155-5p、miR-222-3p、miR-379-5p、miR-409-3p、miR-433、miR-487b 和miR-498 引物购自上海Gene Pharma 公司。10 μl 逆转录反应体系包括Nuclease free water 2 μl,5×RT Buffer 2 μl,miRNA & U6 RT Primer mix 0.5 μl,RT Enzyme Mix 0.5 μl,总RNA 5 μl。反应进行条件:25℃ 30 min,42 ℃ 30 min,85 ℃ 5 min,4 ℃保存。qRT-PCR 采 用20 μl 体系,包括SYBR 10 μl,miRNA/U6 specific Primer set 1 μl,灭菌水7 μl,cDNA 2 μl。qRT-PCR 反应条件:95℃预变性3 min,1 个循环;95℃变性12 s,40 个循环;62℃退火40 s,荧光信号采集。miRNA 的表达水平采用2-△△Ct值表示,△△Ct=VSD 组(Ct 样本-Ct 对照)-对照组(Ct 样本-Ct 对照)。
1.6 统计学方法
数据分析采用SPSS 24.0 统计软件,计量资料以均数±标准差(±s)表示,比较采用t检验,计数资料以例(%)表示,比较采用χ2检验和Fisher精确概率法,P<0.05 为差异有统计学意义。对单个miRNA 和多指标联合诊断模型进行诊断价值评价,首先建立ROC 曲线,通过曲线下面积(AUC)、敏感性、特异性、约登指数、阳性预测值等来判断诊断VSD的效果;利用逐步Logistic 回归模型建立多指标的诊断模型,用以区分CHDs 患者和对照人群。
2 结果
2.1 研究对象一般特征
上述3 阶段研究对象,在年龄、性别等方面均具有可比性,所选研究对象均为汉族,具体临床资料见表1~3。
2.2 血浆miRNA 表达谱芯片检测结果
利用miRNA 芯片技术检测3 例VSD 组和3 例对照组血浆中的miRNA 表达特征,初步确定VSD 差异miRNA 表达谱。微阵列芯片杂交结果显示:与对照组比较,有36 个表达有差异的miRNA(差异倍数>1.5 或差异倍数<0.67,P<0.05),其中21 个miRNA 在VSD 组表达下调,表达上调的miRNA 有15 个。见表4。
表1 初筛阶段VSD 组与对照组临床资料比较 (n =3)
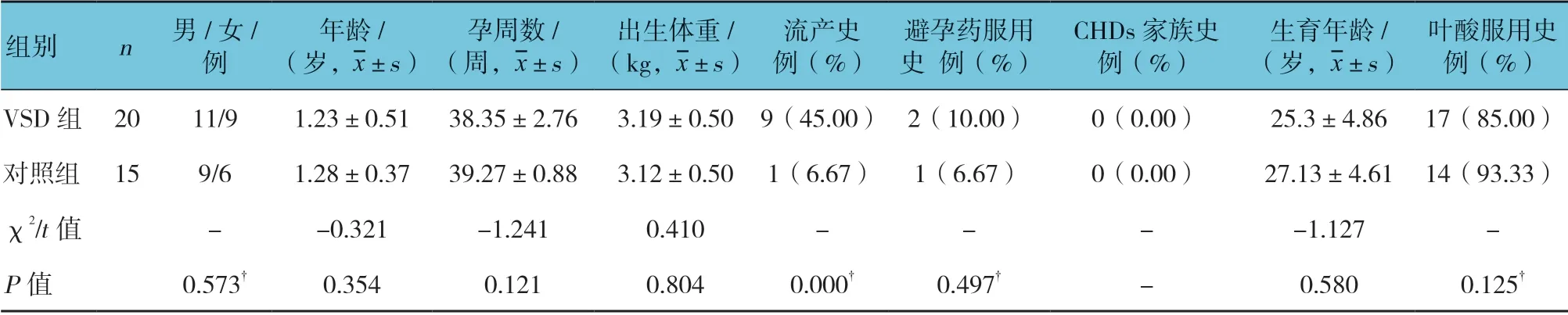
表2 qRT-PCR 验证阶段VSD 组与对照组临床资料比较
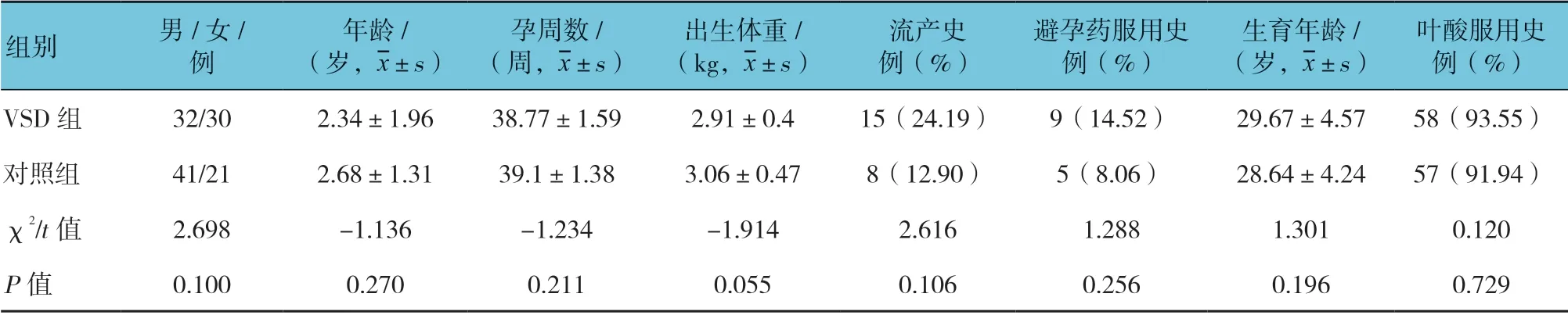
表3 诊断价值评价阶段VSD 组与对照组临床资料 (n=62)
2.3 差异表达的miRNA 的检测结果
通过查阅文献,结合微阵列芯片表达情况,选择8 个差异表达的let-7e-5p、miR-155-5p、miR-222-3p、miR-379-5p、miR-409-3p、miR-433-3p、miR-487b-5p 和miR-498 运 用qRT-PCR技术进行随后的两阶段大样本qRT-PCR 验证,检测到5 种血浆miRNA(let-7e-5p、miR-155-5p、miR-222-3p、miR-433-3p 和miR-487b-5p)在VSD 中的表达差异有统计学意义(P<0.05),可以选择作为具有VSD 早期诊断意义的生物标志物。见表5。
2.4 单个VSD 血浆miRNA 的诊断价值
采用ROC 曲线分析5 种血浆miRNA 对VSD 的诊断价值,5 种血浆miRNA(let-7e-5p、miR-155-5p、miR-222-3p、miR-433-3p 和miR-487b-5p)的ROC曲线下面积(AUC)分别为0.767(95% CI:0.683,0.838,P=0.000)、0.709(95% CI:0.620,0.787,P=0.000)、0.832(95% CI:0.754,0.893,P=0.000)、0.678(95% CI:0.588,0.759,P=0.001)和0.698(95% CI:0.609,0.777,P=0.000);当5 种血浆miRNA 表达量(2-△△Ct)的截断值分别取1.05、0.79、0.62、1.10 和1.11 时,敏感性分别为91.9%、71.0%、74.2%、95.2%和82.3%,特异性分别为53.2%、72.6%、88.7%、33.9%和51.6%,差异有统计学意义(P<0.05)。见表6和图1。
2.5 miRNA 诊断模型的建立
利用逐步Logistic 回归分析模型,以是否患VSD为因变量,5 种miRNA 相对表达量为自变量,分析血浆miRNA 的差异表达是否与VSD 有关,结果显示let-7e-5p、miR-155-5p、miR-222-3p、miR-433-3p及miR-487b-5p 的表达量与VSD 的发生分别有独立的关联,差异有统计学意义(P<0.05)。见表6。
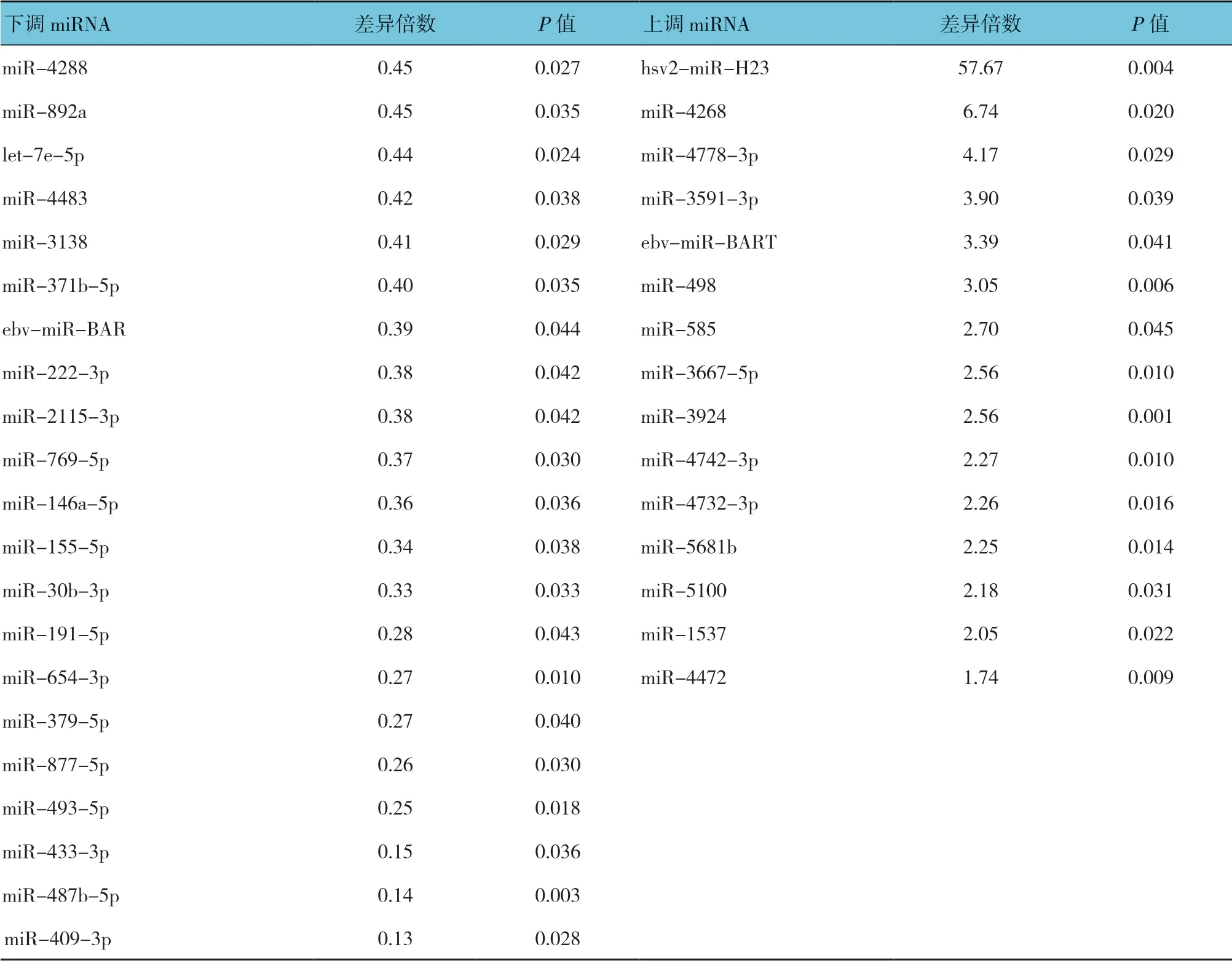
表4 VSD 患者表达有差异的miRNA
表5 8 种血浆miRNA 的相对表达量 (±s)
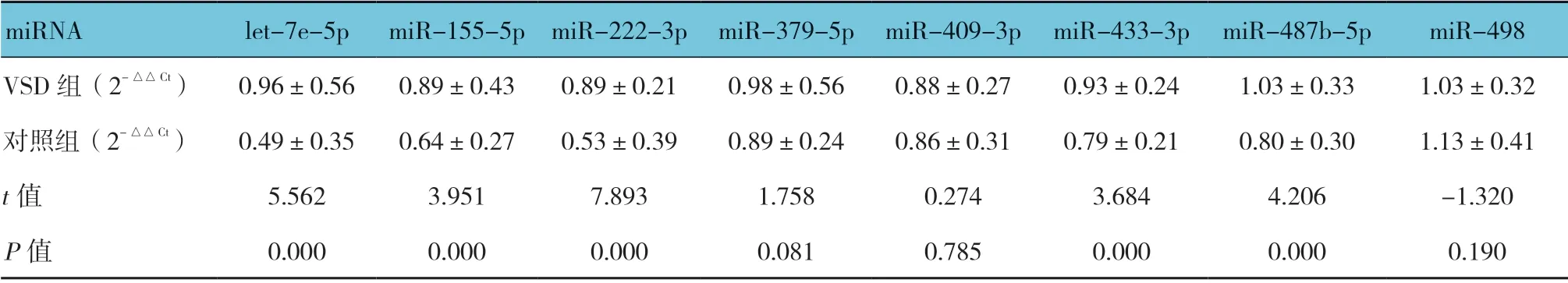
表5 8 种血浆miRNA 的相对表达量 (±s)
miRNA let-7e-5p miR-155-5p miR-222-3p miR-379-5p miR-409-3p miR-433-3p miR-487b-5p miR-498 VSD 组(2-△△Ct) 0.96±0.56 0.89±0.43 0.89±0.21 0.98±0.56 0.88±0.27 0.93±0.24 1.03±0.33 1.03±0.32对照组(2-△△Ct) 0.49±0.35 0.64±0.27 0.53±0.39 0.89±0.24 0.86±0.31 0.79±0.21 0.80±0.30 1.13±0.41 t 值 5.562 3.951 7.893 1.758 0.274 3.684 4.206 -1.320 P 值 0.000 0.000 0.000 0.081 0.785 0.000 0.000 0.190
联合5 种血浆miRNA 指标建立多指标的诊断模型:Logit(P=VSD)=17.04-[3.34×(let-7e-5p)-2.810×(miR-155-5p)-6.75×(miR-222-3p)-5.56×(miR-433-3p)3.69×(miR-487b-5p)]。诊断模型AUC为0.955(95% CI:0.902,0.984,P=0.000),当截断值为0.63 时,敏感性和特异性分别为83.87%和95.16%,约登指数为0.79,5 种miRNA 联合诊断的阳性预测值为92.86%,提示联合多个miRNA 可大幅提高VSD 的诊断效率。见表7和图2A。
本室进一步取AUC>0.7 的3 种血浆miRNA(let-7e-5p、miR-155-5p 和miR-222-3p)进行Logistic 回归分析(见表8和图2B),得出诊断模型(见表9):Logistic(P=VSD)=[7.26-2.68×(let-7e-5p)-2.16×(miR-155-5p)-5.28×(miR-222-3p)]。诊断模型
的AUC 为0.910(95% CI:0.845,0.954,P=0.000),当截断值为0.51 时,敏感性和特异性分别为82.30%和90.30%,约登指数为0.73,3 种miRNA 联合诊断的阳性预测值为89.47%。进一步分析表明:3 个miRNA 联 合(let-7e-5p、miR-155-5p 和miR-222-3p)即可接近于5 个miRNA 联合的诊断效率。
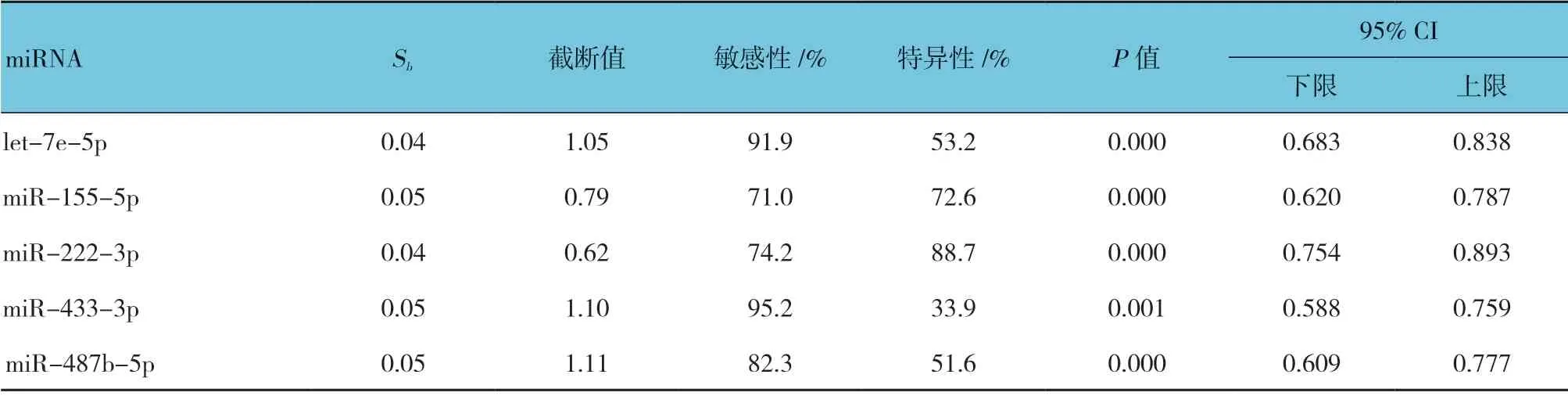
表6 5 种血浆差异表达miRNA 诊断价值评价相关指标
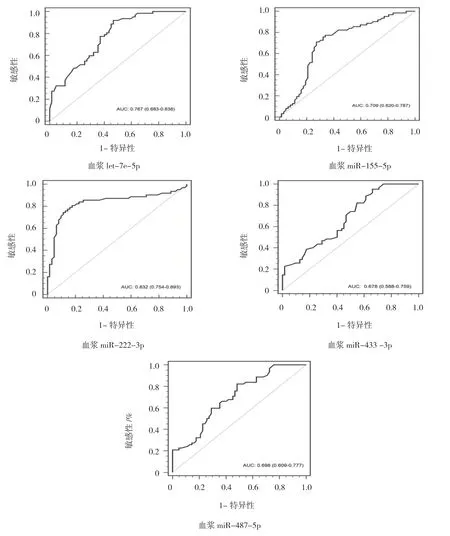
图1 5 种血浆miRNA 的ROC 曲线
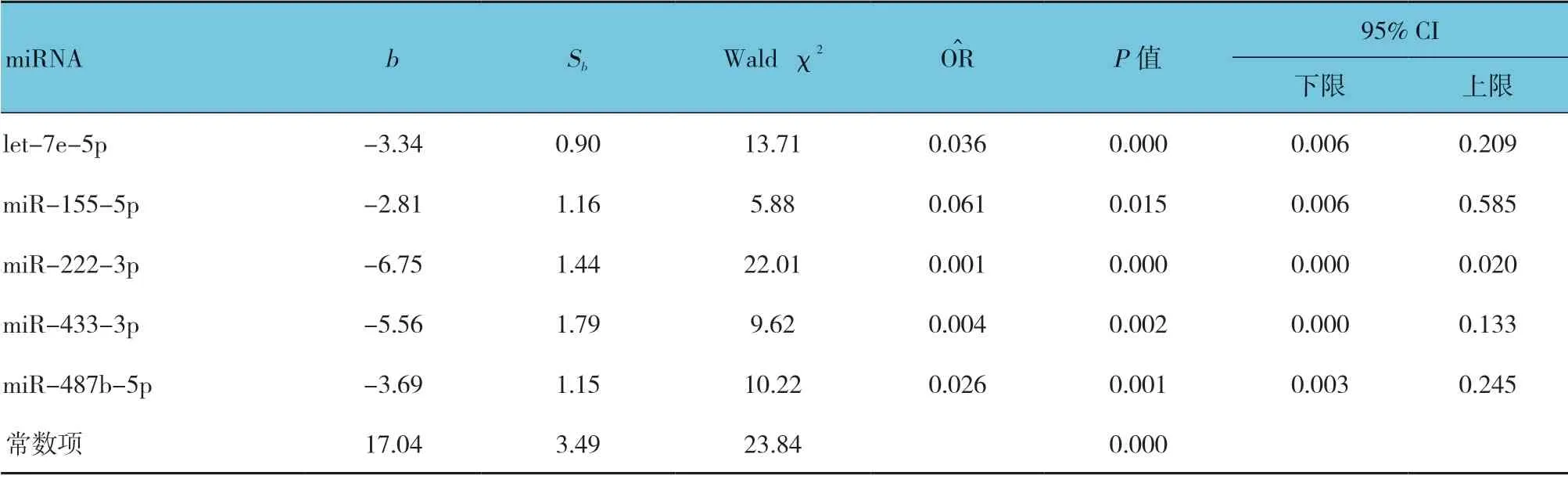
表7 5 种血浆差异表达miRNA 的Logistic 回归分析参数
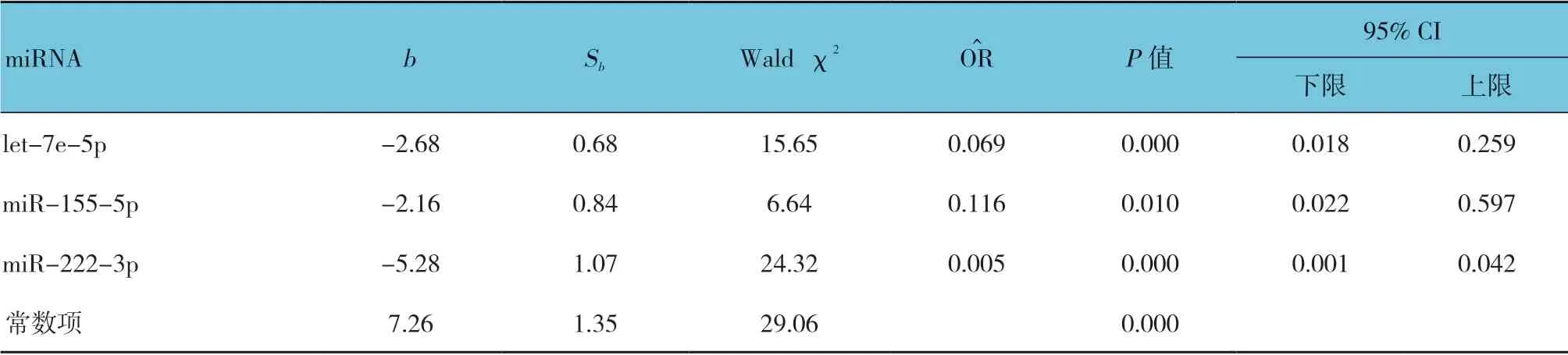
表8 3 种血浆差异表达miRNA 的Logistic 回归分析参数
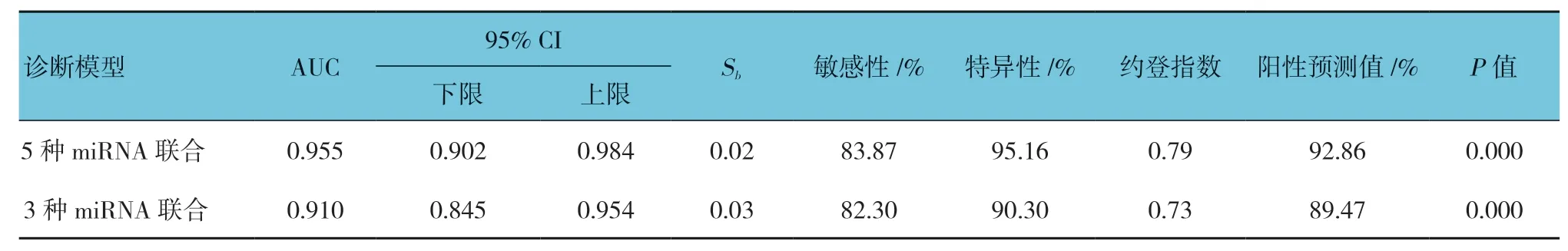
表9 血浆差异表达miRNA 联合诊断模型的价值评价表
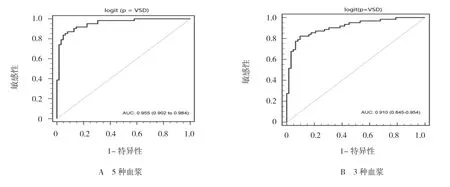
图2 5 种和3 种的血浆miRNA 联合ROC 曲线图
3 讨论
在前期研究中,通过miRNA 表达谱芯片检测技术筛选出VSD 血浆有差异表达的36 种miRNA。进一步扩大样本对重要差异miRNA 进行两阶段的qRT-PCR检测,初步筛选出5 种血浆差异表达miRNA(miRNA- let-7e、miR-155-5p、miR-222-3p、miRNA-433-3p和miR-487b-5p)作为VSD 早期诊断标志物,将其整合后可建立起多指标的联合诊断模型。
利用ROC 曲线下面积,判断上述5 个miRNA 的诊断效能。研究发现,let-7e-5p、miR-155-5p、miR-222-3p、miR-433-3p 和miR-487b-5p 的AUC 值分别为0.767、0.709、0.832、0.678 和0.698,其中miR-222-3p 的诊断效能最高,其他4 个RNA 的AUC 多集中在0.6~0.8,也具有较好的诊断效能。研究发现,5种miRNA 的敏感性和特异性分别为91.9%、53.2%;71.0%、72.6% ;74.2%、88.7% ;95.2%、33.9% ;82.3%、51.6%。有些miRNA 分子的敏感性或特异性相对较低,如let-7e-5p 和miR-487-5p 的特异性在50%左右,而miR-433-3p 的特异性仅为33.9%,即使是诊断效能最高的miR-222-3p,其敏感性及特异性也只能达到80%左右,单个miRNA 在临床上作为理想的分子诊断标志物仍有不小的差距。
鉴于此,本研究运用逐步Logistic 回归分析,利用样品的qRT-PCR 数据建立多指标的Logistic 回归分析模型,优化组合该差异miRNA,构建VSD 联合诊断模型。通过联合5 种miRNA 诊断模型分析发现,AUC 达到0.955,联合多个miRNA 可大幅度提高诊断效能。当截断值为0.63 时,5 种miRNA 联合诊断的敏感性和特异性分别为83.87%和95.16%,约登指数达到0.79,结果提示通过构建5 种miRNA 诊断模型,可以使诊断的效果更好,真实性更高。
进一步以AUC>0.7 的3 种miRNA(let-7e-5p、miR-155-5p 和miR-222-3p)构建诊断模型,该模型AUC 面积为0.910,截断值为0.51 时,敏感性和特异性分别为82.30%、90.30%,进一步提示多个miRNA组合可有效提高诊断效能。
let-7 作为一种可能的临床诊断标志物,通常作为一种抑癌物质,在肿瘤中表达下调,let-7 的正常表达是可以产生抑制癌症的作用和效果[7-8]。最新研究发现,由于let-7 在心血管系统的多种细胞中,如血管平滑肌细胞、内皮细胞、心肌细胞、冠脉平滑肌细胞等均有表达,所以let-7 在心血管系统疾病和心脏发育中的作用十分重要,有研究表明,血浆中let-7b 可能作为急性心肌缺血的生物标志物[9]。以上的研究报告提示let-7 可能在心脏的发育和心血管疾病的发生中参与了调控,但是目前未见有关let-7e-5p 与先天性心脏病的研究报道。本研究首次发现,let-7e-5p 在VSD 组血浆中呈低表达,下调到对照组的27%,ROC曲线分析let-7e-5p 的诊断效能达到0.767,敏感性为91.9%,提示let-7e-5p 在VSD 的早期诊断中具有一定的临床意义。
miR-155 在已知的miRNA 中,是与肿瘤关系最为密切的miRNA[10]。CALIN 等[11]发现miR-155 可作为一种miRNA 标志物,同慢性淋巴细胞性白血病的预后和疾病进程相关。另外,KOENIG 等[12]应用miRNA 芯片检测稳定性冠心病患者血浆的miRNA 表达谱,并进一步应用定量PCR 检测患者血浆中miRNA 的表达水平,结果显示炎症相关的miRNA-155 在内皮细胞中明显降低,这为稳定性冠状动脉粥样硬化性心脏病的临床诊断提供了潜在的生物标志物。目前尚无关于先天性心血管病与miR-155 表达的研究报道。在本研究中,首次发现miR-155-5p 在VSD 组血浆中表达下调。ROC 曲线下面积为0.709,血浆miR-155 诊断VSD 具有较高的敏感性(71.0%)和特异性(72.6%)。血浆miR-155-5p 可以作为VSD 新的无创性诊断标志物。
miR-222 与miR-221 具有高度的同源性,基因序列定位于XPII3 大约在1 kb 的区域内。miR-222 在血管生成、再构以及肿瘤转移过程中起着重要调控作用,是目前非常热门的一个miRNA 分子。miR-222与心血管系统的研究,大多集中在血管内皮细胞功能上,POLISENO 等[13]通过芯片确认27 个在人脐静脉内皮细胞高表达的miRNA,发现其中miR-222 能够抑制靶基因c-kit 的表达从而抑制内皮细胞管腔形成和迁移。虽然未见有关miR-222 与先天性心血管病的有关报道,但是本研究发现,miR-222 在VSD 组血浆中表达降低。通过进一步绘制ROC 曲线,结果显示,miR-222-3p 的曲线下面积最大,达到0.832,表明这种miRNA 对VSD 的诊断具有较高的准确性,值得进一步探讨其临床诊断价值及其与VSD 的致病机制。
另外,本研究首次报道miR-433-3p 和miR-487b- 5p 在VSD 组血浆中差异表达,这两个miRNA 均未见国内外文献报道,其在VSD 中的作用尚不清楚。miR-433-3p 和miR-487b-5p 表达下调,与对照组比较均有差异,与VSD 发病的机制不清,还有待进一步研究。为了解以上所述5 种血浆miRNA 浓度变化是否为VSD 直接导致,在接下来的研究中将选取已经手术治好的室间隔缺损患者,检测这5 种血浆miRNA 浓度,并计算ROC 曲线下面积以及敏感性和特异性,进一步验证和明确let-7e-5p、miR-155-5p、miR-222-3p、miR-433-3p 和miR-487b-5p 作为辅助诊断VSD 患者生物标志物的可行性及价值。

