抑制USP22基因对人结直肠癌细胞增殖的影响
王静,赵成诚,荣婉
(1.武汉生物工程学院 生命科学与技术学院,湖北 武汉 430415;2.武汉华联科生物技术有限公司,湖北 武汉 430212)
结肠直肠癌(colorectal cancer, CRC)是全世界常见的胃肠肿瘤类型之一。据估计,2016年有134 490 例新发CRC 病例和49 190 例CRC 相关死亡病例[1]。手术切除、放化疗仍然是目前CRC 治疗的主要方式,化疗药物能够显著抑制CRC 进展[2-3]。但化疗药物的反复使用,易使肿瘤细胞产生耐药性,致使化疗方案最终失败。为此,研究CRC 的发病机制及新的治疗靶点,对开发新型的CRC 化疗药物,提高CRC 患者的生存率有重要的理论意义。
既往研究发现并确认与肿瘤转移和治疗预后相关的11 个癌症死亡标签[4-5],泛素特异性肽酶22(ubiquitin-specifc protease 22, USP22)是其中之一。作为转录调控组蛋白乙酰化复合物SAGA 的组成部分,USP22 通过调控组蛋白的去泛素化来调节基因转录,发挥广泛的生物功能,包括细胞周期进程、胚胎发育及端粒稳态[6-7]。USP22 在人正常组织中广泛表达,但在恶性肿瘤如结直肠癌、肝癌、乳腺癌、胃癌、膀胱癌及肺癌中表达量上升,与肿瘤发生、转移有关[8-10],这些研究表明USP22 在肿瘤发生及发展中具有重要作用。然而,USP22 对结直肠癌具体调控机制不详。本研究采用特异性小干扰RNA(small interference RNA, siRNA)沉默结直肠癌细胞中USP22基因的表达,观察结直肠癌细胞的增殖、周期及凋亡的变化,同时检测相关蛋白的表达情况,以期初步阐明USP22 对结直肠癌细胞的生物学影响及可能作用机制。
1 材料与方法
1.1 材料
1.1.1 细胞及试剂 HCT-116、SW480、HT-29 购自中国科学院细胞库,结直肠癌组织芯片购自于武汉爱威尔生物科技有限公司,MTT、Annexin V-FITC/PI 试剂盒购自于北京碧云天生物技术研究所,胎牛血清(FBS)、IMDM、L15、DMEM 培养基购自美国Gibco 公司,硝酸纤维素膜、发光液购自武汉华联科生物技术有限公司,抗Cyclin B1 抗体、抗p21 抗体、抗CDK2 抗体、抗USP22 抗体、抗GAPDH 抗体、抗p53 抗体购自英国Abcam 公司,辣根过氧化酶标记山羊抗兔IgG 购自武汉博士德生物有限公司,其他常用生化试剂均为国产分析纯。
1.1.2 主要仪器 二氧化碳CO2培养箱购自美国Thermo 公司,流式细胞仪购自美国BD 公司,电泳仪、电转移购自美国Bio-Rad 公司。
1.2 方法
1.2.1 免疫荧光检测USP22 表达 组织芯片脱蜡后,高压抗原修复20 min;3% H2O2室温温育10 min,PBS漂洗,滴加USP22 抗体(1:20),4℃过夜;PBS 冲洗,Alexa Fluor 594 标记山羊抗兔IgG(1:200),37℃孵育1 h,PBS 冲洗,滴一滴抗荧光淬灭封片液(含DAPI),约20 μl;盖上盖玻片,荧光显微镜观察。
1.2.2 细胞培养及传代 HCT-116、SW480、HC-29分别利用McCOY's 5A、L15、McCOY's 5A 培养基(含10% FBS、100 u/ml 青霉素、100 μg/ml 链霉素)37℃、5% CO2培养。细胞黏合度达到90%以上时,弃去培养液,PBS 冲洗,0.25%胰蛋白酶消化,加培养液吹打均匀成单细胞悬液,按1:2 的比例传代培养。
1.2.3 Western blotting 检测结直肠癌细胞中USP22 表达 弃去培养基,用预冷PBS 洗2 次,加入RIPA 冰上 裂解20 min,收集细胞于离心管中,4℃ 12 000 r/min 离心10 min,收集上清液。将25 μg 提取的蛋白行SDS-PAGE 电泳,半干式电转至硝酸纤维素膜后,室温封闭1 h,兔抗USP22 抗体(1:1 000)4℃孵育过夜,加羊抗兔二抗(1:10 000)37℃孵育1 h。TBST 洗涤3 次。采用ECL 发光显影。并用Quantity One 软件对蛋白条带进行灰度分析。
1.2.4 Western blotting 检 测USP22 siRNA 干扰效率针对USP22(XM_005256575.2)设计特异性的靶序列(USP22 siRNA)5'-GCAGCTCACTATGAAGA AACT-3';同时设置阴性对照序列(NC)5'-TTCTCC GAACGTGTCACGT-3'。将细胞分为对照组(未转染组),NC 组(转染NC 片段)和USP22 siRNA 组(转染USP22 siRNA 片段),利用Lipofectamine 2000 转染试剂盒转染SW480 结直肠癌细胞;24 h 后,收集细胞,RIPA 提取蛋白,通过Western blotting 检测USP22 表达情况。
1.2.5 细胞活力检测 将SW480 细胞分为3 组,分组方式同1.2.4,分别进行转染后,传于96 孔板,37℃、5% CO2分别培养12、24、48、72 及96 h,每组设置5 个复孔。利用MTT 检测试剂盒检测每孔光密度(OD)值。
1.2.6 细胞周期检测 将SW480 细胞分为3 组,分组方式同1.2.4,分别进行转染24 h 后收集细胞悬液,1 000 r/min 离心5 min,吸取上清液。PBS 重悬漂洗细胞,缓慢加入700 μl 预冷的乙醇,使乙醇终浓度为70%,4℃固定过夜,1 000 r/min 离心5 min,预冷PBS 漂洗2 次。加入100 μl RNaseA(50 μg/ml),37℃水浴30 min,加入400 μl PI(50 μg/ml),4℃避光染色30 min,流式细胞仪检测。
1.2.7 细胞凋亡检测 将SW480 细胞分为3 组,分组方式同1.2.4,分别转染24 h 后收集细胞,加入Annexin V-FITC 及PI 染色,随即进行流式细胞仪检测分析。
1.2.8 Western blotting检测 将SW480细胞分为3组,分组方式同1.2.4,分别转染24 h 后弃上清液,收集细胞,RIPA 裂解收集蛋白,以Cyclin B1(1:1 000)、p21(1:800)、CDK2(1:1 000)、p53(1:1 000)为一抗,通过Western blotting 检测各指标的表达。
1.3 统计学方法
数据分析采用SPSS 13.0 统计软件。计量资料以均数±标准差(±s)表示,比较采用单因素方差分析或重复测量设计的方差分析,进一步两两比较采用LSD-t检验,P<0.05 为差异有统计学意义。
2 结果
2.1 结直肠癌组织USP22 高表达
免疫荧光检测发现,在结直肠癌组织中,USP22异常高表达;配对的癌旁组织中,USP22 呈阴性。见图1。
2.2 结直肠癌细胞株USP22 表达情况
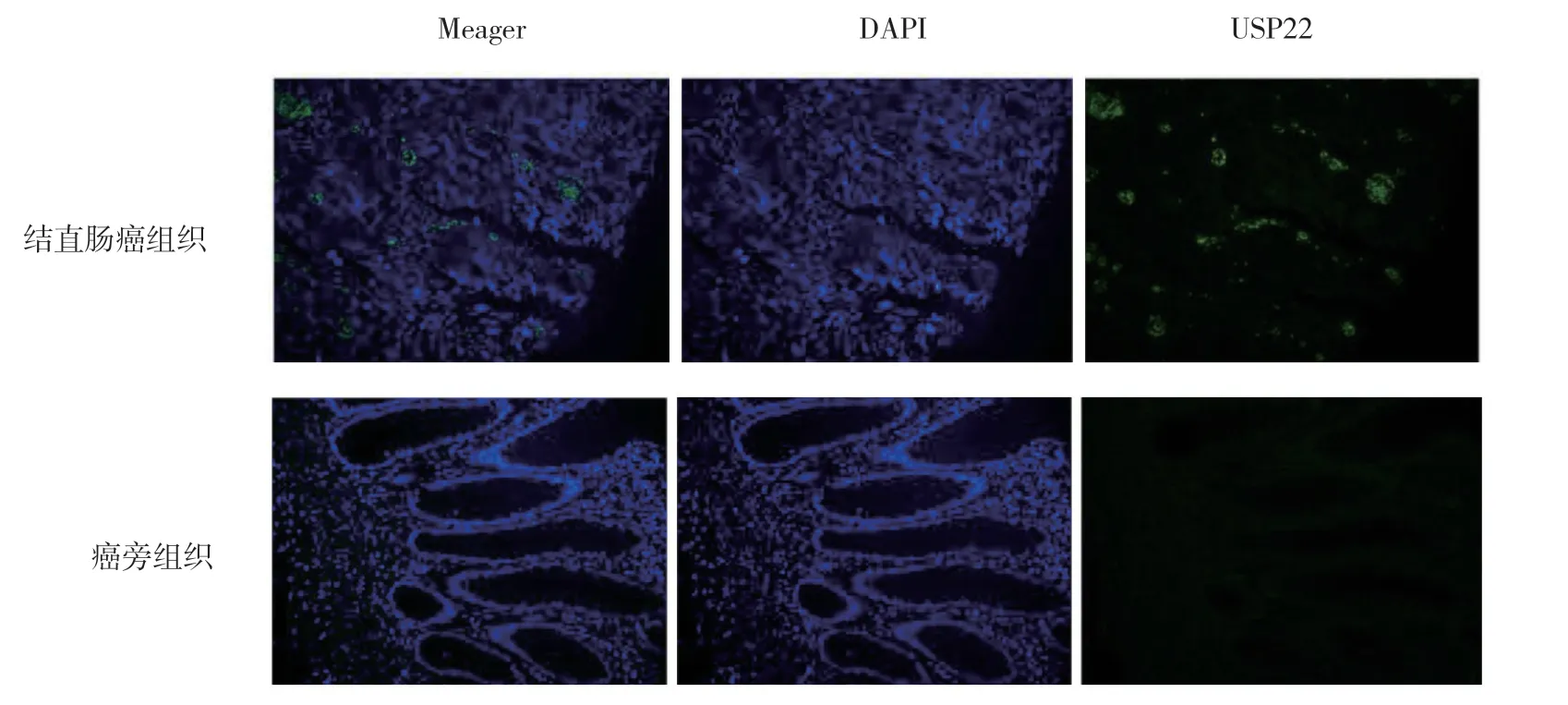
图1 结直肠癌组织和癌旁组织中USP22 表达 (×200)
Western blotting 检测发现,人结直肠癌细胞株HT-29、SW480、HCT-116 均表达USP22,HT-29、HCT-116和SW480 细胞中USP22 相对表达量(相对GAPDH)分别为(0.61±0.03)、(0.73±0.04)和(0.85±0.06)。各组细胞USP22 表达有差异(F=69.130,P=0.000);与HT-29 细胞、HCT-116 细胞比较,SW480 细胞中USP22 表达量最高(P<0.05),因此选择SW480 细胞作为后续研究。见图2。
2.3 USP22 siRNA 降低USP22 的表达
USP22 siRNA 转染SW480 细胞,作用24h 后检测USP22 的表达量。对照组、NC 组及USP22 siRNA 组USP22 相对表达量(相对GAPDH)分别为(0.98± 0.15)、(0.94±0.22)和(0.30±0.02),差异有统计学意义(F=200.600,P=0.000)。USP22 siRNA 组与对照 组比较,USP22 siRNA 可降低USP22 的表达量(P<0.05)。见图3。
2.4 USP22 抑制后细胞增殖能力情况
对照组、NC 组、USP22 siRNA 组在12、24、48、72 及96h 的OD 值比较,采用重复测量设计的方差分析,结果:①不同时间点的OD 值有差异(F=315.312,P=0.000);②3 组在相同时间段的OD 值有差异(F=716.226,P=0.000);③3 组OD 值变化趋势有差异(F=37.270,P=0.000)。见表1。
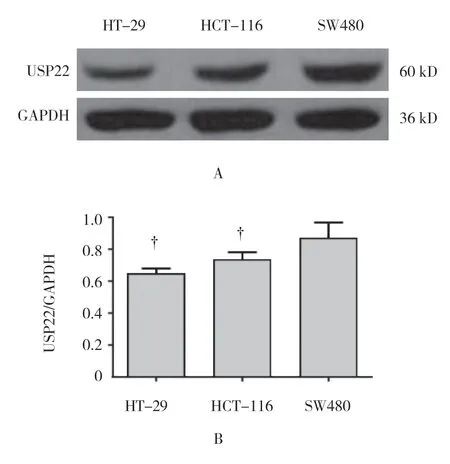
图2 3 种细胞株中USP22 蛋白表达情况
2.5 USP22 抑制后细胞周期的变化情况
流式细胞术检测结果显示:对照组、NC 组及USP22 siRNA 组G0/G1期细胞占比分别为(43.16± 0.64)%、(45.35±0.85)%和(67.94±2.03)%,差异有统计学意义(F=322.800,P=0.000),USP22 干扰后,G0/G1期细胞占比较对照组升高(P<0.05);对照组、NC 组及USP22 siRNA 组S 期细胞占比分别为(38.54±1.05)%、(37.23±1.90)%和(16.36±0.75)%,差异有统计学意义(F=2628.000,P=0.000),USP22干扰后,S 期细胞占比较对照组降低(P<0.05)。见图4。
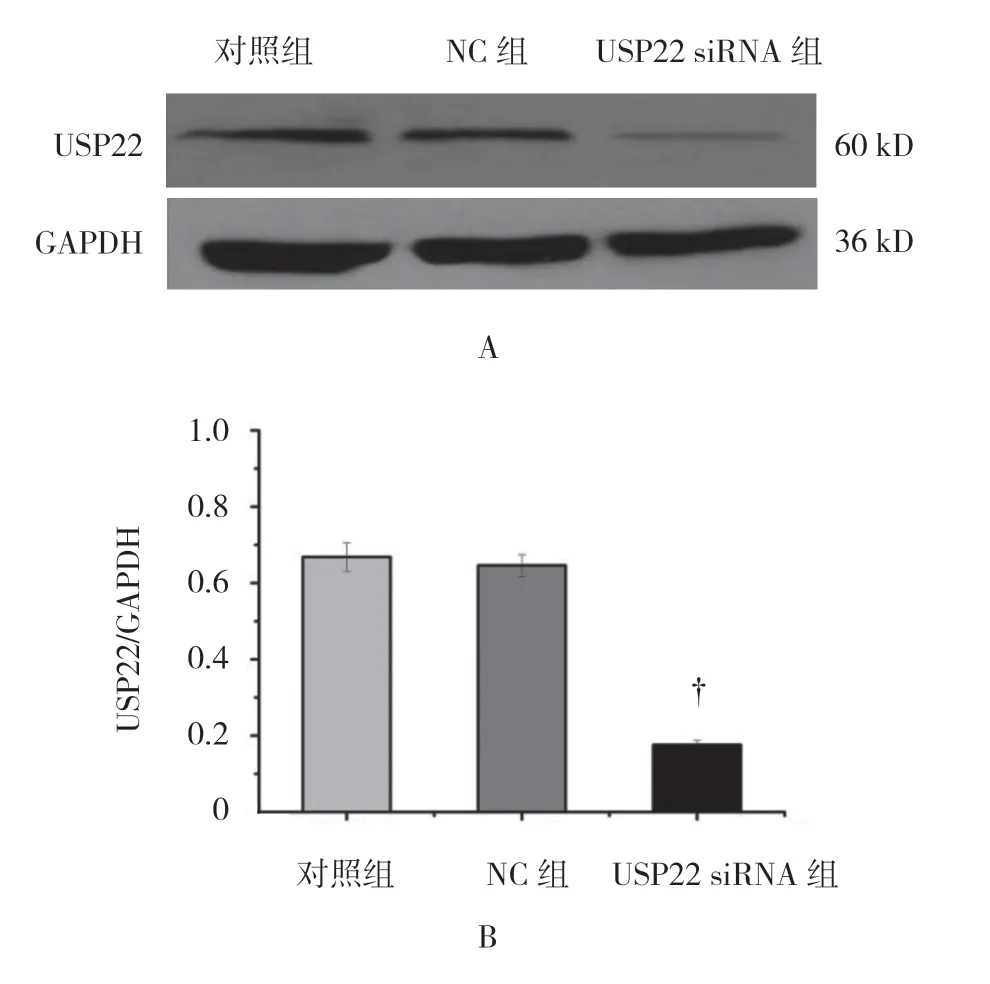
图3 3 组USP22 的表达情况
2.6 USP22 抑制后细胞凋亡率的变化情况
细胞凋亡结果显示,对照组、NC 组和USP22 siRNA 组早期凋亡细胞率分别为(6.59±0.11)%、(8.73± 0.14)%和(21.18±0.25)%,3 组凋亡率比较差异有统计学意义(F=492.800,P=0.000)。与对照组比较,USP22 siRNA 增加细胞早期凋亡率(P<0.05)。见图5。
表1 各组细胞在不同时间条件下OD 值的变化 (±s)
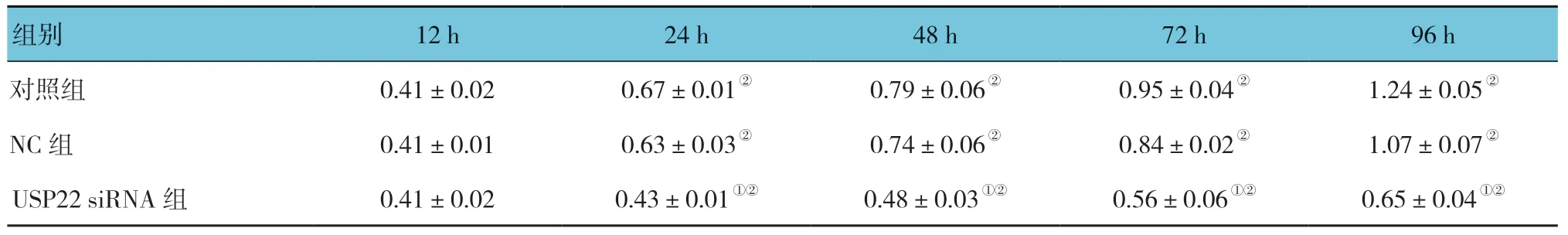
表1 各组细胞在不同时间条件下OD 值的变化 (±s)
注:①与对照组比较,P <0.05;②与12 h 比较,P <0.05。
组别 12 h 24 h 48 h 72 h 96 h对照组 0.41±0.02 0.67±0.01② 0.79±0.06② 0.95±0.04② 1.24±0.05②NC 组 0.41±0.01 0.63±0.03② 0.74±0.06② 0.84±0.02② 1.07±0.07②USP22 siRNA 组 0.41±0.02 0.43±0.01①② 0.48±0.03①② 0.56±0.06①② 0.65±0.04①②
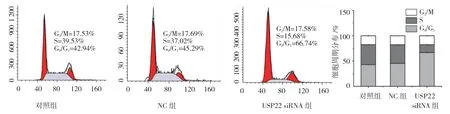
图4 USP22 抑制后SW480 细胞周期的变化情况
2.7 USP22 抑制后周期相关蛋白的表达情况
对照组、NC 组和USP22 siRNA 组中周期蛋白 CyclinB1、CDK2 的表达有差异(F=377.346 和211.132,P=0.000),USP22 siRNA 组中CyclinB1、CDK2 的表达量较对照组降低(P<0.05);3 组p21 和p53 的表达量有差异(F=168.414 和392.018,均P=0.000),USP22 siRNA 组中p21、p53 的表达量较对照组升高(P<0.05)。见表2和图6。

图5 USP22 抑制后SW480 细胞凋亡率的变化情况
表2 3 组周期相关蛋白相对表达量比较 (±s)
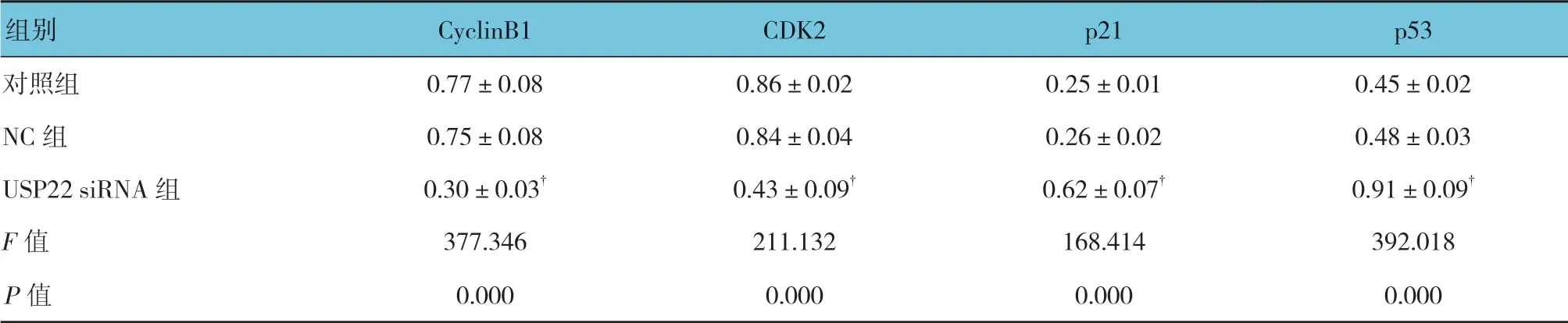
表2 3 组周期相关蛋白相对表达量比较 (±s)
注:†与对照组比较,P <0.05。
组别 CyclinB1 CDK2 p21 p53对照组 0.77±0.08 0.86±0.02 0.25±0.01 0.45±0.02 NC 组 0.75±0.08 0.84±0.04 0.26±0.02 0.48±0.03 USP22 siRNA 组 0.30±0.03† 0.43±0.09† 0.62±0.07† 0.91±0.09†F 值 377.346 211.132 168.414 392.018 P 值 0.000 0.000 0.000 0.000
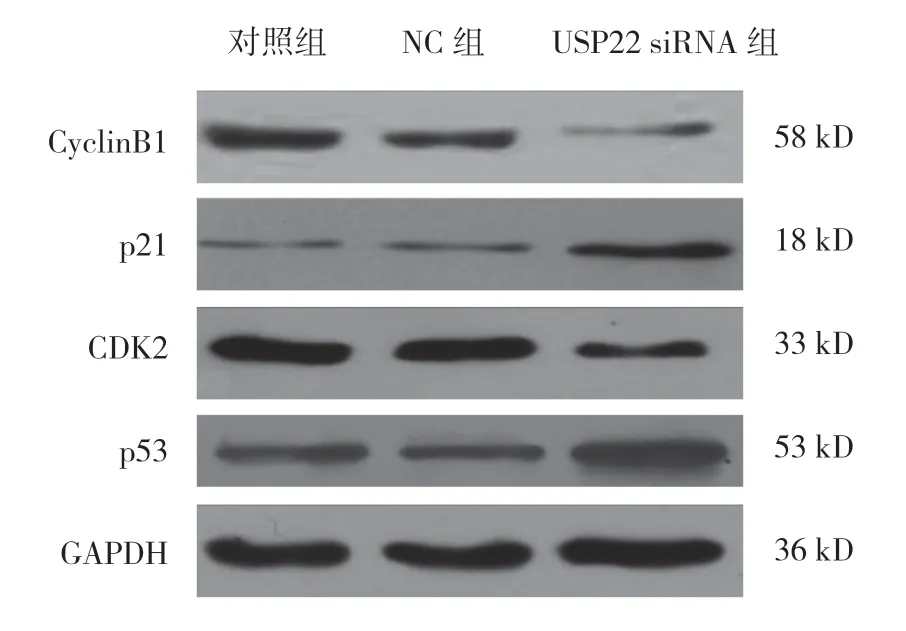
图6 USP22 抑制后,周期蛋白表达
3 讨论
2005年,GLINSKY 等[11]对各种肿瘤组织的mRNA 水平进行分析,发现肿瘤组织中的11 个过表达的基因可以用作癌症死亡标志基因,包括USP22、BUB1、HEC1/KNTC2、CCNB1、Ki67、Gbx2、FGFR2、ANK3、CES、BMI-1和RNF2。USP22 过表达可能与肿瘤发生、转移、复发和耐药性相关。有研究认为,利用慢病毒载体sh-USP22 能有效抑制USP22基因的表达,并有效抑制鼻咽癌CNE-2 细胞的裸鼠成瘤能力[12]。张琳等[13]研究认为,结直肠癌组织中USP22 的异常高表达可能参与结直肠癌的发生、发展过程。USP22 表达与胰腺癌细胞系对吉西他滨敏感性相关,抑制USP22 表达增加胰腺癌细胞对吉西他滨的敏感性,可有效逆转吉西他滨的耐药[14]。本研究发现,HT-29、HCT-116、SW480 3 株结直肠癌细胞中均有USP22 表达,其中SW480 的表达量最高。
USP22 在细胞周期调控过程中起到重要作用。hSAGA 是转录辅助因子复合物,其通过组氨酸尾部的特异性氨基酸共价修饰(例如乙酰化、甲基化和去泛素化)将其转录复合物募集到其靶基因的启动子以激活基因转录[15-16]。USP22 是hSAGA 的亚单位,可以引起组蛋白H2A 和H2B 的去泛素化和组蛋白H4 的乙酰化[17]。本研究使用RNAi 的方法探索抑制USP22对于结直肠癌细胞增殖的影响,结果发现USP22 表达量的减少可以增加G0/G1期的细胞比例,使结直肠癌细胞周期停滞在G0/G1期,从而抑制细胞的周期进程。此外,促进细胞周期进程[18]相关的CyclinB1、CDK2 蛋白的表达量也降低,而细胞周期负性调控因子p21[19]的表达量升高。p21 的表达量与细胞凋亡同样密切相关,本研究也发现USP22 被抑制后可以增加结直肠癌细胞的凋亡比例,说明USP22 可以影响结直肠癌细胞的凋亡。
综上所述,USP22 抑制后,能够抑制结直肠癌细胞的增殖,其机制可能与抑制细胞周期进程,促进细胞凋亡有关。本研究结果可以为筛选USP22 作为治疗结直肠癌的靶标提供理论依据,但具体的作用机制以及相关通路需要更进一步的研究。

