肝硬度值在ALT低于2倍正常值上限慢性HBV感染者肝纤维化中的应用价值
唐伯莹 杨晴 王岩 关欣
沈阳市第六人民医院肝病科(沈阳110006)
瞬时弹性超声成像技术是一种通过测量肝脏硬度值(liver stiffness measurement,LSM)对慢性肝病患者肝纤维化程度进行定量分级的检测方法,具有无创性、即时性、重复性、安全性好等优点,已被应用于慢性乙型肝炎肝纤维化的诊断和治疗后跟踪随访。但LSM 检测值受丙氨酸氨基转移酶(alanine aminotransferase,ALT)水平的影响[1]。目前国内外乙型肝炎防治指南均以ALT≥2×ULN作为抗病毒治疗的标准,ALT <2×ULN 的慢性乙型肝炎,患者主要依据肝穿组织学检查判断是否适合治疗,若存在明显纤维化即应抗病毒治疗[2-3]。因此对ALT <2×ULN 的慢性乙型肝炎病毒(hepatitis B virus,HBV)感染者其肝纤维化程度的准确评估十分必要。但有关的研究较少。因此,本研究针对ALT 持续低于2×ULN 的慢性HBV感染者的LSM 与肝穿病理诊断进行了对照分析,进一步明确LSM 在这类人群中的应用价值。为临床抗病毒治疗以及肝穿时机的选择提供依据。
1 资料与方法
1.1 一般资料本研究经过沈阳市第六人民医院伦理委员会批准。病例来源于2014年3月至2018年7月在我院进行肝活检的慢性HBV 感染者128 例,并且这些患者的ALT 水平持续低于2×ULN。诊断均符合《慢性乙肝防治指南(2015 更新版)》标准[2]。患者同意进行肝活检并自愿签署知情同意书。排除标准:年龄<14 或>65 周岁;孕妇及哺乳期妇女。患有其他种类的肝病、失代偿期肝硬化、肿瘤、糖尿病以及明显高血压等其他严重疾病。未曾进行抗病毒或者抗纤维化治疗,近期未应用对凝血功能有影响的药物。
1.2 方法
1.2.1 肝硬度检测在肝活检前1 周内与肝功生化等同期空腹检测,由有资质的专业人员采用FibroScan502(法国Echosens 公司)检测患者的LSM(单位为kPa)。要求连续有成功测量10 次,最终结果以中位数表示,具体按用户手册进行严格操作。
1.2.2 肝组织病理采用美国MC1616 型一次性活检针B 超引导下穿刺,由专人操作。获取的组织入10%甲醛溶液固定,石蜡切片,行HE 染色、Masson 三色以及浸银染色。由有经验的病理医师进行诊断,肝组织炎症和纤维化程度的诊断严格按标准[2]执行。
1.2.3 实验室检查肝活检前1 周内经静脉抽血,留取标本。检测血细胞计数、凝血功能以及肝功生化等指标。并计算天冬氨酸氨基转移酶/血小板比值(APRI):计算式为:APRI[4]=[AST(IU/L)/ULN/PLT(109/L)]×100,公式中ULN 为AST 正常值上限。
1.3 统计学方法采用SPSS 15.0 软件统计分析。计量资料采用中位数四分位间距[M(P25~P75)]表示。组间比较采用非参数法进行检验;相关性比较采用Spearman 相关分析,肝纤维化的价值应用受试者工作特征曲线下面积(area under receiver operating characteristic curve,AUC)进行分析,P<0.05 为差异具有统计学意义(双侧性检验)。
2 结果
2.1 基线资料纳入128 例慢性HBV 感染者中,男75 例(58.6%),女53 例(41.4%),年龄16 ~59岁,平均(38.3 ± 8.1)岁。体质量指数(BMI)17.1 ~28.2 kg/m2,平均(23.2 ± 3.3)kg/m2。四分位间距(IQR)与测量值M 的比值(IQR/M)为0.15~0.17 平均(0.16 ± 0.07)。其中ALT 正常者67 例(52.3%),ALT <2 × ULN(40 ~80 U/L)者61 例(47.7%)。HBeAg 阳性者94 例(72.9%),胆红素水平在各分组中均在正常值范围。肝组织可供评价的汇管区平均为(11.01 ± 2.04)个。病理诊断结果见表1。
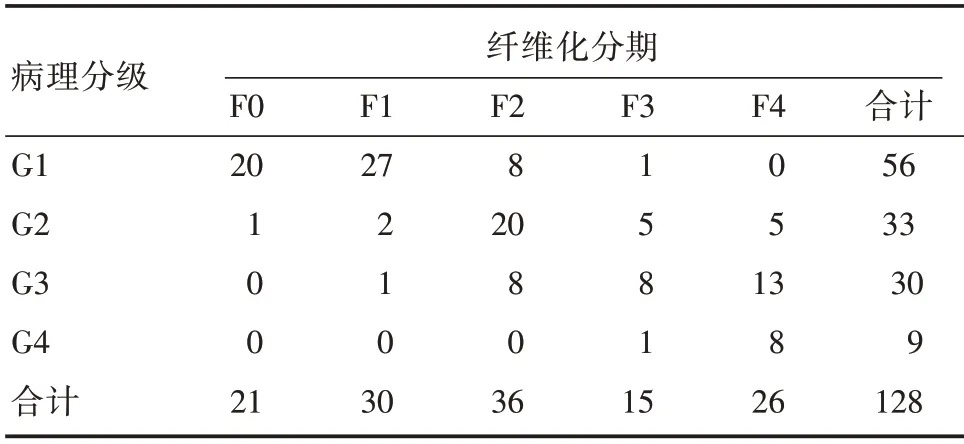
表1 慢性HBV 感染者肝组织病理特点Tab.1 Pathological features of liver tissues in chronic hepatitis B virus infectors 例
2.2 不同ALT 水平的LSM 与肝纤维化病理分期的关系在F0、F1、F2、F3、F4 不同纤维化病理分期中,ALT 正常组的例数分别为10、14、20、8、15例,ALT <2 × ULN 组的例数分别为11、16、16、7、11 例。ALT 正常组的LSM 中位值分别为6.1、7.7、8.1、13.7、15.4 kPa,ALT <2×ULN组的LSM 中位值分别为6.7、6.8、9.5、12.2、14.9 kPa。两组LSM 分别在同一肝纤维化分期中差异无统计学意义。两组LSM 分别在F0、F1、F2、F3、F4 不同纤维化分期中差异具有统计学意义,但在F0 与F1 之间差异无统计学意义(Z值分别为-1.904、-1.087,P值分别0.056、0.294)。见表2。
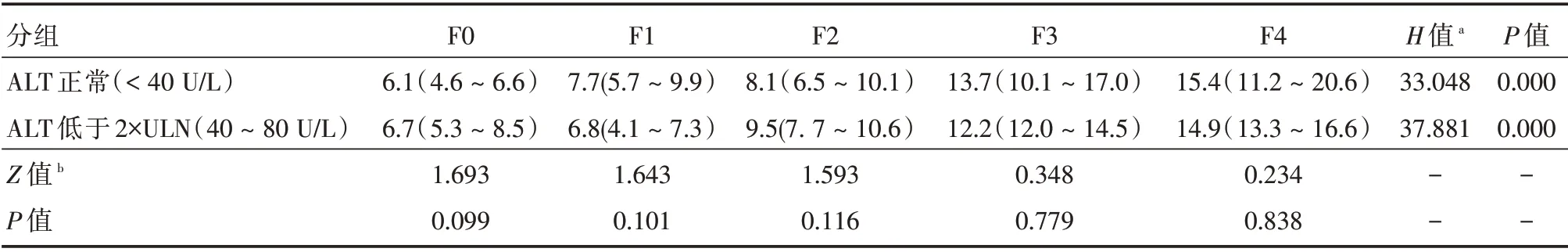
表2 两组LSM 在不同肝纤维化分期中的比较Tab.2 Comparison of two groups of in different liver fibrosis stages M(P25 ~P75)
2.3 LSM与肝组织病理以及ALT水平的相关性Spearman 等级相关分析显示,在ALT <2 × ULN 的128 例HBV 感染者中,LSM 与炎症分级的相关系数为0.572,P<0.001。与肝纤维化分期的相关系数为0.721,P<0.001。LSM 与ALT 水平的相关系数为0.012,P=0.892。
2.4 LSM 诊断肝纤维化程度的价值分析本研究将F2~F3 界定为明显肝纤维化,F4 界定为早期肝硬化。以肝组织纤维化分期为标准绘制ROC曲线。LSM 诊断F2~F3 和F4 的AUC 分别为0.804、0.892,高于公认的模型APRI。具体评价指标见表3和图1、2。

表3 LSM 和APRI 在不同肝纤维化分期中的诊断价值Tab.3 Diagnostic value of LSM and APRI in different liver fibrosis stages
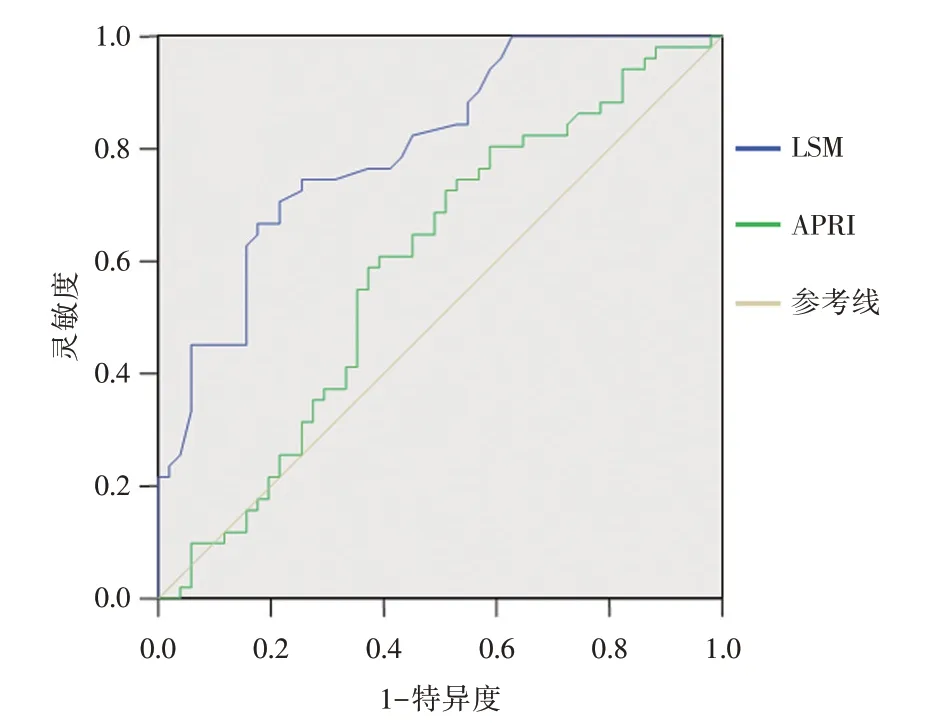
图1 LSM 及APRI 诊断F2~F3 的ROC 曲线Fig.1 The ROC curves of LSM and APRI in diagnosing liver fibrosis in stages 2~3
2.5 LSM 与APRI 与肝纤维化程度的相关性比较Spearman 相关分析显示LSM 与肝纤维化(F2~F3)和肝硬化(F4)相关系数为0.527 和0.546,而APRI 与肝纤维化(F2~F3)相关系数为0.151,几乎不具备相关性,与肝硬化(F4)的相关系数为0.317。见表4。
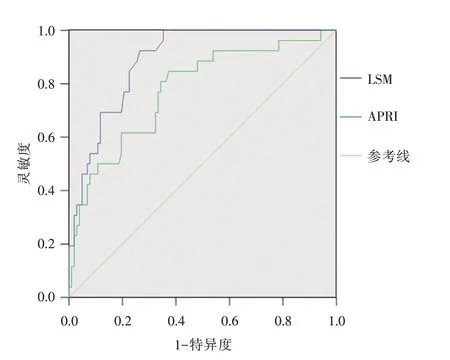
图2 LSM 及APRI 诊断F4 的ROC 曲线Fig.2 The ROC curves of LSM and APRI in diagnosing liver fibrosis in stages 4
3 讨论
肝纤维化是肝细胞损伤后的修复反应,是可逆的病理过程。目前认为由HBV 感染所致肝纤维化是最终发展为肝硬化以及肝细胞癌的中间环节。经有效的抗病毒治疗可延缓或逆转乙型肝炎肝纤维化甚至肝硬化。而ALT <2 × ULN 的慢性HBV 感染者没有纳入指南规定的抗病毒治疗规范,这类人群是否需要抗病毒治疗是临床中经常面对的现实问题。研究发现一些ALT 正常或轻微异常的HBV 感染者肝组织病理多存在明显病变[5-6]。甚至ALT正常的免疫耐受期亦并非安全[7]。本研究纳入的128 例ALT <2 × ULN 的HBV 感染者中,G2 以及以上患者为72 例,占56.3%,F2 以及以上患者为77 例,占60.2%,这部分患者,如果不进行及时的肝穿病理检查,大多会延误治疗时机。虽然肝穿病理检查是诊断肝纤维化的金标准,但肝穿是有创的检查,存在取样误差、难以重复操作等多种因素,限制了其在临床中的广泛应用。FibroScan 测量LSM 用于评估肝脏纤维化程度因无创、操作简单,得到了临床的普遍认同。本研究根据《瞬时弹性成像技术临床应用专家共识》的要求的排除了引起测量失败的可能因素。结果显示ALT 正常组与ALT <2×ULN 组的LSM 均随纤维化程度的升高而逐渐升高,F4 达最高水平,在F2 以上的不同纤维化分期中差异均有统计学意义,可见LSM 能较准确地区分明显肝纤维化的程度。但在同一肝纤维化分期中两组的LSM 差异并无统计学意义,说明轻微ALT 升高对LSM 的影响可能较小。有报道[8-9],LSM 诊断乙型肝炎肝硬化的准确性受ALT 的影响不明显,诊断F2 以上肝纤维化在ALT <2 倍正常值以及<3 倍正常值的情况下的准确性亦无明显影响。进一步分析发现在ALT <2× ULN 的HBV 感染者中,其LSM 虽与肝组织炎症和纤维化程度均相关,但与肝纤维化程度的相关性更强,但与ALT 水平不相关,以上结果与有关报道相一致[10]。以肝纤维化病理分期为金标准,分别绘制ROC 曲线,获得LSM 诊断F2~F3 的AUC 为0.804,最优界值为7.9 kPa,灵敏度为70.6%,特异度为78.4%,准确率为74.5%;诊断F4 的AUC 为0.892,最优界值为10.3 kPa,灵敏度为92.3%,特异度为73.5%,准确率为77.3%。可见LSM 对F2~F3以及F4 均具有良好的诊断价值。本研究中LSM诊断肝纤维化的最优界值与我国TE 临床应用专家共识推荐的诊断诊断明显纤维化(F2)的界值7 ~8.5 kPa 相近,但诊断肝硬化的界值低于我国TE 临床应用专家共识推荐的11.0 kPa 的排除标准以及美国胃肠病学会(AGA)提出的弹性成像评估肝纤维化指南中的11.0 kPa 的标准[1,3]。但有些类似的研究界值亦较低[11-13]。例如LI 等[13]对188 例ALT 轻度升高慢性乙型肝炎的研究中,明显肝纤维化(F ≥2)的界值是6.5 kPa,肝硬化(F4)的界值是9.5 kPa。这类人群诊断界普遍值偏低原因可能是肝组织炎症程度和纤维化程度不同所致。关于界值的准确性仍有待更多肝穿病理样本的积累进一步分层分析,寻找最优的界值以便更准确地区分肝纤维化的程度,更方便临床。

表4 LSM 和APRI 与肝纤维化程度的相关性分析Tab.4 Correlation analysis of LSM and APRI with liver fibrosis stages
Spearman 相关分析显示LSM 与F2~F3 和F4 均具有良好的相关性,而APRI 仅与F4 有微弱的正相关。利用Z 检验分别比较LSM 和APRI 诊断F2~F3和F4 的AUC,结果发现LSM 明显为高,即LSM 对肝纤维化程度的诊断价值优于公认的血清学模型APRI,与类似的多数研究报道一致[14-15]。APRI 是WAI 等[4]提出的用于评价慢性丙型肝炎肝纤维化的模型,含有天冬氨酸氨基转移酶和血小板两项简单的指标,临床应用方便,我国慢性乙型肝炎防治指南亦将其作为评价乙型肝炎肝纤维化的无创模型,但实际应用价值有待进一步评估。
综上,在ALT <2 × ULN 的HBV 感染者中,LSM 对F2 以上的明显纤维化以及早期肝硬化具有较好的临床应用价值,优于一些血清学诊断模型。而ALT 水平对LSM 的影响较小。因此LSM 可用于这类人群肝纤维化程度的初步筛查以及随访管理,在一定程度上代替肝活检,有助于临床治疗时机的把握。但LSM 检测还受炎症、肥胖、腹水等多种因素影响,临床应用时需结合临床、血清学以及其他影像学资料综合考虑,以提高诊断准确性,必要时仍需肝穿活检明确诊断。

