伊马替尼治疗慢性粒细胞白血病的疗效评估
邢丰 冯国安
慢性粒细胞白血病(chronic myelogenous leukemia,CML)是由于骨髓多功能造血干细胞发生异常增殖而引起的恶性血液疾病,其中约有95%的CML 患者存在Ph 染色体阳性和BCR/ABL 融合基因。CML 在成人白血病患者中的发病率仅为10%~15%,而且好发于中年人,该疾病早期症状不明显,临床上可将CML 分为慢性期、加速期和急性期,且大多数确诊为CML 者处于慢性期[1-2],如若继续发展则后果严重[3]。BCR/ABL 融合蛋白是CML 产生和发展的分子生物学基础,通过导致机体出现一系列信号蛋白的磷酸化过程,进而引起细胞凋亡和增殖分化黏附等[4-5]。酪氨酸激酶抑制剂诸如伊马替尼、达沙替尼、尼洛替尼等,其主要通过抑制BCR-ABL 融合蛋白进而发挥分子靶向治疗CML 的功效[6],已经作为CML 的一线治疗方案广泛应用于临床。
1 资料与方法
1.1 一般资料
选取我院2017 年1 月—2019 年1 月间住院治疗的84 例CML患者作为研究对象,按照《中国慢性髓性白血病诊断与治疗指南(2016 年版)》,入选患者均经过骨髓象和外周血象等检查,确诊为CML。在临床上,外周血嗜碱粒细胞比例不高于20%,原始细胞比例不高于15%,而且具有明显的骨髓增生现象[7]。并且需排除药物过敏史和严重肝肾功能损害者。本研究中所有患者均知情同意并经我院伦理委员会批准实施。按照随机数字表法将患者随机分为对照组和观察组,其中对照组42 例,男性18 例,女性24 例,年龄在39~75 岁,平均年龄为(55.67±12.75)岁,Sokal 评分:低危18 例,中危20 例,高危4 例;观察组42 例,男性17 例,女性25 例,年龄在40~77 岁之间,平均年龄为(56.12±10.97)岁,Sokal 评分:低危18 例,中危21 例,高危3例。两组患者的年龄、性别比例和Solal 评分等临床一般性资料经检验差异无统计学意义(P>0.05)。
1.2 方法
对于对照组患者给予常规化疗方案,结合实际病情选择合适的化疗药物,如慢性期内选择干扰素、羟基脲;加速期和急性期内VMP 化疗方案(即长春新碱+6-巯基嘌呤+强的松)进行治疗。观察组患者在常规化疗方案的基础上加用伊马替尼片(Novartis Pharma Schweiz AG 生 产,瑞 士,批 准 文 号:H20150298,H20150112,规格:0.4 g,0.1 g),如慢性期患者每次口服400 mg,每天1 次,需于早餐后30min 后服用药物;加速期和急性期内患者口服伊马替尼的初始计量为400 mg/次,每天1 次,如若未出现明显的不良反应,则药物剂量需增加至600 mg/次。两组患者均需持续接受临床治疗1 年,而且在治疗期间要严密监测血常规的变化。
1.3 观察指标
比较两组患者不同时间点的完全细胞遗传缓解率(CCyR)、完全血液学缓解率(CHR)和分子生物学缓解率(MMR)。其中,完全细胞遗传缓解指骨髓中未发现Ph(+)细胞;完全血液学缓解指外周血白细胞(WBC)小于10×109/L,血小板(PLT)小于450×109/L,WBC 分类中无幼稚细胞,且无白血病的临床体征;分子生物学缓解指骨髓RT-PCR检测显示BCR-ABL/ABL值小于5。另外,通过上述指标评估患者的临床疗效,即完全缓解(达到上述三项指标要求者)、部分缓解(至少1 项指标符合要求,且骨髓中Ph(+)细胞不足35%者)、未缓解(上述三项均未达到要求,且骨髓中Ph(+)细胞达到35%者)[8]。客观缓解率=完全缓解率+部分缓解率。
比较两组患者的免疫功能指标:采用流式细胞仪测定,T 细胞免疫功能指标(CD3+、CD4/CD8 数值)、NK 细胞数值。
比较两组患者的生存质量评分:采用GQL-74 生命质量综合评定量表进行评估,指标内容具体包括躯体健康、心理健康、社会功能、物质生活等。
比较两组患者在治疗期间可能出现的不良反应情况:皮疹、恶心呕吐、下肢水肿、肝功能异常等。另外,比较两组患者的耐药性情况,可以分为原发性耐药和继发性耐药。其中,原发性耐药指经初始标准治疗4 周以上者未达到WBC 下降标准,用药3 个月未达到完全血液学缓解标准,用药6 个月未达到微小细胞遗传缓解标准,用药1 年未达到部分或完全细胞遗传学缓解标准[9]。继发性耐药指治疗后患者达到血液学缓解标准,达到微小细胞遗传学缓解标准的程度不符合一般水平,或者有其它证据可以显示患者在某项结构域中发生了突变。
1.4 统计学方法
选择SPSS20.0 进行分析,采用t检验比较两组间的计量资料;采用χ2检验比较两组间的计数资料,P<0.05 表示差异有统计学意义。
2 结果
2.1 两组临床疗效比较
观察组患者完全缓解6 例,部分缓解24 例,未缓解12 例,客观缓解率为71.43%(30/42);对照组患者完全缓解3 例,部分缓解17 例,未缓解22 例,客观缓解率为47.62%(20/42)。经统计学分析,观察组的客观缓解率显著高于对照组,差异有统计学意义(χ2=4.941,P=0.026)。
2.2 两组CCyR、CHR、MMR 比较
通过比较不同治疗时间点的CCyR、CHR、MMR,结果显示:治疗6 个月和1 年后,观察组的CCyR 显著高于对照组,差异有统计学意义(P<0.05),详见表1。
2.3 两组免疫指标比较
治疗前两组患者的免疫功能指标CD3+、CD4/CD8、NK 比较差异无统计学意义(P>0.05);治疗后的各项免疫功能指标均较治疗前显著改善(P<0.05),而且,相比于对照组,观察组患者的免疫功能指标改善幅度更为显著,详见表2。
2.4 两组生存质量评分比较
治疗前两组患者的生存质量评分(躯体健康、心理健康、物质生活、社会功能)差异无统计学意义(P>0.05);治疗后的各项指标均较治疗前改善(P<0.05),而且,相比于对照组,观察组患者的生活质量评分指标改善幅度更为显著,详见表3。
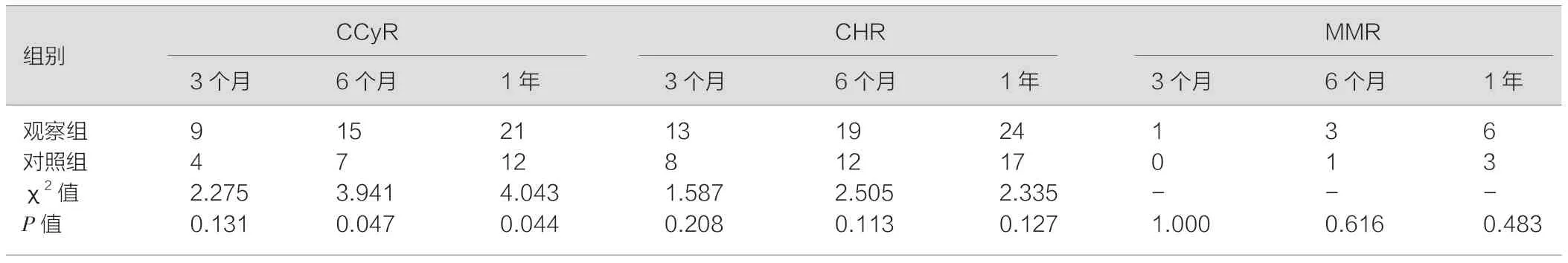
表1 两组患者的CCyR、CHR、MMR 比较[例(%)]
表2 两组患者的免疫功能比较()

表2 两组患者的免疫功能比较()
注:与治疗前相比,*P<0.05;与对照组相比,#P<0.05
表3 两组患者的生存质量评分比较(分,)
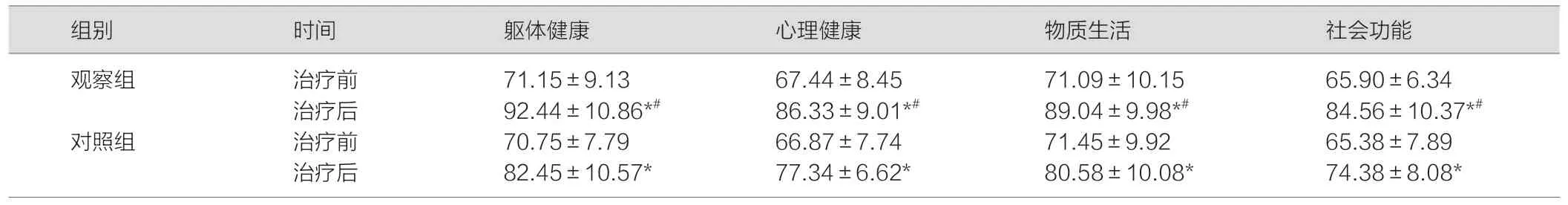
表3 两组患者的生存质量评分比较(分,)
注:与治疗前相比,*P<0.05;与对照组相比,#P<0.05
2.5 两组不良反应及耐药性分析
观察组共出现10 例:2 例皮疹、3 例恶心呕吐、2 例肝功能异常以及3 例血常规紊乱;对照组共出现9 例:3 例皮疹、4 例恶心呕吐、1 例肝功能异常及1 例血常规紊乱。经统计学检验,两组间的不良反应发生率差异无统计学意义(P>0.05)。
针对于伊马替尼的耐药性分析,结果显示观察组原发性耐药率为42.86%,继发性耐药率为23.81%。
3 讨论
CML 属于粒系细胞增殖的血液系统恶性肿瘤,可追溯至骨髓造血干细胞,慢性期患者病情尚可有效控制;而处于加速期和急性期则病情会急剧恶化,预后也大多不良,同时也伴随着低热、乏力、脏器肿大等临床特征[10]。CML 是由于DNA 不断产生异常的蛋白质以干扰骨髓中正常白细胞的生成,导致不成熟的白细胞数量急剧增加,反过来也会抑制骨髓的正常造血功能,并且还会随着血液扩散到全身的器官。针对不同分期的CML 需给予不同的治疗方案,慢性期主要控制疾病进展和维持正常血细胞水平为主,加速期和急性期主要以清除白血病细胞、促进恢复骨髓造血功能为主,多采用化疗方案但效果也有限[11]。
临床上有可能治愈白血病的方法就是异基因造血干细胞移植,但存在供体数量有限、免疫排斥反应以及器官感染的因素限制。作为第一代酪氨酸激酶抑制剂的伊马替尼,可以阻断ATP 与酪氨酸蛋白相结合,抑制酪氨酸激酶发生磷酸化,阻止融合基因的不断增殖。有研究表明,伊马替尼不会对正常的细胞增殖造成不良影响,具有靶向特异性[12]。伊马替尼可有效延长患者生存期,已成为CML 的一线标准治疗药物。而且,伊马替尼口服吸收迅速且与血浆蛋白结合率非常高。本研究结果显示,观察组患者的客观缓解率显著高于对照组的;治疗6 个月和1 年后,观察组的CCyR显著高于对照组;治疗后观察组的免疫功能指标和生活质量评分均显著优于对照组;不良反应方面,两组间无明显差异,但观察组伊马替尼原发性耐药率为42.86%,继发性耐药率为23.81%。伊马替尼治疗CML 具有良好的临床效果,可有效改善免疫功能和生活质量,安全性良好,但需注意其药物耐药性的发生,严格按照临床指征用药。
伊马替尼应用于CML 的临床治疗,以加速期和急性期产生耐药性的比重较大。原因为BCR/ABL 激酶位点变异,或融合蛋白基因扩增和过度表达。临床上针对于伊马替尼耐药性的问题处理多以加大用药剂量为主,若效果不明显则需停止用药,后续考虑联合其它化疗药物以降低BCR/ABL 信号通路的敏感度,增加药效作用。

