细胞色素P450酶催化烟草特异性亚硝胺N’-亚硝基新烟草碱和N’-亚硝基假木贼碱代谢活化的分子机制研究
倪君秀,徐婷,温家乐,徐小琴,于海瀛,尉小旋,马广才
浙江师范大学地理与环境科学学院,金华 321004
在全世界范围内,吸烟是引发人体肺癌和口腔癌的主要原因,而烟草制品和烟草烟雾中的特异性亚硝胺(tobacco-specific nitrosamines, TSNAs)类致癌化合物是诱发这2种癌症的主要因素之一[1-3]。TSNAs主要包括4-(甲基亚硝胺基)-1-(3-吡啶基)-1-丁酮(4-(methylnitrosoamino)-1-(3-pyridyl)-1-butanone, NNK)、N’-亚硝基降烟碱(N’-nitrosonornicotine, NNN)、N’-亚硝基假木贼碱(N’-nitrosoanabasine, NAB)和N’-亚硝基新烟草碱(N’-nitrosoanatabine, NAT)等4种化合物,如图1所示,其中NNK和NNN因其高致癌活性而备受关注,被国际癌症研究机构(IARC)列为第一类致癌物,而NAB和NAT的致癌活性相对较小,为第三类可能致癌物[3-4]。实验检测发现在不同烟草制品中TSNAs的总量可达313~76 500 ng·g-1[5],而即使在香烟烟雾中TSNAs的含量亦可达76.2~571.6 ng·cigarette-1[6]。此外,TSNAs还存于大气颗粒物中,其平均浓度约为1 ng·m-3[7]。因此烟草暴露会使人体摄入TSNAs,对健康威胁很大。
TSNAs被细胞色素P450酶代谢活化是其致癌的重要前提[1]。实验研究发现很多P450 2A亚家族酶,比如人体P450 2A6和2A13[8-10]、大鼠P450 2A3[11],都能有效催化NNK和NNN代谢活化。一般而言,TSNAs的致癌性源于P450酶催化的α-羟基化路径,主要发生在N-亚硝基基团邻位的2个α-碳位点上。P450先催化TSNAs转化成羟基化中间体,然后再经过分子内的分解反应形成高亲电活性的重氮氢氧化物及其他可能的代谢物。比如,NNN代谢可形成4-(3-吡啶基)-4-氧代-丁烷-重氮氢氧化物和4-(3-吡啶基)-4-重氮氢氧基-丁醛2种代谢产物[10,12]。重氮氢氧化物很不稳定,能与DNA反应形成多种加合物,导致DNA受损,进而诱发癌症。近年来,P450酶代谢活化NNK和NNN的反应机理以及代谢物的遗传毒性已经被广泛研究并且取得了重要进展,但NAB和NAT在P450酶中的代谢活化研究却鲜有报道,潜在代谢物与DNA作用的加合物也没有被检测。Liu等[13-14]发现NAT和NAB均可竞争性抑制P450 2A13酶催化的NNK和NNN代谢,但是抑制机理并不明确。早期的实验研究发现吸烟者尿液中解毒的吡啶氮氧化物占了NAB总剂量的25%~30%,而α-羟基化产物的占比小于10%;相比之下,尿液中NNN的吡啶氮氧化物占比6%~11%,而α-羟基化产物占37%[1]。该结果有效解释了NAB致癌活性低于NNN的原因,且暗示了NAB在P450酶中的可能代谢路径。NAB和NAT的双环和手性结构特征与NNN很相似,它们在P450酶中的代谢路径是否也与NNN类似?反应的动力学和毒理学相关性以及反应的机理细节如何?哪一条羟基化路径主导了它们的代谢命运?这些问题仍有待探讨。虽然NAB和NAT是弱致癌物,但是研究它们在P450酶中的活化机制对于我们系统认知TSNAs的代谢路径及致癌机理都有一定的帮助。

图1 4种烟草特异性亚硝胺(TSNAs)的分子结构示意图Fig. 1 Chemical structures of four tobacco-specific nitrosamines (TSNAs)
近年来,量子化学计算已经被广泛且成功地应用于研究P450酶与各种外源性有机化合物之间的相互作用[15-19],为我们的研究提供了良好的理论基础。在本文中,我们使用密度泛函理论(DFT)计算系统研究并比较了P450酶催化的NAT和NAB α-羟基化路径,明确了反应的机理细节及能量关系。该研究结果有助于系统理解NAT和NAB的代谢过程以综合评价不同TSNAs的致癌潜力,并有助于识别潜在的生物标志物用于合理评估这2种烟草特异性亚硝胺暴露的健康风险。
1 计算细节(Computational details)
1.1 计算模型

1.2 密度泛函理论(DFT)计算
本文中所有的DFT计算都由Gaussian 09软件包完成[25]。分子构型优化使用杂化B3LYP泛函[26-27],其中Fe原子使用LANL2DZ赝势基组[28],而其他原子用6-31G(d,p)基组计算[29]。选择B3LYP泛函是因为即使与最精确的基准CCSDT(Q)方法相对比,它也能很准确地预测Fe-卟啉复合物的不同自旋态能量以及反应路径的相对能量关系[30-31]。通过频率计算获取优化构型的Gibbs自由能校正值,并验证优化构型的合理性,其中过渡态鞍点有且只有一个虚频,而局域最小点无虚频。为了获取更精确的能量数据,在优化构型的基础上使用更高水平的Wacthers+f (Fe原子)和6-311++G(d,p) (其他原子)基组进行单点能计算[32-34]。使用SMD溶剂化模型及非极性的氯苯溶剂(介电常数为5.62)对真实的P450酶环境进行隐性模拟[35]。此外,在单点能计算时引入半经验的色散校正以弥补B3LYP泛函不能准确描述长程色散效应的缺陷[36]。因此,本文报道的最终能量数据为相对自由能,其综合考虑了单点能、溶剂化效应、色散效应及Gibbs自由能校正。

图2 密度泛函理论(DFT)计算中使用的Cpd I模型及底物NAB和NATFig. 2 Simple Cpd I model and substrates NAB and NAT used in the present density functional theory (DFT) calculations
2 结果(Results)
2.1 Cpd I催化的N’-亚硝基新烟草碱(NAT)致癌活化

NAT 2-羟基化路径的LS态相对自由能剖面见图3。TS2-H为优化的氢原子夺取反应的过渡态,其中Fe···O距离为1.72 Å,O···H距离为1.23 Å,而C2···H距离为1.33 Å。在优化的中间体IM2-H中,Fe···OH距离进一步拉伸到1.85 Å。计算表明,氢夺取能垒为21.6 kcal·mol-1,而IM2-H的形成会放出4.3 kcal·mol-1的能量,有利于随后的羟基自由基转移。实际上,从FeIV—OH到Cα自由基的羟基转移是一个无能垒的过程,而且IM2-OH中间体的形成伴随着剧烈的放热(-40.2 kcal·mol-1)。尽管IM2-OH表现出相对高的热力学稳定性,但是其独特的结构特征能诱导其自发的分子内分解反应,即—OH转移一个质子给—NO基团,同时C2—N1键断裂,形成产物P2-DiazoOH。TS2-DiazoOH为自发分解反应的过渡态,其中C2···N1距离伸长到1.82 Å,同时O···H伸长到1.44 Å,而Fe···O距离从IM2-OH中的2.73 Å进一步缩短到2.28 Å,表明FeIII-卟啉的存在有助于该反应的发生。相对于IM2-OH,分解反应的能垒为14.1 kcal·mol-1,小于初始的氢夺取能垒(21.6 kcal·mol-1);而P2-DiazoOH形成则需要吸收2.4 kcal·mol-1的热量。此外,在整个2-羟基化路径中,氢夺取反应的能垒最高,是该路径的决速步骤,且IM2-OH和P2-DiazoOH都是该路径潜在的酶催化代谢物。

图3 NAT 2-羟基化路径的二重自旋态能量剖面图及优化的分子构型注:图中能量数据相对于反应复合物(Cpd I + NAT)给出,能量单位为kcal·mol-1,距离单位为Å。TS2-H为氢原子夺取过渡态,IM2-H为C2-自由基中间体,IM2-OH为2-羟基化NAT中间体,TS2-DiazoOH为分解反应过渡态,P2-DiazoOH为产物复合物。Fig. 3 Free energy profile for NAT 2-hydroxylaiton pathway catalyzed by Cpd I of P450, along with the optimized geometries of key reaction species in the doublet-spin stateNote: Free energies (kcal·mol-1) are relative to the reactant complex (Cpd I + NAT), and the distances are given in Å. TS2-H is transition state of hydrogen atom abstraction; IM2-H is C2-radical intermediate; IM2-OH is 2-hydroxyNAT intermediate; TS2-DiazoOH is transition state of decomposition; P2-DiazoOH is product complex.

2.2 Cpd I催化的N’-亚硝基假木贼碱(NAB)致癌活化


图4 NAT 6-羟基化路径的二重自旋态能量剖面图及优化的分子构型注:能量数据相对于反应复合物(Cpd I + NAT)给出,能量单位为kcal·mol-1,距离单位为Å。TS6-H为氢原子夺取过渡态,IM6-H为C6-自由基中间体,IM6-OH为6-羟基化NAT中间体,TS6-DiazoOH为分解反应过渡态,P6-DiazoOH为产物复合物。Fig. 4 Free energy profile for NAT 6-hydroxylaiton pathway catalyzed by Cpd I of P450, along with the optimized geometries of key reaction species in the doublet-spin stateNote: Free energies (kcal·mol-1) are relative to the reactant complex (Cpd I + NAT), and the distances are given in Å. TS6-H is transition state of hydrogen atom abstraction; IM6-H is C6-radical intermediate; IM6-OH is 6-hydroxyNAT intermediate; TS6-DiazoOH is transition state of decomposition; P6-DiazoOH is product complex.
NAB 2’-羟基化路径的相对自由能剖面见图5,其中氢夺取反应的过渡态标记为TS’2-H以区别于NAT的TS2-H,相应形成的自由基中间体标记为IM’2-H。计算的氢夺取能垒为12.7 kcal·mol-1,放出的热量为13.7 kcal·mol-1。随后的OH转移形成稳定2’-羟基化NAB中间体IM’2-OH同样是剧烈放热的过程,放出约48 kcal·mol-1的热量。2’-羟基化NAB进一步经过分子内分解过渡态TS’2-DiazoOH(能垒为15.8 kcal·mol-1)形成略微吸热的重氮羟基化代谢产物P’2-DiazoOH。
对于NAB 6’-羟基化路径(见图6),氢夺取能垒为12.9 kcal·mol-1,与2’-羟基化路径的氢夺取能垒(12.7 kcal·mol-1)几乎相等;而6’-羟基化NAB中间体(IM’6-OH)的自发分解能垒为20.1 kcal·mol-1,明显高于2’-羟基化NAB的分解能垒(15.8 kcal·mol-1)。该结果表明,Cpd I催化的2’-羟基化路径在动力学上比6’-羟基化路径更容易发生,即P450酶催化的2’-羟基化路径有可能主导了NAB的致癌潜力。事实上,α-羟基化NAB中间体和重氮氢氧化产物的相对能垒相差不大,具有相似的热力学稳定性,因此它们都是NAB α-羟基化路径的潜在代谢产物。
3 讨论(Discussion)
烟草特异性亚硝胺NAT和NAB的致癌活性小于NNK和NNN,因此其在P450酶中的代谢活化并未被深入研究。到目前为止,仅有一个早期的实验报道了NAB 2’-羟基化和6’-羟基化反应的可能性,但相关代谢物与DNA作用的加合物也未被检测[37],这在一定程度上不利于我们真实客观地理解这2种污染物的代谢机制及致癌活性。因此,本文基于量子化学计算系统研究了P450酶催化NAT和NAB代谢活化的分子机制(图7),定量了致癌的α-羟基化活化路径的能垒和热力学信息。计算表明,NAT和NAB的α-羟基化路径相似,均包括以下基元反应步骤:(1) 氢原子夺取,形成Cα自由基中间体;(2) 无能垒的OH转移,形成剧烈放热的α-羟基化中间体;(3) 自发的α-羟基化中间体分子内分解,形成最终有致癌潜力的重氮氢氧化物。进一步比较NAT 2-羟基化和6-羟基化路径发现,虽然前者的氢夺取能垒高于后者(21.6 vs 17.9 kcal·mol-1),但前者的羟基化中间体的自发分解能垒更低(14.1 vs 18.6 kcal·mol-1),表明P450酶催化的NAT 2-羟基化和6-羟基化反应都是潜在的致癌路径,且在动力学上可能相互竞争。
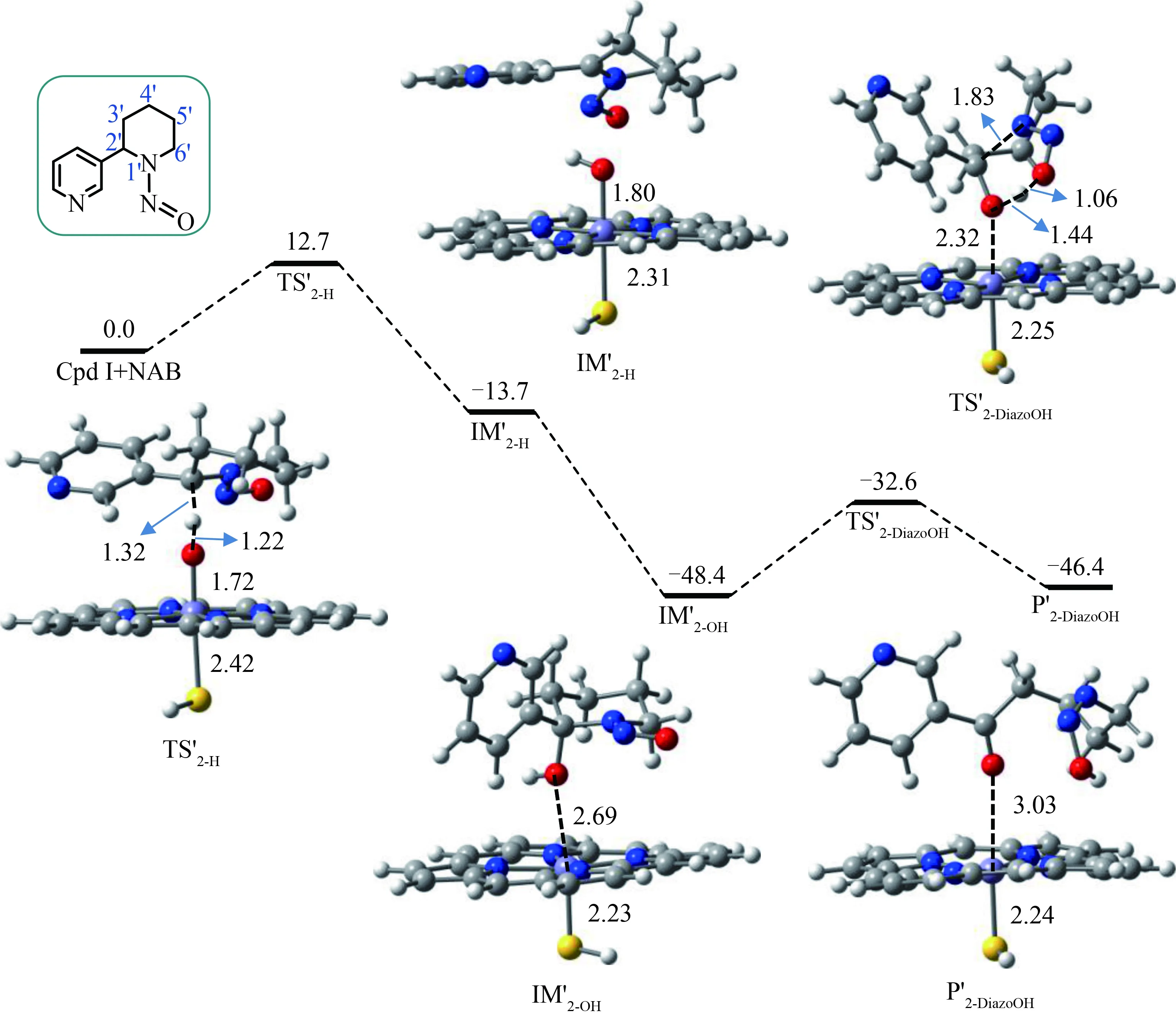
图5 NAB 2’-羟基化路径的二重自旋态能量剖面图及优化的分子构型注:其中能量数据相对于反应复合物(Cpd I + NAB)给出,能量单位为kcal·mol-1,距离单位为Å。TS’2-H为氢原子夺取过渡态,IM’2-H为C’2-自由基中间体,IM’2-OH为2’-羟基化NAB中间体,TS’2-DiazoOH为分解反应过渡态,P’2-DiazoOH为产物复合物。Fig. 5 Free energy profile for NAB 2’-hydroxylaiton pathway catalyzed by Cpd I of P450, along with the optimized geometries of key reaction species in the doublet-spin stateNote: Free energies (kcal·mol-1) are relative to the reactant complex (Cpd I + NAB), and the distances are given in Å. TS’2-H is transition state of hydrogen atom abstraction; IM’2-H is C’2-radical intermediate; IM’2-OH is 2’-hydroxyNAB intermediate; TS’2-DiazoOH is transition state of decomposition, and P’2-DiazoOH is product complex.

图6 NAB 6’-羟基化路径的二重自旋态能量剖面图及优化的分子构型注:其中能量数据相对于反应复合物(Cpd I + NAB)给出,能量单位为kcal·mol-1,距离单位为Å。TS’6-H为氢原子夺取过渡态,IM’6-H为C’6-自由基中间体,IM’6-OH为6’-羟基化NAB中间体,TS’6-DiazoOH为分解反应过渡态,P’6-DiazoOH为产物复合物。Fig. 6 Free energy profile for NAB 6’-hydroxylaiton pathway catalyzed by Cpd I of P450, along with the optimized geometries of key reaction species in the doublet-spin stateNote: Free energies (kcal·mol-1) are relative to the reactant complex (Cpd I + NAB), and the distances are given in Å. TS’6-H is transition state of hydrogen atom abstraction, IM’6-H is C’6-radical intermediate, IM’6-OH is 6’-hydroxyNAB intermediate, TS’6-DiazoOH is transition state of decomposition, and P’6-DiazoOH is product complex.
NAB α-羟基化路径中氢夺取能垒为12.7~12.9 kcal·mol-1,α-羟基化中间体分解能垒为15.8~20.1 kcal·mol-1。此外,尽管2’-羟基化和6’-羟基化路径的氢夺取能垒几乎相等,但前者的羟基化中间体分解能垒更低,表明2’-羟基化路径是NAB的主要致癌路径。进一步比较NAT和NAB的活化路径发现,NAT的氢夺取能垒远高于NAB,而前者的分解能垒只是略小于后者,因此NAB在P450酶中的代谢活性应该更高,即NAB的致癌活性可能略高于NAT。此外,计算表明α-羟基化NAT和NAB中间体与相应的重氮氢氧化代谢产物具有相似的热力学稳定性,且自发分解反应的相对能垒也较高(大于14 kcal·mol-1),因此α-羟基化中间体和重氮氢氧化物都是潜在的P450酶催化代谢产物。事实上,重氮氢氧化物不仅可能与DNA反应形成多种DNA加合物,也可能会进一步水解成低毒性甚至无毒性的醇类化合物。因此,相关的DNA加合物、醇类水解物以及α-羟基化中间体都可以作为潜在的生物标志物用以评估NAT和NAB在P450酶中的活化潜力及人体暴露的健康风险。

图7 P450酶催化的NAT和NAB α-羟基化致癌路径Fig. 7 P450-catalyzed genotoxic α-hydroxylation routes for NAT and NAB
另外2种具有更强致癌活性的烟草特异性亚硝胺NNK和NNN以及其他常见亚硝胺如N-亚硝基吡咯烷(N-nitrosopyrrolidine, NPYR)和N-亚硝基哌啶(N-nitrosopiperidine, NPIP)等具有与NAT和NAB相似的活性亚硝胺基团,因此理论上它们具有相似的致癌活化路径。我们基于DFT计算已经系统研究了P450酶催化NNN代谢活化的分子机制[15],再结合本文的研究结果,我们进一步证实P450酶催化的2种α-羟基化路径是亚硝胺类化合物发挥其致癌活性的重要前提。此外,本文的研究结果也可为其他亚硝胺类致癌物的酶催化代谢活化研究提供一定的理论指导。

