溴系阻燃剂毒理效应的计算模拟预测与环境风险评估进展
李斐,王晓晴,3,刘佳琳,孟祥敬,3,吉成龙,2,吴惠丰,2,*
1. 中国科学院环境过程与生态修复重点实验室,中国科学院烟台海岸带研究所,烟台 264003 2. 青岛海洋科学与技术国家实验室,海洋渔业科学与食物产出过程功能实验室,青岛 266237 3. 中国科学院大学,北京 100049
污染物的理化性质、环境行为及其生物毒性数据,是进行生态风险评价的基础。但目前,全球合成化学品的数量日益增加,仅日常使用的10万多种合成化学品中,超过80%的化学品缺乏相关环境安全数据[1]。通过实验测试获得所有相关信息,需要消耗大量的费用和时间,难以满足生态风险评价的需求。鉴于此,计算毒理学在估算污染物的环境浓度、分析毒性数据、筛选有毒化合物以及评估化合物的生态风险中,发挥着重要的作用[1-3]。其中,分子对接(molecular docking)、分子动力学(molecular dynamics, MD)模拟[4]、量子化学计算和定量结构-活性相关模型(quantitative structure-activity relationship, QSAR)[5]等技术在模拟有机污染物与生物分子的结合模式、研究分子间的相互作用并揭示污染物的毒性作用机制等方面得到较为广泛的应用[3,6]。
溴系阻燃剂(BFRs)因其阻燃效果优良、适用范围广泛和稳定性强等优点,在阻燃剂领域得到了广泛应用。BFRs已在各种环境介质(大气[7-10]、水体[11-14]、土壤[15-18]和沉积物[19]等)和生物体内[20-27]被广泛检出,其中部分BFRs具有持久性有机污染物(persistent organic pollutants, POPs)特征,如高毒难降解、环境持久、易于生物积累和放大等,使得BFRs的毒性效应和生态风险得到人们的广泛关注。大量动物实验和流行病学研究发现,BFRs具有神经发育毒性[28-29]、遗传毒性[30-32]和内分泌干扰效应[33-34]等毒性影响。因此,综合评估BFRs的生态和健康风险显得极为必要。目前,多溴联苯醚(PBDEs)作为使用量巨大的典型BFRs之一,广泛地存在于生物体和非生物环境中,因其环境持久性和生物累积性,已被斯德哥尔摩公约列为需要控制使用的对象[35]。本文基于近年来关于计算毒理学和流行病学的相关研究,重点阐述了影响PBDEs环境转化和毒性作用的分子机制(图1),为评估BFRs的环境健康风险,确定未来研究和发展的方向提供参考。

图1 溴系阻燃剂(BFRs)的环境行为和毒性效应Fig. 1 Environmental behavior and toxic effect of brominated flame retardants (BFRs)
1 环境行为(Environmental behavior)
污染物在环境介质中的迁移转化过程十分复杂,包括在环境中的挥发、光解和水解等物理化学转化过程。反应的影响因子主要包括污染物自身的结构和环境介质组分等。PBDEs的结构改变会显著影响其自身的毒性效应,溴取代基的数量和代谢产物均可影响PBDEs的毒性[36-37]。高溴代的PBDEs在环境中不稳定,易发生光解脱溴反应降解为低溴代的PBDEs。PBDEs与羟基自由基反应,生成毒性更强的羟基多溴联苯醚(HO-PBDEs)[38]。光解和羟基化反应显著增强了PBDEs的生物富集能力和环境持久性。因此,研究PBDEs的脱溴/羟基化反应过程,可为PBDEs在环境中的转化和归趋提供参考。
曹海杰[36]通过量子化学计算六溴环十二烷、2,2’,4,4’,5-五溴联苯醚(BDE-99)及四溴双酚A(TBBPA)等与羟基自由基的反应发现,溴取代程度的高低影响了BFRs与羟基自由基的反应趋势。Wei等[39]研究了13种PBDEs在己烷中的光解脱溴过程,利用基于最小二乘原理建立了随机反应序列(SRS)模型来模拟PBDEs的脱溴过程,该模型能够推测脱溴途径并确定影响脱溴稳定性的溴取代特征。Zou等[40]进一步以十溴联苯醚(BDE-209)作为初始反应物,通过类似马尔可夫链蒙特卡罗算法(Analogue Markov Chain Monte Carlo, AMCMC)算法优化了PBDEs的脱溴曲线,确定并量化了PBDEs光解脱溴的反应过程。AMCMC模型表明,在BDE-209光解的初始阶段主要通过断裂邻位和对位溴取代基的化学键生成2,2’,3,3’,4,4’,5,5’,6-九溴联苯醚(BDE-206)和2,2’,3,3’,4,5,5’,6,6’-九溴联苯醚(BDE-208)。随着反应的进行,间位溴键的断裂在光解反应中逐渐占据主导地位。该研究比较了AMCMC模型和SRS模型,发现AMCMC模型比SRS模型更为稳健高效,更能准确推断出脱溴反应途径,计算出低溴代PBDEs的产率。
溴取代程度高的PBDEs通过脱溴反应可生成低溴代联苯醚2,4,4’-三溴联苯醚(BDE-28)和4,4’-二溴联苯醚(BDE-15)等,进而释放到环境中。研究人员通过量子化学的方法进一步分析了脱溴后产物的环境行为。Cao等[37]比较了空气和水环境中BDE-28与羟基自由基之间反应的能垒图,发现水环境增加了反应的能垒,不利于反应的进行。不仅环境介质对反应造成影响,溴原子的数量也影响PBDEs的降解速率。将计算得到BDE-28和羟基自由基的反应速率常数同2,4-二溴联苯醚(BDE-7)、BDE-15、2,2’,4,4’-四溴联苯醚(BDE-47)和羟基自由基的反应速率常数进行比较发现,PBDEs中溴原子的数目会影响反应中羟基自由基与PBDEs的反应活性。溴原子数目越多,PBDEs中苯环的反应活性越低,越不容易发生降解反应。此外,Zhou等[38]通过量子化学计算研究了BDE-15与羟基自由基反应的降解机制和动力学。如图2所示,该反应存在加成反应和夺氢反应2种生成HO-PBDEs的途径,其中以加成反应为主。在反应过程中,溴原子会钝化邻位碳原子的活性,使其不易与羟基自由基发生加成反应。
2 毒性效应(Toxic effect)
2.1 细胞毒性
Rawat和Bruce[41]通过体外细胞毒性实验获得与细胞活力、细胞凋亡等相关的实验数据,并对数据进行定量评估。以遗传算法(GFA)为基础建立QSAR模型,预测哺乳动物细胞(HepG2)暴露于PBDEs对细胞的毒性以及对细胞活力和细胞凋亡的影响。将细胞毒性、氧化应激压力和细胞凋亡相关的3组数据建立了10个QSAR模型,从中选取能够代表3个毒性终点、具有良好解释能力和拟合优度的模型,具体QSAR模型如下:
log_Toxicity = -9.03 × 10-1- 2.06 × Gasteiger_Charges + 7.37×10-3VSA_AtomicAreas
+ 5.22×10-3VSA_PartialCharge
(1)
log_OS = -1.37 + 1.10 × ALogP_AtomScore + 13.7 × Gasteiger_Charges
(2)
log_Apoptosis = 7.50-1.90 × 10-1ALogP_AtomMRScore -1.98 × Kappa_3 + 1.48 × 10-2VSA_PartialCharge
(3)
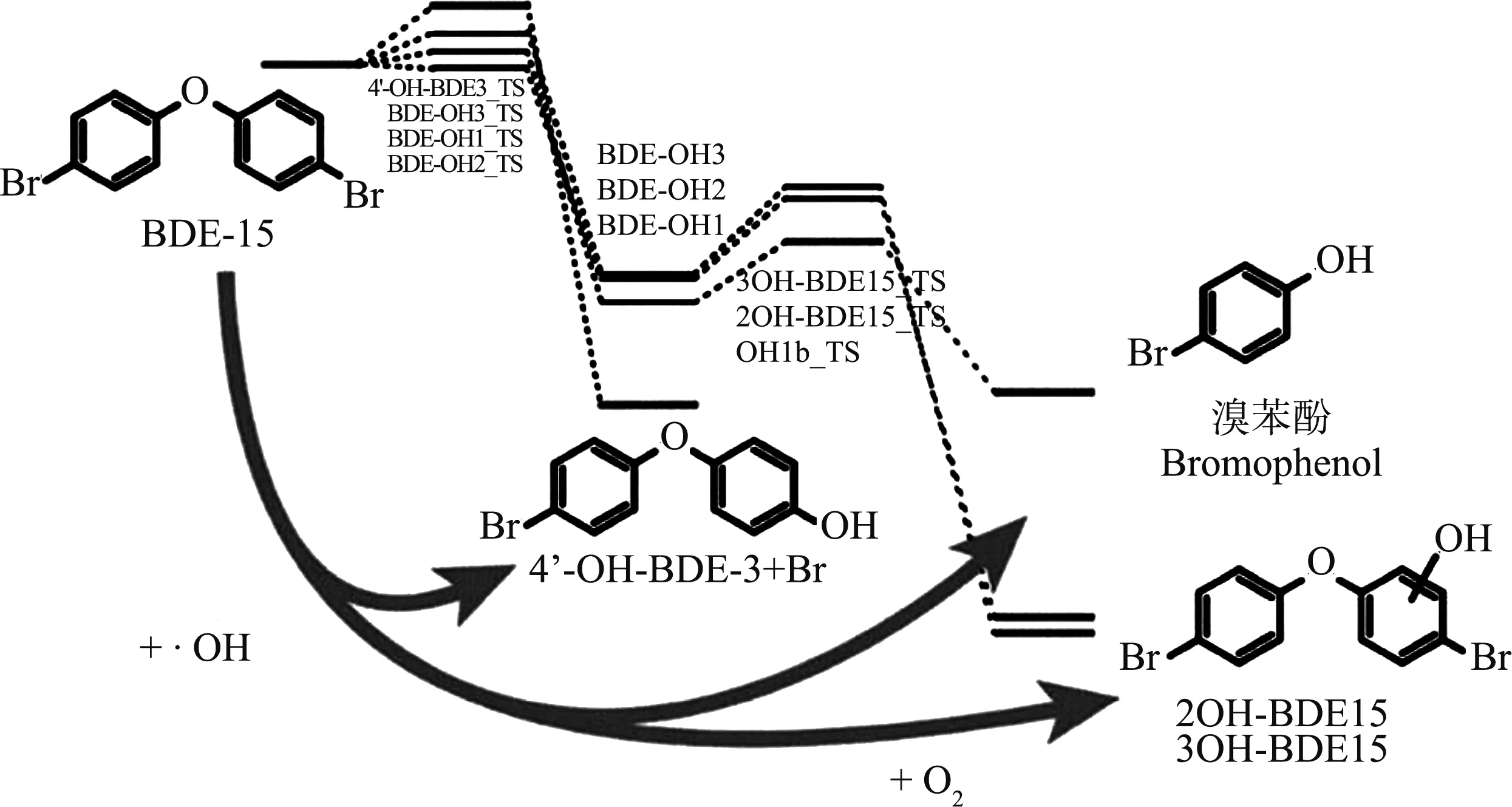
图2 BDE-15与羟基自由基的反应途径注:图片编译自文献[38]。Fig. 2 Reaction pathway of BDE-15 with hydroxyl radicalsNote: modified after reference [38].
式中:Gastieger_Charges是基于原子的特性,用于表征每个原子在鲍林的尺度上计算的电荷。VSA_AtomicAreas和VSA_PartialCharge属于表征范德华表面积(VSA)类的描述符。VSA_AtomicAreas的大小用于衡量每个原子对分子总表面积的贡献程度,VSA_PartialCharge是基于原子部分电荷计算得到的分子表面积。ALogP_AtomScore和ALogP_AtomMRScore属于ALogP分子描述符家族。ALogP表征生物对化学物质的利用度和组织对异生物质的吸收程度,用于预测细胞毒性终点。Kappa_3是描述分子结构大小的二维描述符,用于量化分子的拓扑结构。
2.2 生物酶活
杨伟华等[42]采用分子对接研究了PBDEs衍生物包括HO-PBDEs和甲氧基多溴联苯醚(MeO-PBDEs)与人胎盘芳香化酶的结合构象。构象分析发现相较于MeO-PBDEs,HO-PBDEs中的羟基能够与Arg435、Arg115、Arg375、Asp309和Ala306等氨基酸残基形成氢键从而产生活性抑制作用,推测氢键可能是PBDEs衍生物抑制芳香化酶活性的结构基础。Butt和Stapleton[43]通过分子对接研究HO-PBDEs与甲状腺素磺酸基转移酶(SULT1A1)间的结合作用,发现溴取代基的数量和位置影响HO-PBDEs与SULT1A1间氢键的形成,具体的作用机制有待进一步探索。Wang等[44]通过分析紫外-可见光谱和荧光光谱中特征吸收峰的强度、宽度和位移程度来研究BDE-47、BDE-209和乙酰胆碱酯酶(AchE)间相互作用的机制,发现BDE-47和BDE-209改变了AchE残基的微环境和构象,从而对AchE的活性产生抑制作用,引起神经毒性。通过比较BDE-47、BDE-209与AchE在相同温度下的结合常数和配体-受体间的生物活性构象,发现BDE-47与AchE的结合力强于BDE-209,并且BDE-47更接近于AchE的天然配体的空间位置。综合结合力和空间构象分析发现,BDE-47更易于通过疏水作用与AchE结合增加神经毒性风险。
2.3 载体与转运蛋白
载体和转运蛋白在机体的生物化学反应中发挥重要作用[45-52]。人血清白蛋白(human serum albumin, HSA)作为人体重要的载体蛋白,研究PBDEs及其代谢产物与HSA的结合作用机制,对了解PBDEs毒性作用机制具有重要意义。Yang等[48]通过荧光光谱法和圆二色谱(circular dichroic, CD)法发现了HO-PBDEs(3-HO-BDE-47、5-HO-BDE-47和6-HO-BDE-47)能与HSA通过疏水作用和氢键作用形成络合物,进而改变HSA构象中α螺旋和β折叠的含量。通过分子动力学模拟和泊松-波尔兹曼表面分析(MM-PBSA)计算结合自由能,发现Arg257、Arg218、lle290、Ala291、lys199和Glu292等氨基酸残基在3种HO-PBDEs与HSA结合形成复合物的过程中发挥着重要作用。通过研究HO-PBDEs与HSA之间的结合亲和力,从而推测出污染物在结合位点的浓度和残留时间。
Wang等[49]通过热力学研究发现,疏水作用在十溴联苯醚和TBBPA与HSA的结合中发挥重要作用。通过光谱分析和分子对接研究发现,两者与HSA的结合位点和结合亲和力不同。十溴联苯醚与HSA最可能的结合位点是亚结构域IB,而TBBPA的结合位点则位于靠近亚结构域IIA和Trp-214残基的HSA中心,TBBPA与HSA的结合能力强于十溴联苯醚与HSA的结合能力。不同的结合作用影响了HSA的二级结构,进而影响机体相应的生化过程。Tan等[50]通过分子对接进一步研究了影响PBDEs(BDE-47、BDE-99、2,2’,4,4’,6-五溴联苯醚(BDE-100)、2,2’,4,4’,5,5’-六溴联苯醚(BDE-153)和BDE-209)与HSA残基结合的因素。结果显示,PBDEs中溴原子取代基的数量会影响其与HSA的结合构象、结合位点和结合能力。溴取代基数量越少,PBDEs与HSA残基形成复合物后构型变化越大。以溴取代基数量最少的BDE-47为例,BDE-47与HSA的Ser202残基间形成H键,与其他氨基酸残基Trp214、Phe211、Leu347和Pha206通过分子内化学键和静电作用影响构型。随着溴原子数量的增加,PBDEs与HSA残基形成H键后构型变化较小。此外,仅相差一个溴原子取代基(BDE-47和BDE-99)或者互为同分异构体(BDE-99和BDE-100)的PBDEs与HSA残基结合位点相近。而BDE-153由于受6个溴原子取代基的影响,与HSA残基结合位点和其他PBDEs不同。除BDE-209外,PBDEs与H的结合能随着分子量的增加而增大。
Cao等[51]通过分子动力学模拟研究发现,溴取代基的数量是影响HO-PBDEs与甲状腺素转运蛋白(TTR)和甲状腺素结合球蛋白(TBG)结合的关键因素;并通过QSAR模型预测了HO-PBDEs和TTR/TBG间的结合亲和力,用于评估HO-PBDEs与甲状腺激素转运蛋白的竞争性结合。Cao等[52]进一步通过分子对接和分子动力学模拟研究了2种PBDEs的代谢物(硫酸化多溴联苯醚和HO-PBDEs)与TTR的结合亲和力以及结合程度对TTR结构稳定性的影响。研究发现,硫酸化多溴联苯醚对TTR的结合亲和力高于相应的HO-PBDEs。通过分子动力学模拟进一步分析结构特征表明,TTR与PBDEs代谢物结合后的稳定性增强,可能降低了四聚体蛋白质结构的解离速率。通过计算结合自由能发现范德华相互作用是PBDEs代谢物在TTR的甲状腺素(T4)位点处结合的关键作用力。
2.4 激素受体
PBDEs及其代谢产物能够激活或抑制相关激素受体包括芳香烃受体(AhR)[53-54]、孕烷X受体(PXR)[55]、甲状腺激素受体(TR)[45-47,56-57]、雄激素受体(AR)[58-60]和雌激素受体(ER)[61-63]等介导的信号转导。除此之外,PBDEs亦能够通过作用于相关的载体蛋白,进而引起内分泌干扰效应。Li等[53]通过分子对接分析发现,氢键和疏水相互作用是PBDEs和AhR结合的主要驱动力,不同的结构特征会影响PBDEs的活性大小进而影响其与AhR结合亲和力。通过比较分子相似性指数分析(CoMSIA)建立3D-QSAR模型,更好地解释了PBDEs的毒性作用机制。Gu等[54]通过3D-QSAR模型研究发现,PBDEs邻位和间位取代基的空间效应和疏水作用显著影响了AhR与PBDEs的结合亲和力。Zhang等[55]通过实时荧光定量PCR技术和相关基因的转录谱研究,确定了BDE-99对斑马鱼AhR2和PXR具有显著影响,并通过分子动力学和分子对接研究了BDE-99与AhR2 LBD的结合模式,发现氢键是BDE-99与AhR2形成稳定复合结构的关键,而π-π堆积作用和疏水作用是稳定BDE-99与PXR复合结构的关键。
Li等[56]通过分子对接比较了HO-PBDEs对甲状腺激素的干扰效应。通过研究成键和非键相互作用,推测氢键作用会影响HO-PBDEs与TRβ-LBD的结合。基于机理筛选分子描述符,建立QSAR模型表征了HO-PBDEs与TRβ-LBD间的相互作用。Li等[57]采用CoMSIA方法研究发现,静电作用和氢键是影响HO-PBDEs与TRβ-LBD相互作用的关键。Harju等[58]通过综合风险评估(FIRE)体外筛查程序构建数据集,利用偏最小二乘方法建立了基于雄激素拮抗作用和代谢降解率的QSAR模型,评估了BFRs的内分泌干扰效力和降解效率。研究表明,溴取代基的数量和顺序影响PBDEs的代谢降解速率,在邻位且间位/对位没有取代基的低溴代的PBDEs自身的代谢降解速率更快,与AR的结合能力更强,干扰潜力更大。通过模型预测发现了BDE-17具有强的雄激素拮抗效用,而2,3’,4,4’-四溴联苯醚(BDE-66)的拮抗作用较弱。Li等[61]通过表面等离子体共振技术研究发现,22种不同溴取代程度的HO-PBDEs与雌激素受体(ERα)的结合亲和力存在差异。分子对接发现了低溴代和高溴代的HO-PBDEs与ERα-LBD的结合方式完全不同,推测不同的溴代程度通过影响HO-PBDEs的分子大小进而造成不同程度的雌激素干扰效应,低溴化HO-PBDEs表现出雌激素活性,而高溴化HO-PBDEs表现出抑制雌激素活性。
2.5 基因
部分BFRs会影响神经发育和肿瘤相关的基因表达[64-65]。吴惠丰等[65]通过分子对接和动力学模拟研究BDE-47与p53-DNA间复合物的结合构象和相互作用方式,发现BDE-47主要通过的π-π堆积作用以沟槽方式结合p53-DNA。Wang等[64]通过基因转录谱图和蛋白免疫印迹实验发现,五溴联苯醚混合物(DE-71)及同系物能降低斑马鱼幼鱼中参与神经发育的相关基因(fgf8、shha和wnt1)和神经元形态发育相关的蛋白(髓鞘碱性蛋白MBP、突触蛋白IIa SYN2a)的表达量,造成斑马鱼胚胎的神经发育受损。通过分子对接计算了DE-71及其同系物与纤维细胞生长因子(FGF8)和羟基色胺受体(HTR1B)的结合能。通过分析结合模式图发现,水分子、氧原子与相关的氨基酸残基间形成氢键使得2,2’,4,4’,5,6’-六溴联苯醚(BDE-154)与FGF8复合物间具有高的结合能力,而BDE-47与HTR1B复合物间的结合主要是π-π键的堆积作用、π-阳极作用和范德华作用。
3 风险评估(Risk assessment)
在计算毒理学研究典型BFRs的环境转化行为和毒性作用机制的基础上,结合BFRs对生物体的毒性数据和流行病学的相关研究,可评估BFRs的环境健康风险。由于BFRs广泛分布于各种环境介质和生物体内,为了全面评估BFRs的环境风险,获得用于开发标准测试方法和污染物管理的毒性数据,应综合考虑BFRs单独暴露和联合暴露时的毒性效应,从生态风险和健康风险2个方面进行全面评估。
3.1 生态风险评估
评估水体中PBDEs的浓度对水生生物的生态风险,采用预测的无影响浓度(PNEC)和阻燃剂水体浓度的风险商值(RQ)对英国艾尔河的生态风险进行评估,发现污水中PBDEs对靠近工业和城市污水排放地点的藻类(RQ:3.3~57)、水蚤(RQ:3.6~62)和鱼类(RQ:3.8~65)存在不利影响[66]。同时利用PBDEs的生物浓缩系数(BCF)作为毒性终点构建的数据集,通过遗传算法(GA)选择最佳统计数据模型,评估PBDEs在水生生态系统中的生物积累,为PBDEs的生态风险评估和环境风险提供理论数据支持[67]。
研究发现,不仅需要关注水体中PBDEs造成的生态风险,水体沉积物中PBDEs的生态风险也不可忽视。Ju等[19]利用气相色谱-质谱(GC-MS)分析胶州湾及临近地区表层沉积物中PBDEs的种类、浓度及分布状况,发现了胶州湾中的14种PBDEs的平均浓度为7.48 ng·g-1,胶州湾湾内和东海岸沉积物中的PBDEs污染较为严重,污染状况高于我国其他海域,对鱼类摄食造成危害,具有潜在的生态风险。除了关注水体和沉积物中BFRs造成的生态风险,道路粉尘(RD)中BFRs的生态风险也引起了人们的重视。Cao等[68]研究发现RD中的BFRs浓度与交通密度成正相关,相较于主干道、街道和旁路,在交通路口的BFRs的浓度最高。该研究同时也证实,虽然在RD中检测到多种BFRs,如PBDEs、十溴二苯乙烷(DBDPE)、2-乙基己基-四溴苯甲酸(EH-TBB)和七溴苯(PBEB),但BFRs未达到对人体造成癌症风险的浓度。
目前,人们不仅关注材料使用过程中排放到环境中的BFRs的生态风险,BFRs在循环利用过程中的潜在风险也逐渐引起人们的重视。新材料在合成过程中可能使用包含BFRs的循环塑料,使得制造的产品中可能含有被禁用的BFRs。Guzzonato等[69]以26个从欧洲市场购买的玩具、与食品有接触的物品和废弃电气和电子设备(WEEE)作为研究样本,调查发现约2/3样品的检测结果呈现溴阳性,约有一半玩具中BFRs的含量超过了持久性污染物质含量的最低限值。
3.2 健康风险评估
韩涛[70]评估了土壤和道路灰尘中的六溴环十二烷对人体暴露的健康风险,发现不同的暴露途径(非饮食接触、呼吸和皮肤暴露)会影响人体摄入六溴环十二烷的量,其中通过非饮食暴露的摄入量高于其他2种暴露途径。此外,基于膳食暴露对健康风险进行评估表明,在日常饮食的肉类及肉制品中检出BFRs[71],同时在人体的血清[20-21]和母体乳汁[22-24]中也检测到PBDEs和TBBPA等。关于BFRs分布的研究发现,其在人体中浓度分布存在明显的地域差异。例如,五溴联苯醚和八溴联苯醚在澳大利亚人体中的浓度介于欧亚地区和北美地区人体浓度之间,BDE-47在澳大利亚及其海外的人体血液中浓度尤为突出[72-74]。
年龄的差异使得BFRs对人体的影响程度不同。婴幼儿正处于免疫和神经系统生长和发育的关键阶段,代谢能力较弱,无法代谢环境污染物,更容易受到环境暴露的不利影响[75]。基于儿童与环境相互作用方式和动态生理学的研究发现,在相同环境中儿童比成人具有更高的暴露浓度[75]和摄入量[70]。Toms等[76]研究发现,BFRs在儿童体内的浓度高出成人的4~5倍,对儿童健康造成潜在的不利影响。此外,Martin等[77]研究发现,1~3岁婴幼儿接触PBDEs的联合暴露量可能超过啮齿动物可接受的神经发育毒性的浓度剂量水平,造成早期神经发育毒性。
大量流行病学研究表明,人体暴露PBDEs与多种不利影响和疾病有关[78],主要包括生殖健康[79-82]、糖尿病[83-84]、神经发育障碍[28-29]、癌症[85-89]和内分泌干扰[33-34]等。母体血清中的PBDEs会增加受孕时间并降低受孕率[81]。Gao等[90]研究发现莱州湾地区(山东溴代阻燃剂的生产区)的妊娠期女性血清中PBDEs的浓度与女性生殖功能(月经周期、流产、妊娠时间、胎儿异常、妊娠并发症和早产等)呈现负相关关系,其中,2,2’,3,4,4’-五溴联苯醚(BDE-85)、BDE-153、2,2’,3,4,4’,5’,6-七溴联苯醚(BDE-183)会增加先兆性流产的风险,BDE-153会增加早产风险,BDE-28会延长妊娠时间。暴露PBDEs除了影响妊娠期女性的生殖功能外,还可能增加孕妇及胎儿患病的风险。母亲乳汁中较高浓度的PBDEs可能会引发子代男孩患隐睾症[30]。Meijer等[31]在2012年检测了55份母亲怀孕35周时血清样本中的PBDEs含量,同时在她们所产下的男婴3个月时检测6种生殖相关的激素含量,并在3个月和18个月时检测婴儿睾丸体积和阴茎长度。研究发现,BDE-154会下调雌二醇的分泌并减少游离雌二醇的含量,同时BDE-154对18个月男婴的睾丸体积产生不良影响。Goodyer等[32]研究发现,孕妇通过吸入或摄入空气中分布的PBDEs(BDE-99、BDE-100和BDE-154)会增加男性胎儿患隐睾症的风险,PBDEs的浓度增加10倍,患病的风险增加一倍以上。
其他相关调查研究还表明,母体脐带血中BDE-47浓度与儿童注意力呈负相关关系[91],电子垃圾拆解工人子女的阿普伽新生儿评分(Apgar Score)较低,并可导致死胎或无脑儿的发生[92]。Liu等[93]和Song等[94]通过巢式病例-对照研究探索了暴露PBDEs与妊娠期糖尿病(GDM)和胎儿宫内发育迟缓(IUGR)的相关性,利用气相色谱-质谱(GC-MS)测定了妊娠早期母体和脐带血血清中的PBDEs及同系物的类型及含量,将GC-MS的结果与筛查的患GDM和IUGR疾病状况相比较,发现暴露于PBDEs能够干扰孕妇体内葡萄糖平衡,增加患妊娠期糖尿病的风险,同时造成新生儿生长发育迟缓,增加患IUGR的风险。He等[85]通过病例对照研究了中国潮汕地区乳腺癌患者脂肪组织中的PBDEs浓度与乳腺癌发生风险间的关系。以手术期间测量的腹部样品和正常女性乳房脂肪组织的样品用于对照,通过乳腺癌病例的逻辑回归模型估计,发现患乳腺癌的风险与PBDEs及大多数同系物的浓度间存在正相关关系。Deodati等[34]通过流行病学研究PBDEs暴露与乳房早熟症(premature thelarche, PT)之间的关系,通过PBDEs在人体内的血清浓度、激素水平和人体测量学进行评估,发现女孩PT与血清中较高浓度的PBDEs有关。Meeker等[95]研究发现,男性暴露于含有BDE-47、BDE-99和BDE-100的室内粉尘中,会导致促黄体生成素与雄激素的水平的显著下调。
4 展望(Development of BFRs)
溴系阻燃剂凭借高阻燃性、热稳定性、分散性和价格低廉等特点得到广泛的应用。PBDEs、TBBPA作为使用最广泛的BFRs,在各种环境介质(大气、水、沉积物)、生物体及人体等中被广泛检出,并且使用量呈现逐年增长的趋势。鉴于环保方面的要求,基于BFRs被逐渐禁用的现状,为满足生产生活中对阻燃剂的需求,研发新型的阻燃剂迫在眉睫。
新型的阻燃剂应该同时满足高效的阻燃特性和低毒环保2个方面的要求,使产品在整个生命周期的过程中对环境和生物体的影响最小。新型的替代型阻燃剂主要发展方向和管理策略是:
(1)针对阻燃剂本身,要加强技术创新,研发和改进阻燃剂的应用配方,实现性能高效、热稳定性好、不易挥发、对生态环境和生物体具有较低毒性的高效阻燃剂;例如,在满足材料的加工和阻燃性能的情况下,研发超细化的无机阻燃剂,减少添加剂的投加量,改善阻燃性能;发展新型的复合型阻燃剂,实现阻燃剂的低卤化,在满足高效阻燃的同时,实现阻燃剂低毒、少烟的发展要求。以膨胀型阻燃剂为例,其在受热过程中能够在材料表面产生多孔碳层,从而隔绝氧气,使得内层高聚物不能进一步受热分解,从而实现阻燃效果;利用阻燃剂的协同阻燃特性,开发具有卤素、磷与硅协同,溴磷、溴氮协同的溴系阻燃剂,用于满足特定的应用条件(高温、紫外等);
(2)鉴于阻燃剂在使用过程中可能产生有毒气体和烟雾,开发研制含有表面活性剂和粘结剂的针对BFRs的抑烟剂和消烟剂,降低和消除阻燃剂在使用中产生的烟雾和有害气体的化合物;
(3)依据3R(Reduction, Replacement, Refinement)原则(减少使用、物尽其用、循环使用),实现阻燃剂低风险、低成本、高回收的再加工再利用;
(4)建立完善的监督和监管机制,实现阻燃剂从生产、使用到处理阶段的全过程管理,对在整个阻燃剂的生命周期进行科学的风险评估。
在发展新型替代型阻燃剂的同时,需要进一步对新型溴代阻燃剂的环境行为、毒性效应及其风险进行预测和评估。

