卤代有机污染物抑制甲状腺激素代谢酶活性的研究进展
耿利鸣,马广才,尉小旋,于海瀛
浙江师范大学地理与环境科学学院,金华 321004
卤代有机污染物(halogenated organic contaminants, HOCs)常作为原材料、中间体和溶剂等广泛应用于有机合成中,在人类生产和生活中发挥了重要作用,例如四溴双酚A(tetrabromobisphenol A, TBBPA)和多溴联苯醚(polybrominated diphenyl ethers, PBDEs)作为常用的溴代阻燃剂(brominated flame retardants, BFRs),广泛添加在电子产品和纺织品等日常用品中,也可以作为中间体合成其他复杂的阻燃剂[1-2]。该类化合物具有高毒性、高持久性、生物累积性、半挥发性和疏水性等性质,在生产和使用过程中,通过各种途径进入环境。近年来,HOCs的生态环境安全和健康效应受到了很多关注[3]。体外(in vitro)和体内(in vivo)实验表明,许多HOCs具有内分泌干扰效应,能够干扰人和动物的雌激素、甲状腺激素(thyroid hormones, THs)等内源性激素的体内平衡,引起健康问题[4-8]。特别是THs,作为生物体代谢、骨重塑、心脏功能和精神状态的调节剂,参与多种生理过程,对于正常的机体和智力发育至关重要[9-10]。本文简要介绍了HOCs影响THs功能的途径,在此基础上,重点综述了HOCs对参与THs代谢的生物酶抑制效应的研究,并讨论了环境计算化学和预测毒理学方法在该领域的重要应用,以期为HOCs干扰甲状腺激素酶代谢活性的研究和发展方向提供参考。
1 甲状腺激素及其干扰效应(Thyroid hormones and their disrupting effects)
1.1 甲状腺激素的结构与功能
THs是由甲状腺产生和释放的内源性激素,包括三碘甲状腺原氨酸(triiodothyronine, T3)和甲状腺氨酸(thyroxine, T4),结构如图1所示。血清中THs的水平受到下丘脑-垂体-甲状腺轴(hypothalamus-pituitary-thyroid axis, HPT)反馈的调节,维持THs水平的相对稳定。下丘脑释放促甲状激素释放激素(thyroid releasing hormone, TRH)调节腺垂体促甲状腺激素(thyroid-stimulating hormone, TSH)的分泌,TSH则调控甲状腺细胞分泌甲状腺激素T4和T3;当血液中T4和T3浓度增高后,通过负反馈作用,抑制腺垂体TSH的合成和释放,使TSH分泌减少,从而使THs分泌不至于过高;而当T4和T3降低时,对腺垂体的负反馈作用减弱,TSH分泌增加,促使T4和T3分泌增多[11-13]。
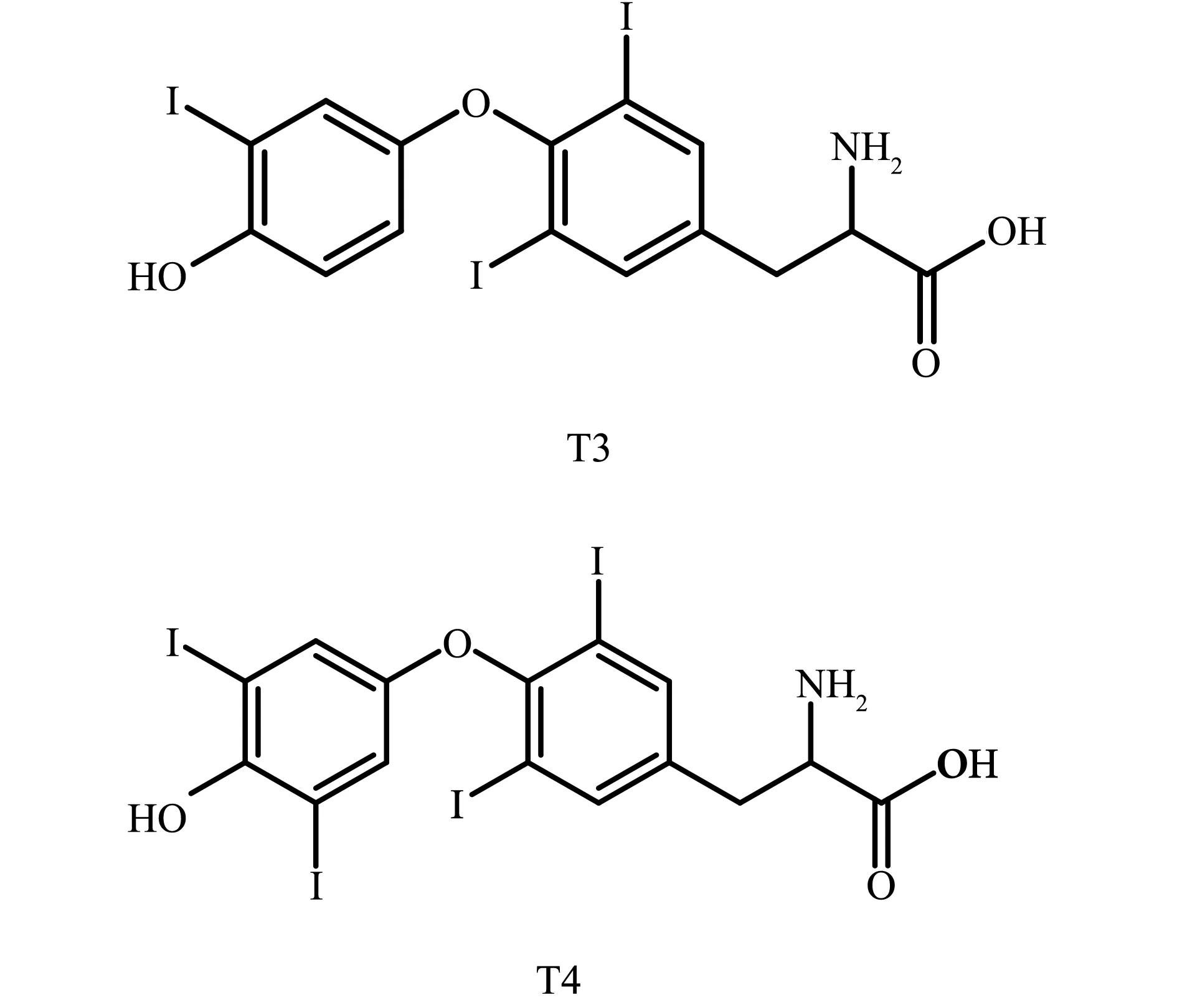
图1 甲状腺激素T3和T4结构式注:T3表示三碘甲状腺原氨酸;T4表示甲状腺氨酸。Fig. 1 Structures of thyroid hormones T3 and T4Note: T3 stands for triiodothyronine; T4 stands for thyroxine.
THs是基于酪氨酸的激素,主要负责调节新陈代谢。THs进入血液后,通过运甲状腺素蛋白(transthyretin, TTR)、甲状腺结合球蛋白(thyroxine-binding globulin, TBG)及白蛋白(albumin, ALB)等辅助转运至外周靶组织,进而发挥其生物学作用[11,14]。T4几乎没有生物活性,在脱碘酶(deiodinases, DIs)的催化作用下通过外环脱碘形成具有生物活性的T3[15]。T3与甲状腺受体结合,进而激活THs介导的生物信号,产生各种生理效应。在肝脏中,THs可被磺基转移酶(sulfotransferases, SULTs)代谢,增加THs水溶性,然后经胆汁、尿液和皮肤等排出体外。
THs具有重要的生理功能[9-10,16-18]:可促进生长发育,主要促进骨骼、脑和生殖器官的生长发育,若没有THs,垂体的生长激素也不能发挥作用;可调节长骨生长和神经成熟;通过增加交感神经活动增强身体对儿茶酚胺(如肾上腺素)的敏感性;提高神经系统的兴奋性;调节蛋白质、脂肪和碳水化合物的代谢,刺激维生素代谢等,提高机体的耗氧率,增加产热效应。THs几乎作用于体内的每一个细胞,对生物体所有细胞的发育和分化至关重要。因此,维持正常的THs水平对于机体健康至关重要。
1.2 卤代有机污染物的甲状腺激素干扰效应
实验研究表明,HOCs进入生物体后,可能会通过以下3种途径影响THs功能的正常发挥:
(1)干扰THs的合成[19-20]。HOCs通过干扰甲状腺摄碘、甲状腺过氧化物酶(thyroid peroxidase, TPO)和甲状腺球蛋白(thyroglobulin, TG)等干扰THs合成,进而影响THs水平。TPO是在THs合成中发挥重要作用的酶,可催化碘化酪氨酸残基产生甲状腺激素前体。TG可用来合成THs,一般情况下,TG的表达升高,THs水平相应升高。THs水平也可通过负反馈调节作用调控TG表达。
(2)干扰THs在血液中的转运以及与受体结合的过程。由于与THs结构上的相似性,HOCs及其羟基、甲氧基代谢物可竞争结合甲状腺激素转运蛋白,如TTR[21-24]和TBG[25],进而影响THs在血液中的正常输送。同时,这些化合物也可以与甲状腺激素受体,如TRα或TRβ相结合[26-27],从而阻碍T3与TRs的正常结合。特别是羟基多溴联苯醚(OH-PBDEs),与甲状腺激素转运蛋白和甲状腺激素受体的结合能力显著高于其母体化合物,表现出更高的甲状腺干扰效应[28]。
(3)干扰THs的代谢过程。人体内的THs稳态同时受脱碘、葡萄糖醛酸化和硫酸化等过程的调节[4,29]。目前,逐渐有研究开始关注HOCs对参与THs代谢过程的酶以及酶催化效果的影响,发现很多HOCs可以抑制甲状腺激素SULTs和DIs的活性[6,30-33]。针对具体的分子机制,也出现了一些代表性的工作。本文接下来将重点介绍HOCs对不同甲状腺激素酶代谢抑制效应的研究进展。
2 卤代有机污染物对甲状腺激素酶代谢抑制效应的研究进展(Research progress in the inhibition of thyroid hormones metabolism by halogenated organic contaminants)
2.1 卤代有机污染物对甲状腺激素磺基转移酶的抑制效应
磺酸化过程是药物和环境化学品以及内源性化合物在生物体内的主要结合反应之一[32]。通常与磺酸盐结合被认为是天然的解毒机制,可增加各种内源和外源亲脂性化合物的水溶性并促进其在胆汁和尿液中的排泄。THs可通过酚羟基与磺酸盐结合而发生代谢,引发THs的不可逆降解[29]。SULTs是THs磺酸化代谢的关键酶类,存在于肝、肾上腺和肾等组织器官中,在多种生物过程中(如细胞通讯、生长、发育和防御)发挥着重要作用,可参与许多内源性物质和异生素如羟基类固醇、THs、胆汁酸和单胺类神经递质的II期代谢,催化其生物转化[34-36]。磺酸化过程使用3’-磷酸腺苷-5’-磷酰磺酸(3’-phospate-5’-phosphosulfate, PAPS)为磺酸盐供体,将磺基转移到底物的—O、—N或—S等受体基团,催化底物与磺酸盐结合[37](图2)。

图2 SULTs催化THs磺酸化机制注:SULTs表示磺基转移酶;THs表示甲状腺激素;PAPS表示3’-磷酸腺苷-5’-磷酸磺酸盐;PAP表示3’,5’-二磷酸腺苷;3,3’-T2表示3,3’-二碘甲腺原氨酸。Fig. 2 The mechanism of THs sulfonation catalyzed by SULTsNote: SULTs stands for sulfotransferases; THs stands for thyroid hormones; PAPS stands for 3’-phospate-5’-phosphosulfate; PAP stands for 3’,5’-bisphosphate; 3,3’-T2 stands for 3,3’-diiodothyronine.
基于氨基酸序列的同一性及其催化功能,磺基转移酶可分为酚和羟基类固醇磺基转移酶2个家族[38-41]。THs是酚磺基转移酶的内源性底物,该酶的晶体结构最初由Sekura等[42]表征。已有研究证实几种大鼠磺基转移酶(rSULTs)和人类磺基转移酶(hSULTs)可催化THs磺酸化[43-44]。Visser等[33]对大鼠及人肝细胞溶质、重组rSULT1C1和hSULT1A1的碘甲腺原氨酸磺基转移酶活性进行了初步表征,发现上述酶催化不同THs磺酸化的顺序为3,3’-二碘甲腺原氨酸(3,3’-diiodothyronine, 3,3’-T2) > T3 ≈ 3,3’,5’-三碘甲状腺原氨酸(3,3’,5’-triiodothyronine, rT3) > T4,说明T3和T4的脱碘产物3,3’-T2是SULTs活性最强的底物。人体中已鉴定出8种可以催化THs磺酸化的SULTs同工酶,包括SULT1A1、SULT1A3、SULT1A5、SULT1B1、SULT1B2、SULT1C1、SULT1E1和SULT2A1[31, 33],其中SULT1A1具有最广泛的特异性,对PAPS和碘甲状腺原氨酸的亲和力最高[45-46]。
Butt和Stapleton[31]测定了OH-PBDEs等溴代阻燃剂和卤代酚对人肝细胞质SULTs催化转化3,3’-T2的半数最大抑制浓度(half maximal inhibitory concentration, IC50)数据,结果显示,所研究的OH-PBDEs和卤代酚化合物均对3,3’-T2的催化磺酸化表现出抑制效应,其中2,4,6-三卤代酚的抑制效应最强,且IC50值处于nmol·L-1水平;邻位(ortho)和对位(para)-OH取代的OH-PBDEs会增强对SULTs催化活性的抑制;Br取代数目越多的OH-PBDEs,分子的空间位阻越大,会降低其抑制作用;对于不同卤素取代的化合物而言,2,4,6-三氟酚(2,4,6-trifluorophenol, 2,4,6-TFP)、2,4,6-三氯酚(2,4,6-trichlorophenol, 2,4,6-TCP)和2,4,6-三溴酚(2,4,6-tribromophenol, 2,4,6-TBP)显示大致相等的抑制效应,2,4,6-三碘酚(2,4,6-triiodophenol, 2,4,6-TIP)表现出较低的抑制效应;卤代双酚A化合物相对抑制效应顺序为:3,3’,5,5’-四氯双酚A(3,3’,5,5’-tetrachlorobisphenol A, TCBPA) ≈ TBBPA > 4,4’-(六氟异亚丙基)-双酚(4,4’-(hexafluoroisopropylidene)-diphenol, BPA AF) > 3,3’,5,5’-四碘双酚A(3,3’,5,5’-tetraiodobisphenol A, TIBPA)。此外,通过构建OH-PBDEs化合物IC50值的定量结构-活性关系(QSAR)模型,发现IC50值与化合物羟基基团的酸碱解离常数(pKa)存在正相关关系,pKa值越小的OH-PBDEs具有越强的干扰效应,表明可电离化合物与SULTs的相互作用也可能具有形态依赖性。
Leonetti等[47]进一步选取PBDEs、OH-PBDEs和2,4,6-TBP等溴代阻燃剂,研究其对人胎盘绒膜癌细胞(BeWo)中SULTs催化THs磺酸化活性的影响,发现2,4,6-TBP、3-OH BDE47和6-OH BDE47均显示SULTs活性抑制,且2,4,6-TBP和3-OH BDE47的抑制效应最强;质谱法检测得到了3-OH BDE47的磺酸化代谢物,证明3-OH BDE47可以作为底物与THs竞争结合SULTs并进行磺酸化。para-OH取代的OH-PBDEs结构上更类似于3,3’-T2,使得OH-PBDEs抑制活性增强。然而3-OH BDE47的暴露可检测到其磺酸化产物的存在,表明3-OH BDE47能够更好地进入SULTs结合口袋,并且与活性位点相互作用,从而允许-OH的硫酸化。
以上2项研究结果均显示,分子中-OH的存在对该类外源性化合物抑制SULTs催化3,3’-T2磺酸化起到重要作用,3-OH BDE47比6-OH BDE47更能有效抑制SULTs的活性。2项研究使用了不同组织来源和类型的SULTs,可能会有不同的SULTs表达水平,并且抑制作用的分子机制有待进一步阐述。
除hSULTs外,某些rSULTs也可催化THs磺酸化。已有研究证实SULT1B1[48]和SULT1C1[49-50]可催化碘甲状腺原氨酸磺酸化,且SULT1C1仅在雄性大鼠肝脏中表达,而SULT1B1的表达与性别无关,但尚未证实大鼠SULT1A1能否催化THs磺酸化[33]。Schuur等[6]以125I标记的3,3’-T2为底物,以大鼠肝细胞溶质作为SULTs的来源,研究多氯联苯(polychlorinated biphenyls, PCBs)、二苯并对二恶英(dibenzo-p-dioins, PCDDs)和二苯并呋喃(dibenzofurans, PCDFs)及其羟基化代谢物对SULTs催化磺酸化活性的抑制作用,发现化合物抑制3,3’-T2磺酸化活性的最重要的结构特征是分子中有羟基基团;此外,卤素取代模式对3,3’-T2磺基转移酶的抑制也有影响,BPA衍生物只有被溴或氯取代时才抑制3,3’-T2的磺酸化。
Schuur等[51]使用大鼠肝细胞溶质的体外实验结果表明,OH-PCBs抑制SULTs活性的IC50值在nmol·L-1范围内;对位或间位羟基取代是该活性抑制的重要结构要求;OH-PCBs对T2的磺基转移酶抑制活性与T3相似,再次表明T2可以用作T3的模型,作为碘代甲腺原氨酸磺基转移酶抑制剂表征的底物。进一步研究发现:以雌性大鼠肝细胞溶质为SULTs的来源,测得OH-PCBs的IC50值与使用雄性大鼠肝细胞溶质、大鼠SULT1C1和人SULT1A1的IC50值相似[32]。
2.2 卤代有机污染物对THs脱碘酶的抑制效应
除磺基转移酶外,DIs也对THs的代谢起到重要作用。THs通过DIs在外周组织中代谢。DIs是含有硒代半胱氨酸的蛋白质,催化THs在体内的脱碘代谢,是调节THs内稳态的重要因素[52]。T4脱碘形成rT3(内环脱碘,inner ring deiodination, IRD)及T3(外环脱碘,outer ring deiodination, ORD),T3和rT3可进一步脱碘形成3,3’-T2[29,52](图3)。目前,已鉴定出3种DIs(DI-1, DI-2和DI-3)具有外环和/或内环脱碘活性,且在THs生物活性的组织特异性调节中起重要作用。另外,THs的酚羟基基团可以与葡糖醛酸和磺酸盐结合,并且磺酸盐缀合物更容易脱碘,从而引发激素的不可逆降解。In vivo实验已经证实T4磺酸化将内环脱碘水平提高约200倍,形成rT3磺酸盐[53]。
Butt等[30]采用光谱测定法研究特定卤素对DIs抑制的作用,选用氟、氯、溴和碘取代的2,4,6-三卤代苯酚和BPA衍生物、BDE99及OH-PBDEs等进行详细分析。研究发现,所有的BPA衍生物对T3和3,3’-T2的形成都显示出一定的抑制效应,抑制强度为TBBPA>TCBPA>TIBPA>BPA AF,其中TBBPA

图3 DIs(DI-1, DI-2和DI-3)催化THs区域选择性脱碘注:DIs表示脱碘酶;rT3表示3,3’,5’-三碘甲状腺原氨酸;ORD表示外环脱碘;IRD表示内环脱碘;DI-1可催化ORD和IRD,DI-2仅催化ORD,DI-3仅催化IRD。Fig. 3 Regioselective deiodinations of thyroid hormones by three DIs (DI-1, DI-2, and DI-3)Note: DIs stands for deiodinases; rT3 stands for 3,3’,5’-triiodothyronine; ORD stands for outer ring deiodination; IRD stands for inner ring deiodination; DI-1 can catalyze the ORD and IRD; DI-2 only catalyzes the ORD; DI-3 only catalyzes the IRD.
是最有效的DIs抑制剂。对于2,4,6-三卤苯酚而言,随着卤素分子量的增加,其抑制强度相应增加,2,4,6-TIP > 2,4,6-TBP > 2,4,6-TCP > 2,4,6-TFP。研究还发现,与抑制磺基转移酶活性相似,化合物分子中羟基基团的存在也对DIs的抑制效应具有重要作用。值得一提的是,5-OH BDE47和4’-OH BDE101未观察到DIs抑制效应,5’-OH BDE99不抑制rT3的形成,原因可能是这些化合物对DI-1的抑制机制与其他化合物不同,但具体的分子机制目前尚不清楚,需要进一步的研究。
Roberts等[54]在PBDEs及其羟基代谢产物对体外培养的人胶质细胞DI-2活性的破坏研究中发现,其抑制活性为3-OH BDE47 > 5’-OH BDE99 > BDE99,而BDE47不能抑制DI-2的活性。Butt等[30]的研究显示,5’-OH BDE99能够同时抑制人肝微粒体中的DI-1和DI-2的活性,并且对DI-2的活性抑制能力更强,IC50值分别为400 nmol·L-1(DI-1)和(16.6 ± 1.1) μmol·L-1(DI-2)。
此外,Szabo等[55]研究了DE-71(商业化五溴二苯醚混合物)对雄性大鼠不同发育时间点THs代谢相关基因的影响。研究发现,暴露于DE-71的大鼠雄性幼仔DI-1活性降低:幼仔出生4 d后,DI-1活性降低60%;幼仔出生21 d后,DI-1活性降低70%。然而,该DE-71含有低水平的溴化二恶英和二苯并呋喃,需要进一步研究确定暴露于纯化的多溴二苯醚同源物的DI-1活性变化情况。
3 环境计算化学方法在甲状腺激素酶代谢抑制作用研究中的应用(Application of environmental computational chemistry methods in the study on the inhibition of thyroid hormones metabolism)
体内(in vivo)或体外(in vitro)实验是获取化学物质潜在干扰效应的有效途径。然而,考虑到使用人体组织所涉及的复杂性,且研究中存在众多混合变量,而这些变量不易控制,对实验结果有影响;另外,由于分子水平作用机理研究的必要性,计算化学方法正在发挥越来越重要的作用[56-57]。环境计算化学,使用计算化学方法结合计算机模拟技术,不依赖于仪器设备与化学试剂,基于一定的实验,在分子水平上对体系进行精细的理论研究,能深入了解有机污染物与受体之间的作用方式和结合过程等,具有实验研究不可替代的优势,在生物酶催化有机物代谢、有机污染物的迁移转化等领域得到了广泛应用。在污染物的毒性作用机理和环境行为的分子机制方面,通过环境计算化学方法,不仅可以揭示其在生物体内与生物大分子的作用机制,也为深入解释实验现象提供帮助。目前,分子对接技术、量子化学计算等方法已经广泛用于模拟HOCs与TR[57-59]和TTR[21,60]的相互作用,为深入理解HOCs对THs抑制作用的机理做出了重要贡献。近年来,研究人员逐渐使用环境计算化学方法在HOCs抑制SULTs与DIs催化活性的分子机制方面进行了初步探索,取得了一定进展。
Butt和Stapleton[31]采用分子对接技术研究了OH-PBDEs和SULT1A1之间的潜在相互作用,揭示了OH-PBDEs分子在SULT1A1活性中心的位置和取向以及氢键的形成。结果显示,在酶活性位点处,3,3’-T2与SULT1A1残基Lys 106和His 108的—OH形成氢键相互作用,且与PAPS辅因子相邻,以利于接下来的磺酸化反应。所有对位取代的OH-PBDEs会在相似位置与Lys 106和His 108形成氢键作用,表明由于结构的相似性,OH-PBDEs可能会与3,3’-T2竞争结合SULT1A1。
多个研究显示,HOCs羟基代谢产物中羟基基团的存在对SULTs和DIs的代谢活性具有重要影响[6,30-31,47,54]。羟基基团在生理(pH = 7.0~7.4)条件下会发生解离,且Yang等[60]采用量子力学耦合分子力学(quantum mechanical/molecular mechanical, QM/MM)方法研究羟基解离对酚类化合物与人运甲状腺素蛋白(hTTR)的结合作用的影响时发现,阴离子酚类化合物与hTTR的结合强于它们的中性形式,说明分子解离对甲状腺激素干扰效应具有重要影响,实验时分子解离效应不应被忽略。
近期,我们课题组使用了17个具有较低Br原子数取代的OH-PBDEs,首次进行了系统的计算模拟,揭示了OH-PBDEs与hSULT1A1可能的结合模式和抑制机理。分子对接结果表明,大多数OH-PBDEs会与SULT1A1的2个残基Lys 106和His 108形成氢键,并且中性OH-PBDEs与其阴离子对应物显示出相似的结合能。进一步使用QM/MM方法模拟了OH-PBDEs与SULT1A1的相互作用,基于计算结果首次提出了包括质子转移和磺酸化2个步骤的SULT1A1代谢OH-PBDEs的分子机制,特别是含有3个和少于3个Br原子的OH-PBDEs可以作为SULT1A1的底物被酶催化形成磺酸化产物,其他OH-PBDEs可能仅与SULT1A1形成三元死结复合物从而抑制酶活性。此外,计算结果揭示了SULT1A1抑制的重要结构需求,不同—OH取代位置的OH-PBDE的抑制活性顺序为ortho-OH BDE > meta-OH BDE > para-OH BDE。同时,OH-PBDEs中Br原子的空间位阻效应也会影响磺酸化反应过程,Br个数越多,越不利于磺酸化反应。
Marsan和Bayse[61]使用密度泛函理论(density functional theory, DFT)研究了THs衍生物和PBDEs/OH-BDEs与DIs活性位点的甲基硒酸盐的卤键(halogen bonding, XB)相互作用的强度。研究发现,XB作用的强度取决于卤素的位置、环上卤原子的数目以及羟基与XB位点的接近程度。无论是从它们的相互作用能还是C—Br键的活化方面来看,PBDEs/OH-PBDEs可以竞争性地结合活性位点硒代半胱氨酸(Sec170),与MeSe-形成弱的XB相互作用,抑制THs脱碘代谢。高溴化PBDEs/OH-BDEs可能会发生脱溴,并具有与THs脱碘相似的作用能;相对于醚基,XB相互作用往往在邻位和间位最有利,而在对位则较弱。
4 总结与展望(Summary and prospect)
作为THs干扰效应的重要机制,HOCs对THs代谢过程中相关酶的抑制作用正引起越来越多的关注。总结国内外研究进展发现,虽然相关工作已陆续开展,尚有许多科学问题未解决,例如:HOCs抑制SULTs与DIs活性的分子机制如何?HOCs是仅通过竞争结合位点来抑制THs活性,还是作为底物与酶反应,从而使THs活性受到抑制?不同卤素种类、取代位置和数量等结构因素对酶活性抑制作用的影响如何?这些问题均需进一步研究探讨;此外,已有研究发现分子中—OH的存在是HOCs抑制甲状腺激素酶代谢活性的重要分子结构特征,但是羟基解离是否会对相关酶代谢的抑制产生影响,尚未有直接研究,需要进一步探索。在开展实验研究的基础上,结合理论计算化学方法进行分子模拟,将会从分子水平上揭示该类化合物对THs相关酶代谢过程抑制的机制,阐明导致甲状腺激素干扰效应的分子起始事件(molecular initiating events, MIEs),进一步服务于化合物的有害结局路径(adverse outcome pathway, AOP)研究和健康风险评价。

