外源性维生素D对小鼠脑缺血/再灌注神经损伤的保护作用*
李永荣, 李 红
(1. 甘肃中医药大学附属医院老年病科, 兰州 730020; 2. 深圳市罗湖区中医院, 深圳 518001)
脑卒中是世界范围内人们常见的死亡原因。脑卒中后缺血/再灌注(ischemia/reperfusion, I/R) 损伤与局部炎症、活性氧产生和循环免疫细胞浸润有关[1]。维生素D活性形式,1,25-二羟维生素D3(1,25-dihydroxyvitamin D3,1,25-VitD3)通过多种细胞和分子机制抑制炎症进展和活性氧产生,并增强抗氧化剂表达[2,3]。观察性研究已经证实,血清维生素D水平较低脑卒后患者梗死体积较大,功能恢复较差[4]。上述结果提示维生素D可能在脑缺血中发挥神经保护作用。最近有研究报道,由于缺乏维生素D饮食导致基线维生素D低水平,对脑大血管闭塞24 h小鼠功能恢复无影响[5]。然而基线高水平维生素D对小鼠脑I/R损伤影响未见相关报道。此外,维生素D不仅能促进小肠对钙吸收,也可能调节大量基因的表达,特别是参与炎症的相关基因[6]。本研究在小鼠大脑中动脉闭塞(Middle cerebral artery occlusion, MCAO)模型制备前5 d 连续补充1,25-VitD3,观察1,25-VitD3对小鼠I/R后脑损伤的影响,并对其机制进行探讨,从而为小鼠I/R后脑损伤的治疗提供新的靶点。
1 材料与方法
1.1 实验动物及分组
雄性C57BL/6 (21-30 g),购于甘肃中医药大学动物中心。室温下自由饮食和饮水。将C57BL6小鼠随机分成:Sham组、Vehicle组和1,25-VitD3组,每组均为10只小鼠。Sham 组小鼠只进行MCAO相关手术步骤,但不插入线栓。1,25-VitD3组小鼠在MCAO手术前5 d连续腹腔注射1,25-VitD3溶液(100 ng/(kg·d)),该溶液中无菌水、丙醇和乙醇比例为5∶4∶1[7]。Vehicle组小鼠MCAO手术前5 d 连续腹腔注射等量Vehicle(无菌水、丙醇和乙醇混合液)。
1.2 实验仪器和试剂
光学显微镜(日本OLYMPUS公司);冰冻切片机(德国Leica公司);1,25-VitD3(美国Sigma公司);TTC染料(美国Sigma公司);抗髓过氧化物酶多克隆抗体(美国Sigma公司);PCR引物由上海内含子生物科技有限公司构建。
1.3 MCAO模型诱导脑I/R
腹腔注射1%戊巴比妥钠(0.06 g/kg)麻醉小鼠,剪毛后进行颈部手术。在显微镜下分离颈总动脉、颈外动脉和颈内动脉,对颈总动脉近心端和颈外动脉远心端结扎,用针在颈外动脉远端动脉壁上扎一个小口,将线栓从颈外动脉小孔插入颈总动脉,通过颈内动脉到达大脑中动脉,固定线栓,MCAO后1 h 拔出线栓,再灌注24 h 。模型成功的标志是小鼠麻醉清醒后出现手术侧肢体瘫痪,站立不稳,小鼠可存活1周。I /R 手术成功率约为70%。Sham 组小鼠只进行相关手术步骤,但不插入线栓。小鼠再灌注24 h,进行神经行为学评分后腹腔注射水合氯醛麻醉,取各组小鼠脑缺血半影区,进行TTC染色、RT-PCR及免疫组化检测。
1.4 神经功能评分
小鼠再灌注24 h,进行神经行为学评分。0分为运动功能正常;1分为尾部抬起时躯干和对侧前肢屈曲;2分为将小鼠置于光滑平面上,尾部抬起时偏向对侧,安静时姿势正常;3分为仰卧时偏向对侧;4分为无自发活动;5分为死亡[8]。
1.5 I/R后脑梗死体积的检测
小鼠再灌注24 h,取各组小鼠脑组织,大脑行冠状切片,厚度为2 mm。然后将脑片放入1% TTC磷酸盐缓冲液中,在37℃水浴中避光孵育10 min。脑梗死区域不染色,而正常脑组织染为深红色。依据相关研究[9]方法计算I/R后脑梗死体积。
1.6 T细胞表型与促炎性介质表达检测
取各组小鼠脑组织缺血半影区,按RNA提取试剂盒步骤提取脑组织中RNA。按照逆转录试剂盒说明书合成cDNA,随后进行PCR 扩增反应。Stat4Rorc、和Gp91phox 其中Stat4上游引物序列为5-CATTTGGTACAAC GTGTC AA C CA-3′,下游引物序列为5′-TGTGGCAGGTGGAGGATTATT A′;Stat6上游引物序5′-ACGGCTCTATG TTGACTTTC -3′,下游引物序列5′-AGATCCTG TTTCCCT TCC-3′;Rorc上游引物序 5′-ACAGCTCCATGCCACCGTAT -3′,下游引物序列5′-TCAAAGCAGGAG C AATGGAAGT-3′;Foxp3上游引物序 5′-GCTGGTCGGG AGAAGAGGAAAA -3′,下游引物序列5′-CAGTATCCCACGGAAA TAACC T-3′;IL-6上游引物序 5′-TGTCTTCCTCACCGATTCCT -3′,下游引物序列5′-ACCA CCCGAGCTC TGT CTTACTC-3′;IL-1β上游引物序 5′-ATGGCAGAAGTACCTAAGCTC-3′,下游引物序列5′-TTAGGAAGACACAAATTGCATGGTGAACTCACGT-3′;内参均为GAPDH。最后取PCR 扩增产物进行琼脂糖凝胶电泳,采用凝胶分析软件对条带进行分析, 后将目的条带与内参照积分吸光度比值来评估和mRNA在组织中相对表达量。
1.7 免疫细胞迁移状况检测
提取各组小鼠脑组织缺血半影区,用10%福尔马林缓冲液固定,石蜡包埋,4 μm 连续切片。切片后脱蜡、抗原修复阻断内源性过氧化物酶活性及封闭后,滴加兔抗鼠抗髓过氧化物酶多克隆抗体(1∶200)4℃冰箱过夜。PBS 水洗后滴加山羊抗兔 IgG 二抗(1∶1 000),DAB 显色,苏木精复染胞核,脱水,透明,封片。每组小鼠缺血半球随机选取6个高倍视野(×400),计数阳性细胞数量,取平均值。
1.8 统计学处理
2 结果
2.1 1,25-VitD3对脑梗死体积和神经功能缺损影响
为了明确基线维生素D升高对小鼠对梗死发展影响,在I/R前5 d连续补充1,25-VitD3。再灌24 h后,1,25-VitD3组小鼠梗死体积显著低于Vehicle组(P<0.05,图1,表1)。Vehicle组小鼠神经功能学评分为3.0±0.5;1,25-VitD3组小鼠为3.1± 0.6,两组小鼠评分无统计学差异(表1),提示两组小鼠再灌24 h神经功能缺损相似。

Fig.1Typical TTC staining in three groups of mice


GroupCerebral infarction volume(mm3)Neurobehavioral scoreSham 0 0Vehicle35.0±7.3∗∗3.0±0.5∗∗1,25-VitD319.2±3.5∗∗#3.1±0.6∗∗
**P<0.01vssham group;##P<0.01vsvehicle group
2.2 1,25-VitD3对小鼠脑组织T细胞表达影响
以往研究报道,Th1和γδT细胞促进脑卒中后脑损伤,而Th2和T调节细胞通过抑制过度炎症反应发挥保护作用[10]。RT-PCR结果显示,I/R或1,25-VitD3对Th1转录因子Stat4表达和Th2转录因子Stat6表达均无明显影响。然而,I/R导致Th17/γδ T细胞转录因子Rorc表达增高,而1,25-VitD3降低Rorc表达。此外,I/R可使T调节细胞转录因子Foxp3表达升高,而1,25-VitD3进一步使Foxp3表达升高(表2)。

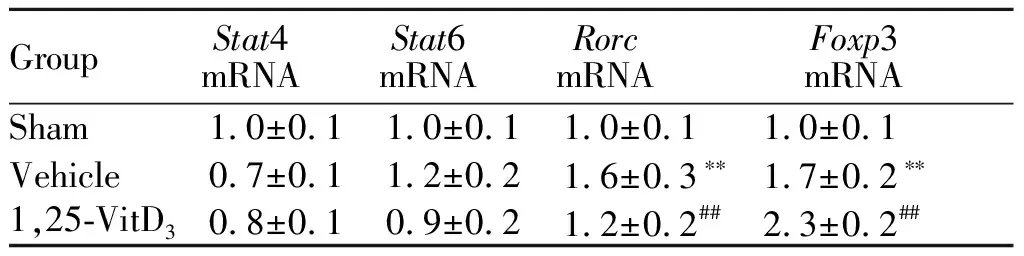
GroupStat4mRNAStat6mRNARorcmRNAFoxp3mRNASham1.0±0.11.0±0.11.0±0.11.0±0.1Vehicle0.7±0.11.2±0.21.6±0.3∗∗1.7±0.2∗∗1,25-VitD30.8±0.10.9±0.21.2±0.2##2.3±0.2##
**P<0.01vssham group;##P<0.01vsvehicle group
2.3 1,25-VitD3对小鼠脑组织促炎性介质表达影响
由于1,25-VitD3有免疫调节作用,因而本研究检测I/R后脑组织中炎症介质mRNA表达。结果显示,1,25-VitD3组小鼠IL-1β、IL-6和Gp91phoxmRNA表达均显著低于Vehicle组(P<0.05,表3)。


GroupIL-1β mRNAIL-6 mRNAGp91phox mRNASham1.0±0.10.0±0.00.9±0.1Vehicle24.5±6.8∗∗90.0±20.5∗∗6.0±1.2∗∗1,25-VitD35.6±1.4##30.0±5.8##2.6±0.4##
**P<0.01vssham group;##P<0.01vsvehicle group
2.4 1,25-VitD3对小鼠脑组织浸润中性粒细胞影响
最后检测了维生素D对脑损伤部位免疫细胞迁移影响。免疫组化结果显示,1,25-VitD3小鼠脑损伤部位中性粒细胞数量明显低于Vehicle组(P<0.05,图2)。

Fig.2Quantification of neutrophil in brain tissue after I/R in mice
*P<0.05
3 讨论
炎症是缺血性脑卒中后继发性脑损伤的主要原因,因此是I/R损伤潜在治疗靶点[1]。除了在钙代谢中的作用,维生素D也具有免疫调节特性,可以改变各种疾病中对损伤的免疫应答[11]。如果维生素D在脑卒中后脑损伤中发挥作用,其可能代表新的治疗方向。本研究结果表明,外源1,25-VitD3在I/R小鼠中的神经保护作用可能与I/R小鼠大脑促炎症介质减少有关。此外,结果还表明,补充1,25-VitD3可改变T细胞表型,减少缺血脑组织中中性粒细胞数量,均有助于外源1,25-VitD3发挥神经保护作用。
研究结果显示,再灌24 h后,1,25-VitD3组小鼠梗死体积显著低于Vehicle组。然而,在这个时间点,两组IR小鼠神经功能评分无统计学差异,可能是由于观察神经功能评分时间点相对较早。但是脑梗死体积在再灌24 h时已充分形成[12]。因此,评估维生素D通过抑制炎症发挥神经保护作用来减少脑梗死体积,本研究选择再灌24 h。我们的研究结果类似于以往报道结果,1,25-VitD3预处理可降低I/R小鼠脑梗死体积[13],但是该研究未对神经功能进行评估。下一步本研究需在再灌48及72 h在进行神经功能评分,观察两组小鼠的差异。此外,补充1,25-VitD3发挥神经保护作用的机制也不明确。为此,本研究检测1,25-VitD3可能调节I/R中免疫应答的证据。维生素D可调节T细胞表型。例如,在小鼠多发性硬化模型中,维生素D可下调Th1和Th17细胞发育所必需的信号通路[2]。此外,维生素D可促进Th2和T调节细胞形成,抑制γδT细胞发展[14]。研究已经表明,Th1和γδT细胞可加重脑卒中后脑损伤,抑制上述细胞则发挥神经保护作用;而Th2和T调节细胞被认为可抑制脑卒中后脑损伤[15]。因此我们研究了补充1,25-VitD3发挥神经保护是否与调制T细胞表型有关。结果显示,I/R或1,25-VitD3对Th1和Th2转录因子表达均无影响。然而,1,25-VitD3降低Th17/γδ T细胞转录因子Rorc表达,增加T调节细胞转录因子Foxp3表达。上述结果表明,补充1,25-VitD3促进T调节细胞形成,抑制Th17/γδT调节细胞,从而发挥神经保护作用。
补充1,25-VitD3可降低促炎性细胞因子IL-1β和IL-6 mRNA表达。有趣的是,这些细胞因子在Th17和γδT细胞功能中起着关键的作用[16]。此外,我们也观察到Gp91phoxmRNA表达减少,其在缺血性脑卒中后超氧化物产生及介导细胞损伤中发挥重要作用[17]。外源性1,25-VitD3可减少损伤部位白细胞聚集[18],因而我们检测了I/R后损伤部位中性粒细胞的浸润。我们观察到一种趋势,补充1,25-VitD3可减少小鼠中性粒细胞浸润。下一步观察其对其他白细胞浸润的影响。
总之,本研究表明,补充维生素D可能通过调节炎症反应缓解小鼠I/R后脑损伤。因此,补充维生素D可能作为一种新的治疗脑卒中的研究方向。

