三氯乙烯对斑马鱼胚胎心脏发育的毒性作用及机制*
史佳林, 夏 颖, 花 月, 张可佳, 陈 涛, 姜 岩△
(1. 苏州大学医学部, 江苏 苏州 215123; 2. 江苏省老年疾病预防转化医学重点实验室, 苏州大学, 江苏 苏州 215123)
三氯乙烯(trichloroethylene,TCE)是一种易挥发的无色液体,作为清洗剂在电子、电镀等行业长期广泛应用,也常用作萃取溶剂和高分子化合物的生产原料等。由于其广泛应用及其所具有的挥发性和微量溶水性,三氯乙烯已成为全球最重要的有机污染物之一,广泛存在于大气、土壤和地下水中[1]。对我国城市浅层地下水有机污染的研究也表明三氯乙烯是主要的污染物,2012年国际癌症研究组织(International Agency for Research on Cancer, IARC)将三氯乙烯从2A类(人类可能致癌物)升级为I类(人类致癌物)[2]。
先天性心脏病(congenital heart disease, CHD)是指胚胎期心血管发育异常而累及心功能的一组先天性畸形,新生儿的发病率为4.05%~12.3%,严重危害幼儿健康,越来越多的证据表明除遗传因素外,环境因素是先心病发生的主要原因[3]。Goldberg等人首次报道,正常孕妇孕期接触TCE污染诱发先心病患儿的是孕期未接触的3倍[4]。随后的研究进一步显示:高龄孕妇孕期接触TCE污染孕育先心病婴儿的风险率是孕期未接触的6倍[5]。迄今为止,有关TCE与人先心病的研究主要局限在TCE污染地区的流行病学研究,而结果分析受多种因素的干扰,如污染地区其他污染物并存影响,暴露时间和强度的非可控性,样本量数目的局限性等。鉴于我国每年新增先天性心脏病患者15~20万以及TCE在我国的长期广泛使用,因而有必要针对TCE心脏发育的毒性作用及其机制开展深入研究,从而提高人口生存质量。TCE暴露与先心病之间是否具有因果关系,以及有关TCE在胚胎发育过程中对心肌毒性机制的研究罕有报道。本实验室前期结果显示,TCE可抑制人胚胎干细胞向心肌的定向分化[6]。
心脏分化发育是多个信号通路相互作用的结果。大量研究表明,Wnt信号通路调控心肌分化,并随发育时程变化起到双向调节的作用,在胚胎干细胞早期激活Wnt信号通路,可促进中胚层发育和心肌细胞分化[7]。先天性心脏病全基因组数据显示,Wnt通路的异常是散发性先天性心脏病的高风险因素,经典Wnt信号通路包括Wnt蛋白、Wnt受体、Dsh/Dvl蛋白、β-catenin、GSK-3β、TGF、APC蛋白等,该通路激活后可在以GSK-3β为主的调节作用下解聚β-catenin降解复合体,从而使低磷酸化β-catenin在胞质中积累,转移入细胞核内后调节靶基因表达[8]。Wnt信号通路是否参与了TCE导致的心脏发育毒性尚不明确,本课题立足实验室前期科研积累,以斑马鱼心脏胚胎发育为模型,探讨Wnt信号通路在三氯乙烯心脏发育毒性中的作用,为寻找干预靶点提供研究依据。
1 材料与方法
1.1 主要试剂
三氯乙烯TCE(CAS79-01-6,纯度99%,购于Adamas-beta上海总公司); CHIR99021(6-[2-[4-(2,4-二氯苯基)-5-(4-甲基-1H-咪唑-2-基)嘧啶-2-基氨基]乙基氨基]吡啶-3-甲腈, CAS252917-06-9,纯度>98%,购于Priceton公司);XAV-939(3,5,7,8-四氢-2-[4-(三氟甲基)苯基]-4H-噻喃并[4,3-D]嘧啶-4-酮CAS 284028-89-3,纯度>98%,购于Selleck公司);TRIzol购自天根生化有限公司;cDNA Synthesis MasterMix试剂盒购自BioMIGA公司;SYBR Select Master Mix, 购自TM Applied Biosystems公司。
1.2 斑马鱼胚胎培养
斑马鱼胚胎来自国家斑马鱼资源中心,饲养于系统养殖水中,恒温28℃,每隔24 h更换养殖水,并分别加入相应药物,进行如下分组:DMSO组、DMSO+CHIR、DMSO+XAV组、TCE处理组、TCE+CHIR组以及TCE+XAV组。其中 CHIR为Wnt信号通路激活剂,浓度为1 μmol/L;XAV为Wnt信号通路抑制剂,浓度为0.3 μmol/L;TCE的处理浓度为7.6 nmol/L(1 ppb)、76 nmol/L(10 ppb)、760 nmol/L(100 ppb);TCE、CHIR和XAV均溶于DMSO中。经过换算保证对照组和各处理组中DMSO浓度一致,均不超过5‰(前期的研究结果显示,DMSO在此浓度不引发斑马鱼胚胎发育异常)[9]。
1.3 心脏发育形态观察
取出已培养72 hpf(hours post-fertilization 受精后小时)的斑马鱼胚胎,恒温体式镜下记录心脏发育情况,拍照,录像评价血流循环,统计心脏畸形率和畸形类别。
1.4 斑马鱼心脏富集
注射器针头剥离斑马鱼胚胎心脏,荧光显微镜下检查心脏特异性绿色荧光蛋白,确认心脏剖取完整性,用<10 μl的移液枪小心吸取剥离好的斑马鱼胚胎心脏置于放于冰上的1.5 ml离心管(预置350 μl裂解液)中,重复此项操作至该组全部斑马鱼胚胎心脏剥离完毕(实验组和对照组分别60个斑马鱼胚胎,每次实验重复3次)。
1.5 表达芯片及分析
提取细胞总RNA,检测RNA质量,荧光素标记后与安捷伦斑马鱼表达谱芯片杂交,并进行数据分析,差异基因筛选标准为变化幅度>2为上调基因,<-2即为下调基因。Go(gene ontology)分析统计靶基因个数,并进行Pathway显著性分析,集中分析与心脏发育相关的信号通路(该部分实验由上海欧易有限公司协助完成)。
1.6 实时荧光定量PCR
TRIzol提取RNA后,用cDNA Synthesis MasterMix试剂盒逆转录为cDNA,进行PCR扩增,引物见表1. 以荧光定量PCR仪(ABI7500,购自Applied Biosystems 公司)检测,以GAPDH为内参,以2-ΔΔCt方法进行差异分析(计算相对量)。
Tab.1Primer sequences for quantitative real-time PCR

GeneForwardReverseAxin2GGACACTTCAAGGAACAACTACCACTTTGCCGAGGATTTTGCCSox9bTGACGAGTTGTTCTCCAGAGAGGCCACACGTCTATAACCCNkx2.5GCTTTTACGCGAAGAACTTCCGATCTTCACCTGTGTGGAGGGapdhGACGCTGGTGCTGGTATTGCTCTACTCCTTGGAGGCCATGTGT
1.7 统计学处理
2 结果
2.1 三氯乙烯对斑马鱼胚胎心脏发育的影响
与对照组相比,斑马鱼胚胎在TCE暴露72 h出现显著的心脏发育畸形(图1)。TCE处理组的斑马鱼胚胎心脏出现心房心室比例异常、环化不全,心包肿大等严重畸形。与control组(畸形率:4.59%±0.65%)相比,TCE10 ppb组(畸形率:9.69%± 0.82%),TCE100ppb组(畸形率:15.03%± 2.89%)斑马鱼胚胎心脏畸形表型比例显著增加。此外高浓度剂量组,斑马鱼胚胎心脏出现卵黄囊出血、血液循环速度减慢以及心搏无力等更多畸形表型。

Fig.1Cardiac defects of zebrafish embryos exposed to TCE with different concentrations Arrows indicate heart malformations
2.2 三氯乙烯影响心脏组织特异性转录
剖取心脏组织,在荧光显微镜下确认心脏剥离(图2A)。提取RNA进行转录组分析,TCE处理导致1221基因表达上调,1531基因表达下调(图2B)。进行GO分析,显示细胞外基质重塑相关事件的通路受到显著影响,其中Wnt信号通路多个相关基因(NKX2.5, SOX9b及Axin2等)表达被下调(图2C)。

Fig.2The mRNA array profiling analysis of TCE treatment on heart development
A: Dissection of heart tissue, GFP labeled heart under fluorescence microscope; B: mRNA profiling analysis; C: Target genes located in Wnt signaling pathway
2.3 三氯乙烯干扰Wnt信号通路相关基因表达
结合基因表达芯片结果,进一步检测Wnt信号通路中的几个相关靶基因表达水平。Q-PCR定量结果表明,N kx2.5, Sox9b及Axin2基因表达水平显著降低,提示三氯乙烯抑制Wnt信号通路相关基因表达(表2)。

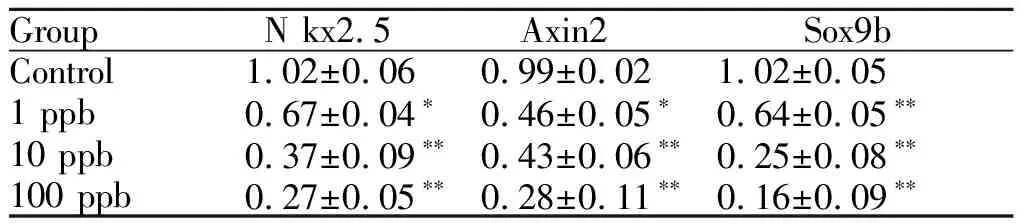
GroupN kx2.5Axin2Sox9bControl1.02±0.060.99±0.021.02±0.051 ppb0.67±0.04∗0.46±0.05∗0.64±0.05∗∗10 ppb0.37±0.09∗∗0.43±0.06∗∗0.25±0.08∗∗100 ppb0.27±0.05∗∗0.28±0.11∗∗0.16±0.09∗∗
*P<0.05,**P<0.01vscontrol
2.4 Wnt信号通路在三氯乙烯心脏发育中的毒性作用
为进一步验证Wnt信号通路参与介导三氯乙烯致心脏发育中的毒性,我们在三氯乙烯10 ppb组加入Wnt信号通路激活剂CHIR(1 μmol/L),检测72 hpf后斑马鱼胚胎心脏发育情况。结果显示,心包增大、心脏线性化、心搏无力等心脏畸形表型情况明显改善(图3)。但在DMSO+CHIR与DMSO组畸形率无显著差异,说明CHIR本身对心脏发育无明显影响。而Wnt信号通路抑制剂XAV(0.3 μmol/L),本身即可显著增加心脏畸形,与三氯乙烯联合暴露更引起90%以上的胚胎心脏畸形(表3)。
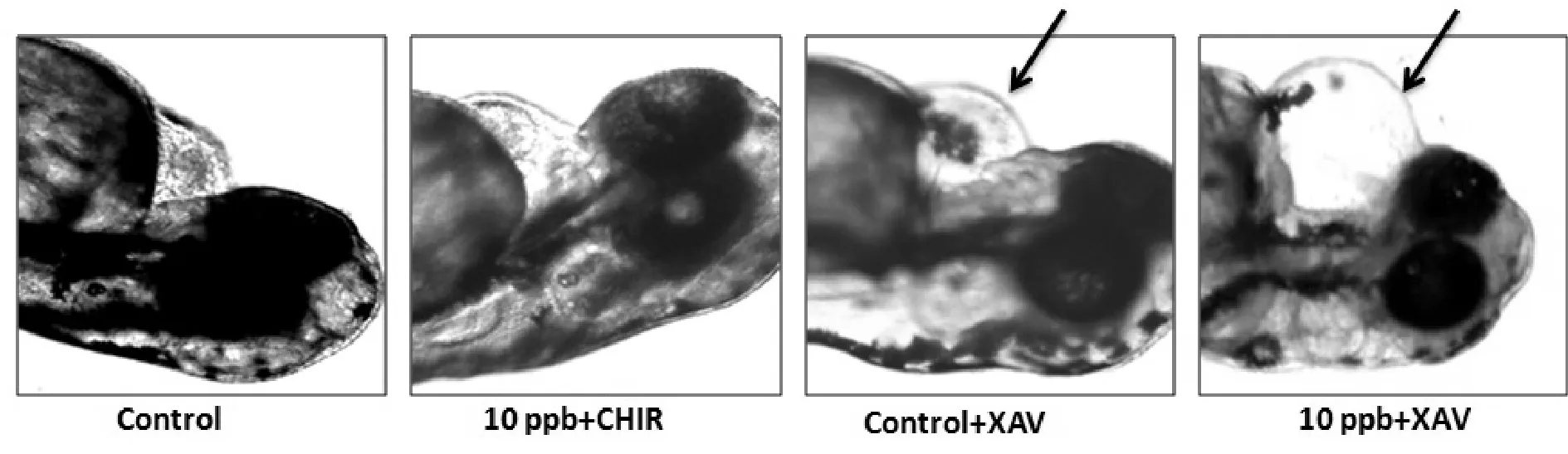
Fig.3Wnt signaling pathway is involved in the cardiac developmental toxicity induced by TCE Arrows indicate heart malformations

Tab. 3 The effects of TCE on heart
*P<0.05vscontrol;#P<0.05vscontrol +XAV
3 讨论
先天性心脏病作为一种极为常见的先天畸形疾病,是由于胚胎发育时期胎体在遗传及环境等多种因素单独或者联合作用下,引发心脏及大血管的形成障碍或发育异常而导致胚胎心血管系统解剖功能出现异常。在体外细胞实验中,本实验室和其他研究组已有多个报道显示,TCE孕期三氯乙烯暴露可显著影响胚胎心脏发育,尽管相关信号通路尚不明确,但多数集中在心肌发育相关基因表达受到干扰[10-11]。但细胞水平无法客观反映整体动物代谢以及复合毒性的影响,如TCE可能的代谢中间物TCA的影响[12]。基于此,本研究利用发育模式生物斑马鱼作为实验对象,研究整体水平TCE的心脏发育毒性。斑马鱼和人类基因有着87%的高度同源性,在研究生命科学的基础问题,胚胎和组织器官发育的分子机制,以及建立毒理学模型等方面都得到广泛的应用[13]。特别值得注意的是斑马鱼早期胚胎不依赖母体血液循环,体外发育便于检测,避免由于早期发育毒性所导致胚胎致死而错过研究敏感时期。有研究证实,TCE浓度在10 ppb时即可引起斑马鱼胚胎血管网的减少和斑马鱼胚胎心脏F-肌动蛋白的分解失衡[14]。我们的研究结果显示,TCE暴露导致斑马鱼胚胎心脏出现严重畸形,主要表现在心脏环化不完全,心房心室体积比例异常,围心腔肿大等畸形。在既往的多数TCE染毒实验中,由于早期胚胎组织分离操作困难以及缺乏特异性高效的鉴别标准,多数心脏发育毒性研究集中在整个胚胎的分析,这无法排除非心肌组织基因表达的干扰[15]。在本研究中采用心脏特异性转基因斑马鱼,在荧光显微镜辅佐下,有效的富集心脏组织,这极大提高下游分析信号通路及基因表达的组织特异性,为后期相关的干扰治疗提供精准的参考信息。
大量的研究发现,Wnt信号通路在胚胎的心脏发育过程中至关重要,胚胎期由于环境暴露而改变Wnt信号通路可导致心脏畸形[16]。本研究发现TCE暴露导致的斑马鱼心脏畸形,在转录水平主要反映在影响细胞代谢以及形态重建,结合到观察到形态畸形以及Wnt在细胞形态重建中的作用,该实验着重研究Wnt信号通路变化。本研究结果表明,Wnt信号通路多个靶基因(N kx2.5, Sox9b, Axin2)受到抑制。N kx2.5在胚胎发育心脏祖细胞中高表达,而后在成年的心脏中维持较高水平,N kx2.5异常表达可导致心肌细胞凋亡数目增加和心功能障碍[17]。N kx2.5的显性突变在许多先天性心脏病中被报道,以房及室间隔缺损,法洛四联症为主要表型。N kx2.5参与心脏形成,在环化,心腔分化,间隔形成中起重要作用[18]。本研究结果显示N kx2.5显著减低,这提示心肌祖细胞分化可能受到影响,这与之前我们在细胞水平的研究结果一致[6]。后期我们仍需对N kx2.5影响祖细胞分化的分子机制进一步明确。
SOX和Axin2也都参与Wnt相关通路,经典途径中,GSK-3β通过Axin和APC结合形成的蛋白复合物磷酸化β-catenin而促使其经蛋白酶体降解。Wnt信号存在激活Wnt-Fzd信号通路, GSK-3β受到抑制,使得胞内游离β-catenin蛋白水平升高,继而进入核内激活转录因子表达[19]。CHIR为GSK-3的抑制剂,可以模仿经典Wnt信号激活。在本研究中观察到,加入CHIR可对心肌起到明显的保护作用,能够缓解TCE暴露下导致的心脏发育畸形,提示TCE暴露导致Wnt信号通路受抑制参与TCE介导心脏发育毒性的产生。为了进一步验证,我们加入XAV939, XAV939是小分子选择性抑制剂,通过稳定Axin和APC复合物促进β-catenin降解。本研究表明XAV本身即显著增加斑马鱼胚胎心脏畸形,XAV与TCE联合暴露更加剧了斑马鱼胚胎心脏畸形表型。
三氯乙烯通过抑制Wnt信号通路引起心脏发育相关基因表达改变,导致斑马鱼胚胎心脏畸形。本研究利用斑马鱼为模型,富集心脏,进行组织特异性信号通路分析,为水环境污染物TCE介导心脏发育毒性提供了新的研究靶点。

