2-12烷基-6-甲氧基环己基-2,5-二烯-1,4-二酮(DMDD)抗弥漫大B淋巴瘤的作用及机制*
洪 凯, 蒋盼若, 柯瑞君, 应佳豪, 张肖艳, 陈佳玉
(绍兴文理学院医学院, 浙江 绍兴 312000)
B淋巴瘤是起源于B细胞的肿瘤,包括霍奇金淋巴瘤和非霍奇金淋巴瘤两大类,其中弥漫性大B淋巴瘤(diffuse large B lymphoma,DLBCL)为非霍奇金淋巴瘤最常见的一个类型,其发病率占非霍奇金淋巴瘤的30 %~35 %[1]。DLBCL具有侵袭性和中高度恶性的特点,对患者的生命和健康危害极大。目前,利妥昔单抗加环磷酰胺、长春新碱、多柔比星和泼尼松(R-CHOP)作为DLBCL化疗的标准方案,尽管该方案可以延长患者的生存期,提高患者响应率(RR),但仍有超过30 % DLBCL患者对该方案治疗不敏感或者出现了抗药性[2]。因此我们需要开发更加有效,且毒性作用小的新药,以实现对DLBCL真正意义上的临床治疗。杨桃为广泛分布于东南亚的水果之一,其根作为治疗慢性阵发性头痛和关节痛的良药已有数千年的历史。DMDD为来源于杨桃根的苯醌类化合物,具有降血糖、抗脂质过氧化、诱导人乳腺癌凋亡、抑制肺癌和骨癌细胞扩散的作用[3]。但有关该药物是否具有抗DLBCL的作用一直未见报道。在本实验中,我们将杨桃根中苯醌类化合物2-Dodecyl-6-Methoxycyclohexa-2, 5-Diene-1, 4-Dione(DMDD)作用于DLBCL细胞OCI-LY19,探讨该药对OCI-LY19细胞的增殖和凋亡的影响,并分析其作用的相关机制,以期为临床治疗DLBCL的新药发现提供实验依据。
1 材料与方法
1.1 材料
DLBCL细胞株OCI-LY19购自于南京科佰生物科技有限公司;4周龄雄性BALB/C小鼠购于浙江省实验动物中心;DMDD源于上海摩贝生物科技有限公司;PCR引物由上海Sangon Biotech公司合成;一抗和酶标二抗源于武汉BOSTER Biotech公司;AnnexinV-FITC/PI双染试剂盒、PI单染试剂盒和脱脂奶粉为美国BD公司产品;Cell titer 96® AQueousNon-Radioactive Cell Proliferation Assay试剂盒来源于美国Promega公司;LDH试剂盒为上海Roche Applied Science公司产品;JC-1染色试剂盒由碧云天提供;胰酶、RPMI-1640细胞培养液、胎牛血清均于美国Gibco公司购买。ECL化学发光液购自美国SIGMA公司;SuperScript®III First-Strand Synthesis System和TRIzol源于美国Invitrogen公司。BCA蛋白浓度测定试剂盒、hoechst 33342和RIPA裂解液购自于上海Beyotime公司。
1.2 小鼠的抑瘤实验
取4周龄雄性BALB/C鼠100只,分为5组,每组20只,无菌条件下饲养一周以适应环境。取对数生长期的OCI-LY19细胞,600 g离心5 min,去上清,PBS清洗2次,每次600 g离心5 min弃上清,用生理盐水调整细胞浓度至1 × 107cells/ml,腹股沟注射BALB/C小鼠,0.1 ml/只,于肿瘤细胞接种的2 d后分别灌胃0、1、5、25、125 mg/kg剂量的DMDD,1次/2天,于首次给药后的第18日每组杀10只小鼠,其余小鼠仍旧正常饲养,记录其生存期。
1.3 细胞增殖实验
取对数增长期OCI-LY19细胞,用RPMI 1640完全培养液稀释成1×105cells/ml,加入96孔平底培养板,每孔100 μl,在37℃、5 % CO2和饱和湿度环境中培养24 h。离心弃上清(600 g/min,离心5 min),分别加入100 μl含有DMDD的RPMI 1640完全培养液,使药物终浓度分别为0 μmol/L、1 μmol/L、5 μmol/L、25 μmol/L和125 μmol/L,设三复孔。将细胞继续置于37℃、5% CO2和饱和湿度的环境中培养。分别于培养0、24、48和72 h时,取出细胞,于细胞上清液中加入Cell Titer 96®AQueousNon-Radioactive Cell Proliferation Assay试剂,20 μl /孔。37℃ 5% CO2条件下继续培养3 h,利用酶标仪检测各孔在490 nm波长下的吸光度值(OD值),绘制细胞生长曲线,分析药物作用后细胞的增殖情况。
根据细胞增殖实验结果,选择0 μmol/L、5 μmol/L和25 μmol/L的DMDD作为后续用药浓度作用OCI-LY19细胞24 h,通过流式细胞仪检测细胞凋亡率、hoechst 33342染色分析细胞核型变化、JC-1染色观察细胞线粒体膜电位的改变、LDH释放实验检测药物细胞毒作用、qPCR和Western blot分析细胞内各基因转录和表达水平的改变,分析药物作用的分子机制。
1.4 流式细胞仪检测OCI-LY19细胞凋亡率
取经过DMDD处理、培养24 h的OCI-LY19细胞,按美国BD公司的FITC和PI双染试剂盒的说明书进行染色,用流式细胞仪(美国BD公司)检测细胞凋亡水平。
1.5 Hoechst 33342染色分析OCI-LY19细胞核型变化
取经过DMDD处理、培养24 h的OCI-LY19细胞,PBS清洗3次,每次经600 g离心5 min回收细胞,于细胞沉淀中加入含有10 ng/ml hoechst 33342染液的PBS液1 ml,避光、室温染色15 min,经600 g离心5 min,弃上清,PBS清洗3次后(每次经600 g离心5 min回收细胞),将细胞置于载玻片上,于荧光倒置显微镜下观察细胞的核型变化。
1.6 JC-1染色观察OCI-LY19细胞线粒体膜电位的改变
取经过DMDD处理、培养24 h的OCI-LY19细胞,于各孔中分别加入0.5 ml JC-1工作液,37℃ 5% CO2避光孵育30 min,600 g离心5 min,弃上清,PBS清洗3次,每次均经600 g 离心5 min后弃上清。用0.5 ml RPMI-1640完全培养液悬浮细胞,静止5 min,在倒置荧光显微镜下观察并拍照,分析DMDD作用后OCI-LY19细胞线粒体膜电位的改变。
1.7 LDH释放实验检测DMDD对OCI-LY19细胞毒性作用
取经过DMDD处理、培养24 h的OCI-LY19细胞,600 g离心5 min,分离细胞和细胞培养上清,按照LDH检测试剂盒说明书分别检测细胞裂解液内和培养上清中LDH的浓度,并通过公式LDH释放率(%)=培养液中LDH含量 /(培养液中LDH含量+细胞裂解液中LDH含量)×100%计算LDH的释放率,分析DMDD对OCI-LY19细胞的细胞毒作用。
1.8 QPCR检测OCI-LY19细胞基因mRNA水平
取经过DMDD处理、培养24 h的OCI-LY19细胞,600 g离心5 min,弃上清,PBS清洗3次,每次经600 g离心5 min回收细胞,利用Trizol提取细胞RNA,并经Nano Drop定量后用SuperScript® III First-Strand Synthesis System逆转录成cDNA,试剂用量和操作均按说明书进行。以β-actin为内参,qPCR法检测caspase-3、bax、bcl-2、jak 1、jak 2、stat 3和iκBα基因mRNA的CT值,通过2-△△CT法进行数据分析,探讨DMDD作用后OCI-LY19细胞基因转录水平的改变。
1.9 Western blot检测OCI-LY19细胞蛋白水平
取经过DMDD处理、培养24 h的OCI-LY19细胞, 600 g离心5 min,回收细胞,PBS清洗3次,每次均经600 g离心5 min回收细胞。于细胞沉淀中加入细胞裂解液(1×107cells/ml),冰上裂解10 s, 12 000 g离心20 min。取上清1 μl进行BCA定量,其余按比例加入上样缓冲液,95℃煮沸5 min,待冷却后离心。按30 μg / 孔上样,以β -actin为内参进行蛋白电泳。其后,蛋白经湿转、封闭和一抗、酶标二抗孵育和ECL显色后,利用Image Quant LAS 4000 mini超灵敏化学发光成像仪进行图像采集,第一抗体和酶标二抗的稀释倍数均采用试剂说明书建议的稀释倍数的均值。
1.10统计学处理
2 结果
2.1 DMDD对 小鼠的抑瘤实验结果
0-125 mg/kg DMDD灌胃荷瘤小鼠,1次/2天,首次给药的第18日取瘤组织称重,结果如表1,与0 mg/kg DMDD治疗组相比较,DMDD可抑制OCI-LY19瘤组织的生长,且其抑制作用与该药作用的剂量有关,当DMDD用药剂量≥1 mg/kg时,其治疗效果尤其显著(P<0.01)。此外,表1结果证实,0~25 mg /kg DMDD治疗组荷瘤小鼠的生存期显著延长(P<0.01),当用药剂量达到125 μg /kg时,小鼠生存期虽较未用药组有所延长,但较5 mg/kg和25 mg/kg治疗组缩短。


DMDD dosageTumor tissues weight (g)Survival time (d)0 mg/kg 2.23±0.1024.0±0.11 mg/kg 2.04±0.0941.0±0.15 mg/kg 1.12±0.07∗∗67.0±0.1∗∗25 mg/kg 0.65±0.05∗∗117.0±0.1∗∗125 mg/kg 0.38±0.13∗∗52.0±0.2∗∗
**P<0.01vs0 mg/kg DMDD treated group
2.2 DMDD对OCI-LY19细胞增殖活性的影响
如图1所示,DMDD作用后,OCI-LY19细胞的增殖活性明显受抑制(P<0.01),且抑制程度与药物作用的浓度和时间有关。
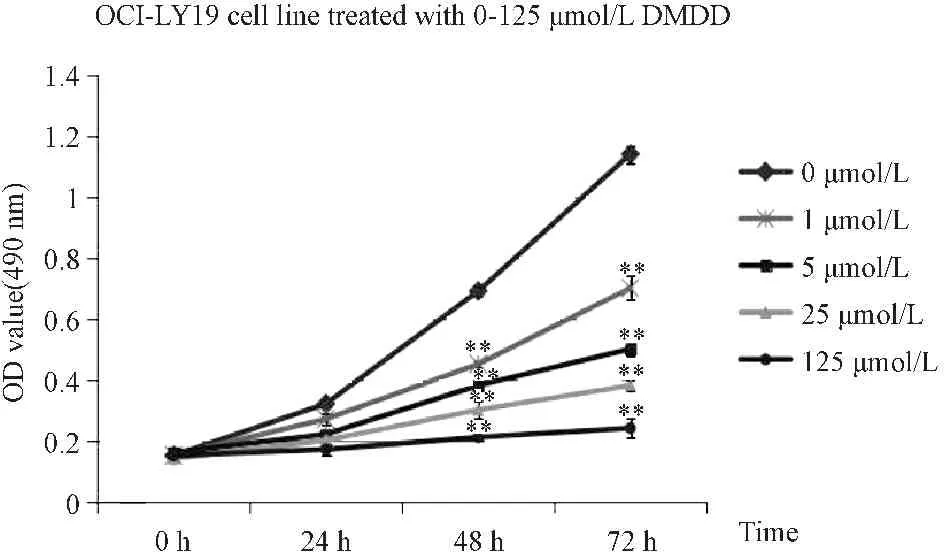
Fig.1The proliferation activity results of OCI -LY19 cells (n=3)
**P<0.01vs0 μmol/L DMDD group
2.3 DMDD对OCI-LY19细胞凋亡的影响
流式细胞仪检测结果显示(图2),OCI-LY19细胞经5 μmol/L或25 μmol/L DMDD作用24 h后,细胞凋亡水平分别为21.40%±0.06%和55.30%± 0.09%,较未用药的对照组(0.20%±0.02%)显著增加(P<0.01),且其作用效果与用药剂量相关。

Fig.2The apoptosis of OCI -LY19 cells detected by flow cytometry (n=3)
2.4 DMDD对OCI-LY19细胞核变化的影响
结果如图3所示,OCI-LY19细胞经5 μmol/L或25 μmol/L DMDD作用24 h后,细胞核出现凝集、碎裂的现象,且出现了凋亡小体。细胞发生核型改变的比率与药物作用的剂量有关。

Fig.3The results of Hoechst 33342 staining (n=3)
2.5 DMDD对OCI-LY19细胞线粒体膜电位的影响
结果如图4所示,OCI-LY19细胞分别经0、5或25 μmol/L DMDD作用24 h后,细胞线粒体膜电位显著下调,且其下调水平与药物作用的剂量有关。
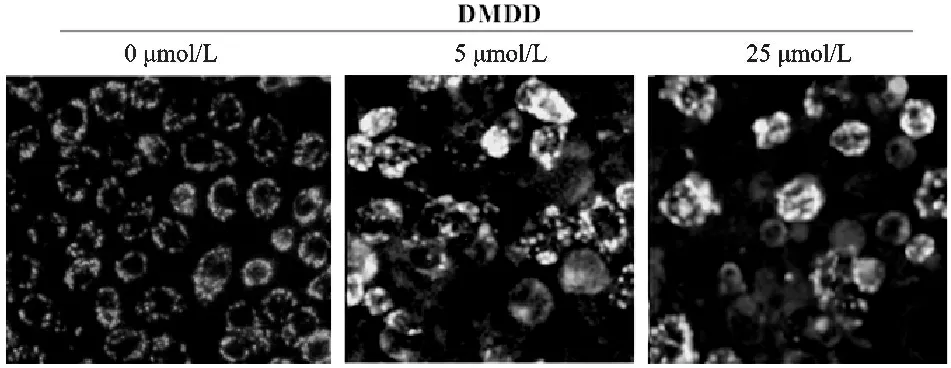
Fig.4JC -1 staining results of cell mitochondrial membrane potential (n=3)
2.6 DMDD对OCI-LY19细胞LDH释放率的影响
实验结果如表2所示,随着DMDD作用浓度的增高,培养液中LDH释放的水平也较对照组显著增加(P<0.01),细胞损伤情况与DMDD的用药浓度有关。
Tab.2The results of LDH release experiment (n=3)

DMDD dosageMedium LDH (%)0 μmol/L1.45±0.02 5 μmol/L18.37±0.03∗∗25 μmol/L27.44±0.05∗∗
**P<0.01vs0 μmol/L DMDD treated group
2.7 DMDD对OCI-LY19细胞基因mRNA水平的影响
QPCR检测结果显示(表3),25 μmol/L DMDD作用OCI-LY19细胞24 h后,细胞内caspase-3和bax基因mRNA水平较对照组明显上调,而基因bcl-2、bcl-xl、jak 1、jak 2、stat 3和iκBα转录水平均显著下降(P<0.01)。
2.8 DMDD对OCI-LY19细胞蛋白表达水平的影响
OCI-LY19细胞经0 μmol/L、5 μmol/L、25 μmol/L DMDD作用24 h后,p-IκBα、Caspase-3和BAX的水平较0 μmol/L DMDD作用组显著增加,而BCL-2、JAK2和STAT3等的水平明显下调(P< 0.01,图5,表4)。

Fig.5The Western blot results of the proteins from OCI-LY19 cells after treated with 0 μmol/L, 5 μmol/L or 25 μmol/L DMDD for 24 h

Tab. 3 The real time PCR results (n=3)
**P<0.01vs0 μmol/L DMDD treated group

Tab. 4 The Western blot results of the proteins from OCI-LY19 cells (n=3)
**P<0.01vs0 μmol/L DMDD treated group
3 讨论
细胞凋亡是由一系列基因控制的细胞自主有序的死亡方式,B细胞凋亡障碍是因为B细胞中某些细胞凋亡相关基因的表达水平发生变化,从而B细胞会无限增殖,最终导致B细胞淋巴瘤的发生[4]。因此,如能发现逆转DLBCL凋亡障碍的新药,则必将有助于DLBCL的临床治疗。
本研究将不同浓度的DMDD作用于DLBCL细胞株OCI-LY19和接种有OCI-LY19细胞的BALB/C裸鼠,结果发现,DMDD可显著抑制OCI-LY19细胞的增殖活性,诱导其凋亡,下调细胞线粒体膜电位,发挥明显的细胞毒作用。同时该药能够抑制荷瘤小鼠DLBCL组织的生长、延长了荷瘤小鼠的生存期。QPCR和Western blot检测发现,DMDD明显上调了OCI-LY19细胞内caspase-3和bax基因的转录、表达水平和IκBα的磷酸化,抑制了bcl-2、bcl-xL、jak2和stat3基因的转录和表达。
JAK2和STAT3蛋白为JAK / STAT信号通路的主要成员,JAK2基因的表达受抑,则将直接抑制了STAT3的表达及其磷酸化[5],从而减少了转位到核的p-STAT3与IRF9的复合物,并进一步影响了作为凋亡调控关键因素的BAX与BCL-2(或BCL-xL)的构成比例。资料显示,当BAX与BCL-2(或BCL-xL)形成同源二聚体时可诱导细胞凋亡,而形成异源二聚体时则细胞凋亡受抑制[6],因此BCL-2 / BAX(BCL-xL / BAX)也被称为启动细胞凋亡的“分子开关”[7,8]。本实验中,DMDD通过抑制JAK 2 / STAT 3信号通路而打破了OCI-LY19细胞原有的BAX和BCL-2(或BCL-xL)间的平衡,BAX表达上调,而BCL-2和BCL-xL的表达显著受抑,促使细胞朝形成BAX同源二聚体发展,线粒体内凋亡因子释放,线粒体通透性改变、膜电位下降,细胞凋亡过程中最重要的终末剪切酶Caspase-3活化[9],进而引起细胞广泛的损伤和变性[10],最终导致OCI-LY19细胞凋亡的发生[11]。
此外,NF-κB通路中的关键蛋白NF-κB和IκBα与DLBCL细胞的增殖和凋亡紧密相关[12]。IκBα为IκBs的主要成员,有研究表明它在调控NF-κB激活的经典途径中扮演着重要角色[13,14],当细胞未受到刺激时,大部分的NF-κB二聚体通过与细胞质中抑制因子IκBα等结合而以无活性的状态存在。在本实验中,当DLBCL细胞OCI-LY19经DMDD作用后,细胞内p-IκBα水平增加,从而抑制了NF-κB的活化,并进一步减弱了NF-κB对BCL-2基因表达的刺激作用[15],致使BCL-2 / BAX的比例发生改变[16],最终在与JAK 2 / STAT 3信号通路蛋白共同作用下,加速了OCI-LY19细胞的凋亡。
总之,DMDD可以抑制荷瘤小鼠瘤组织的生长,延长其生存期,并通过影响OCI-LY19细胞JAK2 / STAT3和NF-κB信号通路,下调BCL-2 / BAX、活化Caspase-3,进而激活OCI-LY19细胞线粒体凋亡的内源性通路,从而发挥其抗DLBCL的作用。该研究为探讨DMDD在DLBCL临床治疗中的进一步应用提供了一定的实验依据。

