癫痫模型大鼠海马CA1网络theta节律断裂的观察*
杨明浩, 葛曼玲, 付晓璇, 黄贤冲, 崔家俊, 郭志彤, 张夫一
(河北工业大学电气工程学院, 省部共建电工装备可靠性与智能化国家重点实验室, 河北省电磁场与电器可靠性重点实验室, 天津 300130)
癫痫(epilepsy)是大脑神经元突发性异常放电,导致短暂的大脑功能障碍的一种慢性疾病[1]。发作间期活动(interictal-like activity, ILA)是癫痫发展过程(epileptogenesis)的重要特征,与神经回路有关[2,3]。在颞叶癫痫(temporal lobe epilepsy, TLE)的实验大鼠模型中,ILA多出现在早期阶段[3-5],这表明致癫痫网络的构建直接与ILA有关[6],同时ILA可用来预测癫痫的发展[7]。ILA的反致痫作用也被提出[8,9]。一般来说,ILA与谷氨酸回路、GABA能回路以及两种回路之间的不平衡有关[2]。ILA与各种类型癫痫中抑制性GABA能神经元的兴奋性和动作电位放电选择性丧失也有关[10],ILA传导还随GABA能所介导的抑制作用不同而有所差异[10,11]。此外,癫痫中具有重要特征的病态信号散发性尖波(sporadic spikes, SSs)是由海马CA1区在癫痫发生过程中兴奋性和抑制性突触间的不平衡所造成[11]。对动物模型和癫痫患者的研究表明:ILA可打断认知节律,如内侧颞叶(MTL)中的theta节律。
theta振荡作为哺乳动物脑神经网络里最主要的神经元同步化活动的一种,是空间导航和定位、学习、记忆的重要信号频率,也是研究认知和颞叶癫痫作用机制的关键信号之一。海马结构系大脑半球皮质内侧缘的部分,属于古老皮质,海马CA1区的功能主要与空间记忆有关。嗅行时大鼠的海马CA1区含有丰富的theta节律,此外,theta节律的断裂可能与海马区主要神经元和中间神经元的消亡有关[12-16],从而造成颞叶癫痫患者(TLE)的认知缺陷,如空间记忆和工作记忆等障碍[12,14]。
前期,我们在匹罗卡品(pilocarpine)致痫嗅行大鼠模型上,应用脑深度电极记录(SEEG)研究了海马CA1区ILA对theta节律的瞬时抑制作用,发现:ILA在早期对theta能量和相位稳定性损伤最为严重。SSs是ILA的一种形式,以相邻尖波之间(尖波间期)持续时间较长、并在尖波期后伴随较长时间无尖波恢复期为特征,常用来研究癫痫尖波与认知状态、癫痫波形态和癫痫发生过程等因素对脑功能的影响[15]。最近,我们通过时频分析的量化评估技术,对处于安静休息状态的4位TLE患者立体定向脑电(SEEG)的发散性尖波在海马区CA3和嗅皮层EC脑区的theta节律进行研究,发现:尖波对theta能量有瞬态的削减作用,并且,尖波间期theta节律的断裂与这种削减作用成正比[17]。Theta断裂自1978年由Winson在大鼠模型上发现并发表在Science上以来[14],一直没能很好地开展下去,癫痫尖波何时打断theta节律以及癫痫发展进程中theta节律断裂的规律是什么等问题尚没有很好地解决,主要原因是缺少实验数据。借鉴立体定向脑电技术,本文使用了癫痫发展进程中匹罗卡品颞叶癫痫大鼠模型,在尖波间期和无尖波恢复期分别研究了癫痫早期和晚期theta节律断裂的规律。本文为癫痫对认知节律的抑制作用提供了分析依据,对揭示癫痫与认知的关系具有重要临床意义。
1 材料与方法
1.1 材料
法国马赛地中海大学神经科学研究室提供了颞叶癫痫大鼠模型的相关信息和实验数据。
14只成年Wistar大鼠,均为雄性,体质量(225±20)g。大鼠分笼饲养,室温(20±3) ℃,相对湿度40%~60%。
1.2 实验的分组与处理
将大鼠在麻醉状态时进行开颅手术,将1只直径约为 0.8 mm的双极性钢电极埋入海马区的背侧,在大鼠颅骨上,将3个不锈钢皮质电极植入,在其右额皮质和左额皮质,分别将两只电极植入。小脑埋入参考电极,随后将颅骨粘合,检测、记录大鼠脑电图;之后腹腔注射癫痫诱发药物:匹罗卡品氢氯化物(pilocarpine hydrochloride,310 mg/kg)、30 min后注射大鼠莨菪碱 (scopolamine, 1 mg/kg)。详细手术过程见 Chauviere 等[13]。当首次在与脑电同步的视频监视仪上观察到大鼠出现癫痫持续状态 (status epilepticus, SE)时,同时在EEG(DeltamedTM)上观察到持续的高振幅放电,40 min 后注射安定;癫痫发生早期大多出现在癫痫持续状态后4~10 d,通过在视频监视仪上观察大鼠行为同时在EEG上观察大鼠脑电图,发现发作间期活动 (interictal-like activity, ILA) 在7 d后才正式建立起来,本文定义7 d(7D)为癫痫发展进程的早期。在癫痫持续状态后14~16 d,大鼠又一次出现自发放电,此时EEG为发作间期活动 (interictal activity, IA),对应于癫痫持续状态后25~40 d为癫痫发展进程的晚期,本文取25 d(25D)。其中研究7 d的大鼠有6只,25 d的大鼠有5只,注射前(BI)和7 d,25 d无尖波恢复期的大鼠均是3只。所有分析以1 h数据为一个记录段。因为在早期,ILA放电不频繁,一天中在每只大鼠上至少取2个记录段用于计算。但在晚期,ILA放电频繁,一天中在每只大鼠上取 1 个记录段用于计算。总之,保证在每只大鼠上所取的记录段总数比较均匀,即每只大鼠尖波总数至少大于30段。D7在6只大鼠脑电上取了224个尖波,尖波间期持续的最长和最短时间分别是14.21和3.7 s;D25在5只大鼠脑电上取了290个尖波,尖波间期持续的最长和最短时间分别是12.89 s和3.56 s。尖波脑电后有较长时间的无尖波恢复期,尖波脑电后2 h后取一个记录段。文章的记录段皆为白天,无夜间睡眠节律的影响。D7在3只大鼠上取恢复期脑电,最长和最短计算时间分别是20.37 s和5.14 s;D25也在3只大鼠上取恢复期脑电,最长和最短计算时间分别是18.65 s和4.96 s。最后需要说明的是,注射前在3只大鼠取脑电,最长和最短计算时间分别是35.38 s和7.69 s。
1.3 大鼠脑电极植入的方法与脑电图的观察
Gabor小波变换能够较好地兼顾信号在时域和频域中的分辨率,可获取theta节律的时频能量,并可直接观察theta节律是否具有时间连续性。Gabor小波变换可用下式描述:
(1)
公式中,复数Wx(t0,f)代表信号x(t)在频率为f时间为t0时刻的正交信息,η代表中心频率,复数Wx(t0,f)实部和虚部的平方和为小波能量值。选取3.5 s计算时长,选取的时长和之前的研究一致[15、17],可获得Gabor小波时频能量。当进行能量分析时,小波能量对段平均,可直接观察theta能量在尖波附近的动态变化。在时频分析图中,当能量突然消失或变得很低,成为背景颜色时,当背景颜色持续时间达到200 ms及以上时认为该段(以350 ms为一段)节律出现断裂,选取的时长和之前在癫痫尖波附近350 ms的研究一致[15,17]。计算断裂的段数与总段数的比值,定义为theta节律断裂比,用来衡量尖波间期或无尖波恢复期theta节律断裂程度。本文以t检验为统计学差异。
没有伪差的脑电图中,尖波幅值要高于内在 EEG (intrinsic EEG) 幅值的10倍以上。为获取内在脑活动,需要去除尖波的作用,尖波的开始和结束由起始点(onset)和终止点(offset)由经验丰富的法国神经学专家根据EEG上癫痫尖波前后基线 (baseline) 来确定。在尖波间期,我们选取D7和D25的每只大鼠的前一个尖波的offset到后一个尖波的onset的时间序列;在注射前和无尖波恢复期,我们遍历了每只大鼠嗅行时脑电的时间序列,如图1所示。值得说明的是那些幅度较小的尖波(如图1C所示)也会对theta节律断裂分析造成影响需要去除:在脑电分析软件EEGLAB中找到小尖波对应的时间刻度,换算成在小波时频能量对应的时间刻度,在进行能量分析时,去除该时间段,就可以去除这个小尖波的影响。文章所用段数归纳如下(表1):在尖波间期,D7一共419段,发生断裂数是126段;D25一共3729段,发生断裂数是906段;注射前一共1290段,发生断裂数是75;在无尖波恢复期,D7一共420段,发生断裂数是98段;D25一共270段,发生断裂数是61段。
2 结果
2.1 尖波间期theta节律断裂
D7的尖波间期的波形图和对应的theta节律时频能量图如图所示(图2A上),与注射前相比,此期间的theta节律能量断裂比相较于注射前增加了近6倍,如表格1所示。而D25(图2A下),尽管与注射前相比,theta节律仍然有很大的断裂程度,但是相对于D7来说,断裂程度趋缓,断裂比降低了6%左右(表1)。此外,尖波间期发生较大程度的theta节律断裂表明尖波是导致theta节律断裂的直接原因。

Fig.1EEG during epileptogenesis
A: Period between two adjacent spikes; B: Before-injections(BI) period and recovery period without spikes; C: EEG connotative a tiny spike(between two gray lines)
2.2 无尖波恢复期theta节律断裂
注射前脑电波形和theta节律时频能量表现为能量连续和良好的质量,发生断裂的段数比较少,断裂情形微乎其微,如图所示(图2B上),反映出健康大鼠theta节律呈现良好状态,断裂比仅5.81%,如表1所示。D7的无尖波恢复期脑电出现较大比例的theta节律断裂(图2C上),断裂比高达 27.14%,与D7的尖波间期相当。
D25的无尖波恢复期的断裂程度(图2C下)却较D7有所降低(22.59%),如表1所示,但与D25的尖波间期相当。
3 讨论
本文分析了颞叶癫痫大鼠在尖波间期和无尖波恢复期theta节律断裂在癫痫发展进程中的规律,得出如下结论:(1)癫痫尖波是theta节律断裂的直接原因;(2)即便是在无尖波恢复期,theta节律断裂仍然持续。
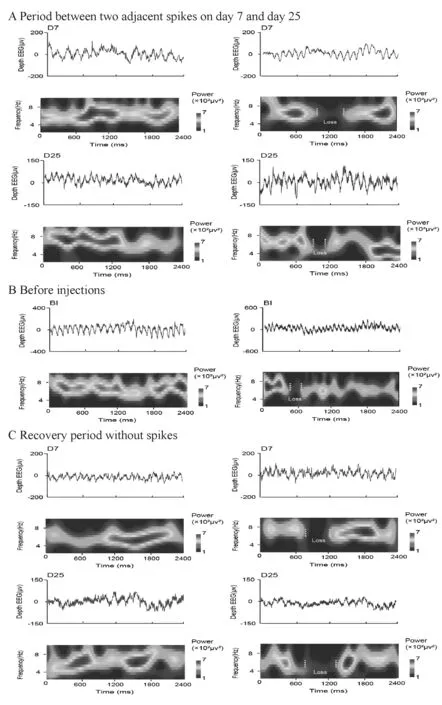
Fig.2Examples of theta rhythms continuity and breakage in EEG and time-frequency plane during each period
A: Period between two adjacent spikes on day 7 and day 25; B: Before injections; C: Recovery period without spikes
Tab.1The numbers of disrupted theta rhythms and breakage ratio(%) in different periods

Before injectionsInterspike periodRecovery period without spikesD7D25D7D25Loss7512690611461Breakage ratio(%)5.8130.7024.3027.1422.59
在癫痫网络中,突触驱动的不平衡是产生癫痫尖波的主要原因,它使得网络易于产生癫痫发作,并便于癫痫波的传导[3],以持续增强的兴奋性或持续降低的抑制性为特征的网络超兴奋 (hyper-excitation)状态是这种不平衡作用的主要结果。尖波间期theta节律的断裂很可能与这种不平衡所产生的影响有关。在D7,尖波对慢GABA能神经元的抑制性造成很大的伤害[3],致使GABA能网络交互性大大降低,导致theta节律断裂比很大。相反,在D25,谷氨酸突触调制作用有所增强[3,18],即兴奋性有所增强,因此,断裂比相对D7有所减小。本文揭示的早期theta节律断裂最为严重的分析结果与Chauvièha等发现的癫痫早期大鼠对空间位置记忆功能受伤害最大有关联[13],也与我们前期在尖波附近瞬态(350 ms)分析得出的规律是一致的[15,16]。此外,研究表明:嗅行速度和焦虑情绪等因素会影响theta节律,Chauvièha等研究说明了癫痫发生晚期比早期嗅行速度要低,与本文分析的theta节律的断裂趋势一致,但在注射前大鼠嗅行速度更低,而本文分析的theta节律断裂较少,具有良好的质量,因此,嗅行速度和焦虑情绪不是导致theta节律断裂的直接因素,癫痫形成了CA1神经元网络超同步是主要原因。本文研究结论和癫痫导致的神经元损伤会导致海马theta节律能量降低直至断裂的结论是一致的[10,11]。文章所取无尖波期为发散尖波停止出现后的一段1 h脑电,在这1 h时间内不仅没有尖波发放,也没有bursts发放,更没有seizures,我们断定该无尖波期theta节律的断裂由前面的尖波引起。无尖波恢复期theta节律断裂与尖波间期相当,可能与癫痫导致CA1网络重组有关[19],尽管此期间没有尖波,但重组了的CA1网络状态无法恢复,导致theta节律的损伤持续。今后的工作将在虚拟脑模型上用理论方法研究theta节律断裂的深层机制。

