阿帕替尼联合替吉奥治疗老年晚期胃癌血清肿瘤标记物水平的变化情况
路静,岳桂敏
河南省安阳市第六人民医院,河南 安阳 455000
胃癌在癌症致死肿瘤疾病中位居第三位,每年全球可新增100万例患者,35%左右发生在中国[1]。胃癌在我国恶性肿瘤发病率中占第二,而死亡率占第三,有研究发现大部分胃癌患者确诊时已处于局部晚期或全身多处转移情况,错过手术治疗时机。对于晚期胃癌患者,化疗治疗可延长生存期并改善生活质量,但中位生存期仍不超过1年,且随着化疗治疗延长,不良反应发生率相应增加。随着分子生物学发展,一种新型治疗方式逐渐兴起,即肿瘤分子靶向治疗,其通过小分子药物等阻断患者体内癌细胞异常活化或过度表达的相关路径达到治疗目的[2]。替吉奥是常见的化疗药物[3],阿帕替尼则是一种抗血管生成的小分子靶向药物,两者联合治疗报道较少。基于此,本研究通过采用阿帕替尼联合替吉奥治疗老年晚期胃癌,旨在探究联合治疗效果。
1 资料及方法
1.1 一般资料选择医院2016年1月到2018年1月就诊晚期胃癌患者100例,按治疗方式分为对照组组及观察组,各50例。对照组男性26例,女性24例;年龄65~80岁,平均(73.12±7.48)岁;肿瘤位于胃底部5例,胃体部24例,胃窦部21例;组织高分化2例,中分化19例,低分化29例;腹膜转移9例,肝脏转移4例;血清甲胎蛋白(alpha fetoprotein,AFP)正常44例,异常6例;均为腺癌;合并冠心病20例,糖尿病13例。观察组男性25例,女性25例;年龄65~79岁,平均(73.20±7.51)岁;肿瘤位于胃底部6例,胃体部25例,胃窦部19例;组织高分化3例,中分化20例,低分化27例;腹膜转移10例,肝脏转移5例;血清AFP正常42例,异常8例;均为腺癌;合并冠心病19例,糖尿病11例。两组人员肿瘤位置、转移情况等一般资料可比,差异无统计学意义(P>0.05)。
1.2 纳入、排除标准纳入标准:①根据病理学检查确诊为胃癌患者,患者均为无法手术治疗、复发转移的晚期患者,有至少一个可测量病灶;②预计生存期超过3个月,卡氏评分(Karnofsky’s performance scoring,KPS)在60-80分范围内,年龄不低于65岁;③患者及家属知情并签署知情同意书。
排除标准:①骨髓储备异常者;②肝肾功能严重障碍患者;③心脑血管疾病患者;④对所用药物过敏者;⑤合并其他恶性肿瘤患者;⑥精神疾病者;⑦合并影响药物吸收疾病,如慢性腹泻、肠梗阻等患者;⑧血液系统疾病患者;⑨伴有症状的中枢神经系统转移患者;⑩化疗禁忌证;k靶病灶有放疗史者;l近3个月有化疗史患者。
1.3 治疗方法两组患者均给予基础治疗,如保肝、止吐等,对照组给予替吉奥治疗,按照患者体表面积给药:体表面积小于1.25m2,40mg/次,2次/d;体表面积在1.25m2~1.50m2,早上40mg/次,晚上60mg/次;体表面积超过1.50m2,60mg/次,2次/d;所有患者治疗14d,休息14d,28d为一个疗程。观察组在对照组基础上服用阿帕替尼,初始剂量500mg/次,按照患者耐受情况增加至850mg/次,1次/d,共治疗28d为一个疗程。两组患者均治疗3个疗程后复查。
1.4 观察指标①采用微粒子化学发光免疫法检测两组患者治疗前后血清癌胚抗原(carcinoembryonic antigen,CEA)、糖类抗原199(carbohydrate antigen 199,CA199),检测采用贝克曼库尔特DXI800全自动免疫发光分析仪及其配套试剂;②采用酶联免疫吸附法检测两组患者治疗前后肿瘤坏死因子(tumor necrosis factor-α,TNF-α)、γ-干扰素(γ-interferon,IFN-γ),试剂盒购于上海通用乐生公司;③统计两组患者疗效,参照实体瘤疗效评价标准,可分成完全缓解、部分缓解、疾病稳定及疾病进展,治疗有效率=(完全缓解+部分缓解)/总例数×100%,疾病控制率=(完全缓解+部分缓解+疾病稳定)/总例数×100%;④统计两组患者治疗期间不良反应发生率。
1.5 统计学方法本文数据采取统计学软件SPSS17.0进行处理,计量型研究数据符合正态分布且方差齐采用t检验,不满足使用Mann-Whitney U检验;计数型数据无序分类采用卡方检验,P<0.05表示有统计学意义。
2 结果
2.1 两组患者血清肿瘤标记物水平比较两组患者治疗前血清肿瘤标记物水平无明显差异,差异无统计学意义(P>0.05);观察组治疗后CEA、C A199均低于对照组,差异有统计学意义(P<0.05);详见表1。
2.2 两组患者细胞因子水平比较两组患者治疗前细胞因子无明显差异,差异无统计学意义(P>0.05);观察组治疗后TNF-α、IFN-γ均高于对照组,差异有统计学意义(P<0.05),详见表2。
表1 两组患者血清肿瘤标记物水平比较(±s)Tab 1 Comparison of serum tumor markers between two groups(±s)
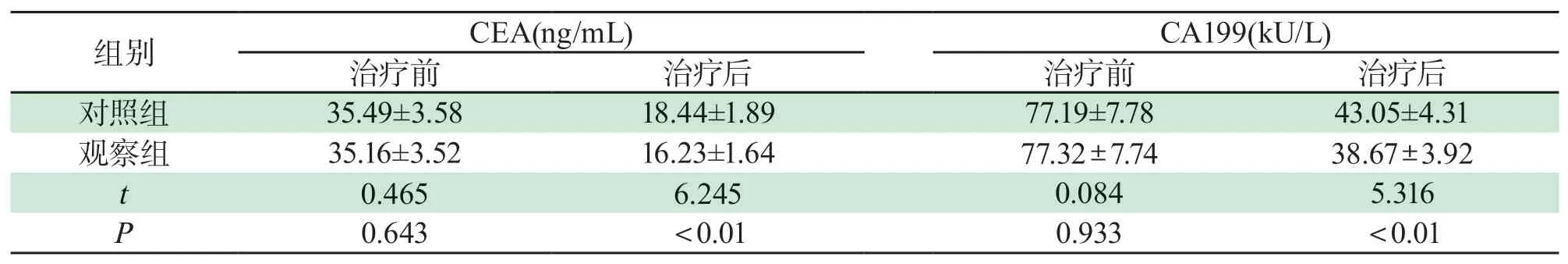
表1 两组患者血清肿瘤标记物水平比较(±s)Tab 1 Comparison of serum tumor markers between two groups(±s)
表2 两组患者细胞因子水平比较(±s,pg/mL)Tab 2 Comparison of cytokine levels between two groups(±s,pg/mL)
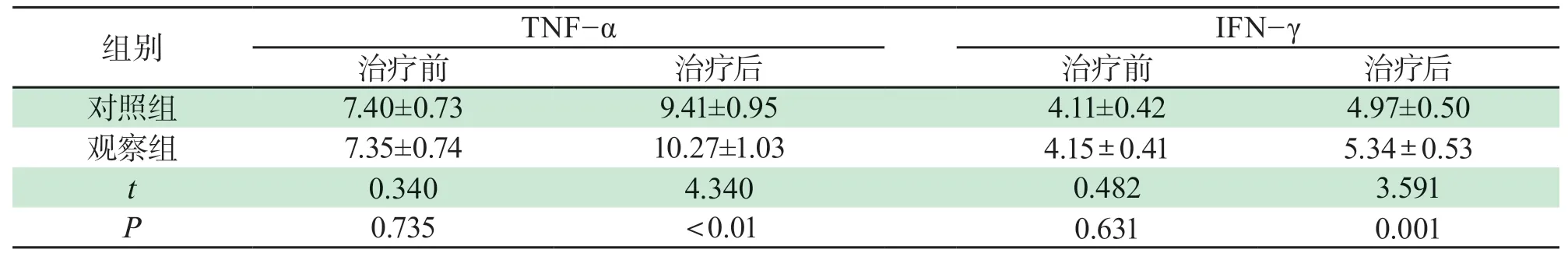
表2 两组患者细胞因子水平比较(±s,pg/mL)Tab 2 Comparison of cytokine levels between two groups(±s,pg/mL)
2.3 两组患者疗效比较观察组治疗有效率(46.00%)及疾病控制率(82.00%)均高于对照组(26.00%及64.00%),差异有统计学意义(P<0.05),详见表3。
2.4 两组患者不良反应发生率比较观察组蛋白尿发生率(16.00%)高于对照组(0.00%),差异有统计学意义(P<0.05);两组患者其他不良反应发生率无明显差异(P>0.05);详见表4。
3 讨论
机体中Th细胞可分为Th1及Th2两种,Th1分泌TNF-α、IFN-γ等细胞因子,主要参与细胞免疫;Th2分泌白细胞介素等细胞因子,主要参与体液免疫[4]。对于肿瘤患者,Th1细胞因子可对其产生间接杀伤作用。CEA源自大肠癌组织,属于广谱肿瘤标志物;CA199则是糖脂类抗原,在胃癌患者血清中异常表达[5]。
分子靶向治疗是新型治疗癌症的方式,目前的研究方向多集中于抗人表皮生长因子受体及血管内皮生长因子(vascular endothelial growth factor,VEGF)血管内皮生长因子受体(vascular endothelial growth factor receptor,VEGFR)两条通路,其中VEGF信号通路是重要的血管生成通路,而血管生成也是肿瘤生长的重要环节;在VEGF众多亚型中,与肿瘤病理中血管生成关系最紧密的是VEGF-A及VEGFR-2。阿帕替尼是国内自主研发出的靶向抗血管生成药物,是一种络氨酸激酶的小分子抑制剂,可与VEGFR-2特异性结合,通过竞争关系抑制VEGFR-2与VEGF结合,从而抑制VEGFR-2磷酸化,阻断下游信号传导,最终达到抑制患者体内肿瘤组织生成血管目的[6]。阿帕替尼还具有上调抑制细胞周期蛋白表达作用,可阻滞细胞周期。
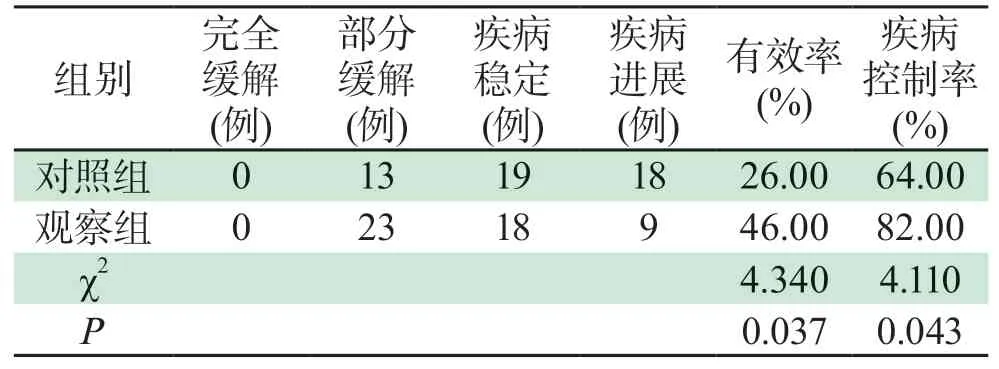
表3 两组患者疗效比较[例(%)]Tab 3 Comparison of curative effect between two groups[cases(%)]
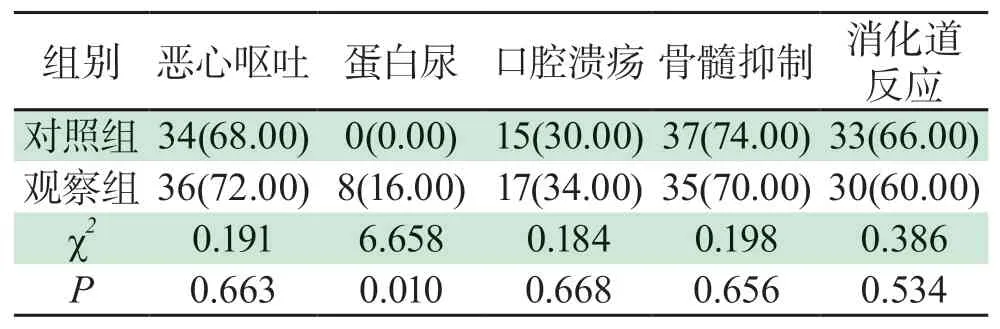
表4 两组患者不良反应发生率比较[例(%)]Tab 4 Comparisons of adverse reactions between the two groups[cases(%)]
本研究采用阿帕替尼联合替吉奥治疗晚期胃癌血清肿瘤标志物水平更低,可能原因为阿帕替尼可有效抑制肿瘤组织中血管生成,从而减少肿瘤标志物水平。艾良等[7]研究发现阿帕替尼联合替吉奥治疗晚期胃癌治疗后CEA及CA199水平均低于对照组。本研究采用阿帕替尼联合替吉奥治疗晚期胃癌细胞因子水平更高,可能原因为阿帕替尼抑制肿瘤组织细胞增殖及血管生成,改善病情,黄毅超等[8]研究发现采用阿帕替尼联合替吉奥治疗晚期胃癌TNF-α、IFN-γ低于对照组。本研究采用阿帕替尼联合替吉奥治疗晚期胃癌治疗有效率更高,疾病控制率更高,说明两者联合治疗效果更好。本研究采用阿帕替尼联合替吉奥治疗晚期胃癌发生蛋白尿比例高于对照组,可能原因为VEGF/VEGFR通路可调节肾小球血管通透性,该通路被抑制后可能破坏患者肾小球上皮细胞及内皮细胞,但症状较轻,患者可耐受。
综上所述,本研究采用阿帕替尼联合替吉奥治疗晚期胃癌血清肿瘤标志物水平更低,免疫细胞因子水平更高,疗效更好,无严重不良反应。

