水液相环境下苯丙氨酸分子的手性对映体转变机理
马宏源,张林佳,姜春旭,马梓瑄,佟 华,2,王佐成,2
(1.白城师范学院 物理与电子信息学院,吉林 白城 137000; 2.白城师范学院 理论计算中心,吉林 白城 137000;3.白城师范学院 传媒学院,吉林 白城 137000)
苯丙氨酸(phenylalanine; Phe)是一种人体必需氨基酸,是蛋白质的重要成分.根据构型的不同可分为S-型(S-Phe)和R-型(R-Phe),根据旋光性的不同可分为左旋体(L-Phe)和右旋体(D-Phe).在生命体内苯丙氨酸可以控制肿瘤的转移,左旋体具有活性,还可用作动物饲料和人类食品的添加剂[1].右旋体可用于治疗阿尔茨海默病,也是重要的化工和生物制药的原料[2].左旋体可从生物中提取,价格较低.而右旋体可利用不对称合成或外消旋体拆分技术获得.不对称合成方法成本高,手性拆分也会得到左旋体,因此使左旋Phe消旋获得右旋体具有重要意义.文献[3-6]报道,目前在动物体内已经发现右旋-丙氨酸和右旋-苯丙氨酸等多种氨基酸的右旋体.关于生命体内右旋-氨基酸的来源,目前的实验研究[7-8]认为体内左旋氨基酸的消旋是主要来源,但反应机理尚不十分清楚.
基于以上原因,人们对氨基酸的旋光异构及手性对映体转变进行了大量研究.文献[9-10]基于密度泛函理论研究了缬氨酸(Val)的旋光异构,结果表明,在激发态及水汽环境下Val可以实现手性对映体转变.文献[11-15]基于密度泛函理论的B3LYP方法和从头算的MP2方法研究了丙氨酸分子的手性对映体转变,研究表明,丙氨酸(Ala)的手性对映体转变有4个反应通道,以氨基氮为质子转移的通道具有优势,在水分子催化、纳米限域催化和氢氧根水分子簇催化时Ala可以实现手性对映体转变.
然而,关于Phe分子手性转变的研究并不深入,文献[16-17]采用密度泛函理论的B3LYP方法,对Phe分子的旋光异构及水分子的作用进行了研究,结果表明,质子以氨基氮做迁移桥梁,S-Phe可以旋光异构,但没给出其手性对映体转变的机理,不能解释生命体内S-Phe的手性对映体的存在.文献[18]基于密度泛函理论的WB97X-D方法和从头算的MP2方法,研究了气相Phe分子的手性对映体转变及水汽环境下水分子(簇)的作用,结果表明,气相Phe分子的手性对映体转变需越过很高的能垒,通常很难实现,水分子(簇)的催化可以实现Phe分子的手性对映体转变.然而,生命体内的Phe分子是处在水液相环境中,通常的化学反应也多数是在水溶剂中进行.在液相水中的水分子也是以水簇的形式存在[19].因此水液相环境下苯丙氨酸分子的手性对映体转变的研究具有重要意义.基于此,本工作对标题反应进行了比较详细的研究.
1 研究与计算方法
Phe分子存在氨基与羧基间以及氨基与苯环间的氢键,研究水分子(簇)的作用时,Phe分子与水分子间存在氢键.为较好地处理这些氢键作用以及水溶剂效应,本工作采用色散校正密度泛函WB97X-D方法[20]结合自洽反应场理论的SMD模型方法[21],在SMD/WB97X-D/6-311++G(d,p)水平全优化水液相环境下水分子及2个水分子簇(二聚水)的构象和S-Phe分子手性对映体转变反应过程中的各驻点,同时获得它们的零点振动能校正.为确认过渡态[22]的可靠性,在上述理论水平对过渡态进行IRC(内禀反应坐标)[23]计算.为得到反应过程更加可靠的势能面,采用从头算的MP2方法[24],在SMD/MP2/6-311++g(3df,2pd)水平计算相关分子结构的单点能,用Gtotal=EZPV+ESP计算驻点总能(EZPV和ESP分别为零点振动能校正和单点能).S-Phe分子与2个水分子簇形成的络合物,记作S-Phe·(H2O)2(m、n、u和v),m、n、u和v表示水分子(簇)在S-Phe分子的前面、后面、上面和右面,其他体系用相似的形式表示.所有计算工作由Gaussian09[25]程序在白城师范学院理论计算中心完成.
2 结果与讨论
在SMD/WB97X-D/6-311++G(d,p)水平优化文献[16]的最稳定构型,得到水液相环境下S-Phe及其手性对映体R-Phe的构象见图1,图中(b)和(c)只是视角不同,便于读者从不同的方位和角度观察S-Phe与R-Phe的镜像对称情况.(b)与(a)为关于纸面垂直的平面镜像对称,(c)与(a)为关于纸面镜像对称.研究表明,理论上水液相环境下S-Phe的手性对映体转变可以通过质子直接迁移和水分子(簇)协助质子迁移两种途径实现,下面分别进行讨论.

图1 水液相环境下苯丙氨酸分子手性对映体的几何构型Fig.1 The geometries of chiral enantiomers for phenylalanine molecule in water liquid environment
2.1 质子直接迁移时S-Phe分子的手性对映体转变
质子直接迁移时,S-Phe分子的手性对映体转变反应有a和b两个通道,分别是α-氢以氨基氮为桥和以羰基氧与氨基氮顺次为桥迁移,下面分别进行讨论.
2.1.1 S-Phe在a通道的手性对映体转变
S-Phe分子在a通道的手性对映体转变反应历程见图2,反应势能面见图3的a路线.
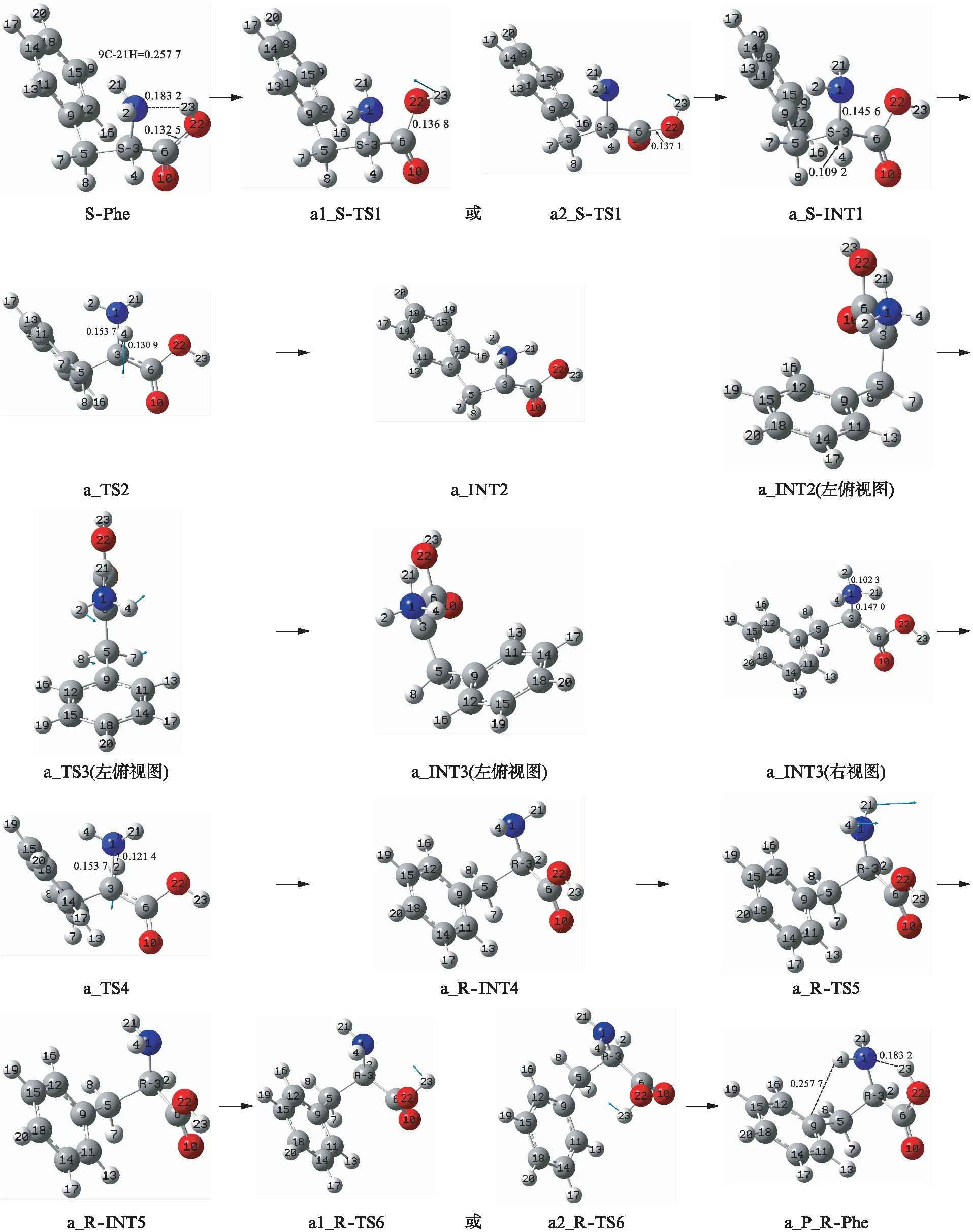
图2 水液相环境下S-Phe分子手性对映体转变在a通道的反应历程Fig.2 The chiral enantiomorphism transformation process of S-Phe molecule in water liquid environment on the a channel

图3 水液相环境下S-Phe手性对映体转变反应的势能剖面Fig.3 The potential energy profiles of chiral enantiomorphism transformation reaction for S-Phe molecule in water liquid environment
首先,第1基元反应: 反应物S-Phe经6C-22O键内旋转的过渡态a1_S-TS1或a2_S-TS1,构象异构得到第1中间体a_S-INT1.此过程23H绕6C-22O旋转,羧基从反式平面结构变为顺式平面结构.a1_S-TS1的旋转矢量方向是从6C向22O,a2_S-TS1的旋转矢量方向是从22O向6C.从S-Phe到a_S-INT1过程,二面角2H—1N—3C—5C从96.95°变为56.58°,1N正面的负电荷密度增大,又23H在羧基里侧,基本不会对质子从正面向1N迁移产生空间位阻,因此a_S-INT1从正面接受质子的能力增强.从S-Phe到a1_S-TS1过程,二面角23H—22O—6C—10O从-178.34°变为-89.04°,同时,二面角2H—1N—3C—5C从96.95°变为57.08°,6C—22O键长从0.1325nm增至0.1368nm,拉伸0.0043nm.2个化学键的内旋转和一个化学键的小幅拉伸,不需太多能量,a1_S-TS1产生的能垒是47.58kJ·mol-1.a2_S-TS1与a1_S-TS1相似,产生的能垒是47.01kJ·mol-1,不再赘述.a2_S-TS1与a1_S-TS1产生的能垒明显低于气相环境的60.25和53.62kJ·mol-1[18],主要原因是水液相环境下6C—22O键的拉伸幅度小于气相环境的6C—22O键的拉伸幅度0.0042nm[18].
第2基元反应: 第1中间体a_S-INT1经过渡态a_TS2,构型异构成第2中间体a_INT2,过渡态矢量是从3C向1N.氨基质子化的a_INT2不稳定,在纸面里侧的质子2H容易向3C迁移,为S-Phe实现手性转变奠定了基础.从a_S-INT1到a_TS2过程,3C—4H键长从0.1092nm拉伸至0.1309nm,3C—1N键长从0.1456nm拉伸至0.1537nm,反应活性中心骨架二面角1N—3C—5C—6C从127.14°变为149.56°,2个化学键的拉伸和不小的骨架形变需较高的能量,a_TS2产生了252.16kJ·mol-1的能垒.此能垒与气相环境下a_TS2产生的能垒259.71kJ·mol-1[18]的相比略小,原因是水液相环境下a_S-INT1到a_TS2过程,3C—4H和3C—1N键长的拉伸略小于气相环境下的[18]拉伸.
第3基元反应: a_INT2经碳—碳键5C—3C和碳—氮键3C—1N内旋转的过渡态a_TS3,构象异构成a_INT3.过渡态a_TS3有2个旋转矢量,一个是3C到1N,另一个是5C到3C.此基元反应,亚甲基7H—5C—8H绕5C—3C键左视顺时针旋转,同时带动苯环从纸面里摆到纸面外.二面角12C—9C—5C—3C和11C—9C—5C—3C分别是47.43°和-47.43°,a_INT2和a_INT3的苯环镜像对称;二面角7H—5C—3C—1N和8H—5C—3C—1N分别是-58.67°和58.67°,a_INT2的亚甲基与a_INT3的亚甲基也镜像对称.从a_INT2到a_INT3完成了R-基的镜像对称异构,为S-Phe实现手性对映体转变奠定了基础.从a_INT2到a_TS3过程只是2个化学键内旋转,所需能量很小,a_TS3产生的能垒只有11.02kJ·mol-1,这与气相环境下的12.86kJ·mol-1[18]相差无几,说明水溶剂效应对此基元反应的影响很小.
第4基元反应: 中间体a_INT3经过渡态a_TS4,构型异构成a_R-INT4,过渡态矢量是从1N到3C.从S-Phe到a_R-INT4,二面角1N—3C—5C—6C和4H—3C—5C—6C分别从125.00°和-113.74°变为-129.30°和112.39°,至此S-Phe从S-手性变为R-手性,并且基本实现了手性活性中心1N—3C—5C—6C—4H的镜像对称异构以及R-基的镜像对称异构.从a_INT3到a_TS4过程,1N—2H和1N—3C键长从0.1023和0.1470nm分别拉伸至0.1214和0.1537nm,这2个化学键的拉伸幅度小于从a_S-INT1到a_TS2过程,并且从a_INT3到a_TS4过程,α-碳3C从sp2杂化向sp3杂化过渡,释放能量,因此a_TS4 产生的能垒要远低于a_TS2产生的能垒,能垒值是155.90kJ·mol-1.这比气相环境下的a_TS4产生的能垒111.86kJ·mol-1[18]明显升高,说明水溶剂效应对此基元反应具有阻碍作用(负催化作用).主要原因是气相环境下a_INT3的偶极矩(7.158D)大于a_TS4的偶极矩(4.353D),强极性溶剂水的极化使前者变得相对更稳定,使后者变得相对不稳定.
第5基元反应: a_R-INT4经过渡态a_TS5,实现了21H和4H从右向左的翻转,构象异构成a_R-INT5.这会大大地减小23H向分子内旋转的空间位阻;同时1N右侧的负电荷密度增大,增加了1N对23H的库仑引力,为完成S-Phe氨基团的镜像对称异构奠定了基础.此基元反应是非骨架异构的二面角旋转,所需能量很低,a_TS5产生的能垒只有21.06kJ·mol-1.这与气相环境下的17.96kJ·mol-1[18]相比较也有所升高,说明水溶剂效应对此基元反应具有负催化作用.
最后是第6基元反应: a_R-INT5经过渡态a1_R-TS6或a2_R-TS6,构象异构成产物a_P_R-Phe,a1_R-TS6和a2_R-TS6与第1基元的过渡态相似,产生的能垒分别是39.38和38.81kJ·mol-1.这与气相环境下的53.62和50.84kJ·mol-1[18]明显降低,说明水溶剂效应对此基元反应具有较好的催化作用.主要原因是气相环境下a_R-INT5的偶极矩(2.371D)小于a1_R-TS6或a2_R-TS6的偶极矩(3.204D和5.004D),强极性溶剂水的极化使前者变得相对不稳定,使后者变得相对稳定.结构分析表明: a_P_R-Phe与S-Phe的结构镜像对称,亦即S-Phe到a_P_R-Phe实现了手性对映体转变.
2.1.2 S-Phe分子在b通道的手性对映体转变
S-Phe分子在b通道手性对映体转变反应的部分历程见图4,反应的势能剖面见图3的b路线.

图4 水液相环境下S-Phe手性对映体转变在b通道的反应历程Fig.4 The chiral enantiomorphism transformation process of S-Phe molecule in water liquid environment on the b channel
首先是第1基元反应: S-Phe经过渡态b_TS1,构型异构成第1中间体b_INT1,过渡态矢量是21H从3C向10O.从S-Phe到b_TS1过程,3C—21H键长从0.1093nm拉伸至0.1539nm,活性中心骨架二面角1N—3C—5C—6C从124.79°变为136.45°,1个化学键较长的拉伸断裂和骨架形变导致b_TS1产生了302.86kJ·mol-1的内禀能垒.b_TS1产生的内禀能垒大于a_TS1产生的内禀能垒,主要原因是3C—21H键拉伸的幅度大.本工作的水液相环境下b_TS1产生的内禀能垒高于气相环境下b_TS1产生的内禀能垒(287.96kJ·mol-1[18]),说明水溶剂对此基元反应起了阻碍作用(负催化).主要原因是气相S-Phe和b_TS1偶极矩分别是5.376D和3.189D,前者的偶极矩大,因此在强极性溶剂水中水的极化使前者变得相对更稳定,使后者变得相对不稳定.
第2基元反应: 第1中间体b_INT1经过渡态b_TS2,构象异构成第2中间体b_INT2,完成了R-基的镜像对称异构.此基元反应相似于2.1.1中的第3基元反应,b_TS2产生了10.26kJ·mol-1的能垒.
第3基元反应: 第2中间体b_INT2经过渡态bj_TS3或bk_TS3,21H转到羧基的内侧,构象异构成第3中间体b_INT3.bj_TS3和bk_TS3产生的能垒分别是7.14和8.12kJ·mol-1.此基元反应相似与a通道的第1基元.
第4基元反应: b_INT3经过渡态b_TS4,构型异构成中间体b_INT4.过渡态矢量是从质子化羧基向氨基氮.b_INT4的氨基是质子化的,质子化的氨基不稳定,给予一定的能量,2H便可以在纸面里向α-碳迁移.从b_INT3到b_TS4过程,键长22O—23H从0.0973nm拉伸至0.1232nm断裂,拉伸幅度不是很大;b_TS4的键角1N—23H—22O是138.72°,22O—23H—1N存在氢键,二面角1N—23H—22O—6C和3C—6C—22O—23H分别是-0.32°和0.84°,过渡态五元环共面程度较高.因此b_TS4较稳定,产生的能垒只有24.32kJ·mol-1.这比气相环境下的41.44kJ·mol-1[18]显著降低,原因之一是液相环境下22O—23H的拉伸幅度小,原因之二是气相b_TS4的偶极矩3.012D大于b_INT3的偶极矩0.979D,在强极性溶剂水中前者变得相对稳定.值得一提的零点振动能校正后,气相环境下b_INT4经b_TS4到b_INT3的反应是无势垒过程[18].而本工作水液相环境下b_INT4经b_TS4到b_INT3的反应是有势垒过程,b_INT4处在势能面较低的位置.原因是气相b_INT4的偶极矩4.638D大于b_TS4的偶极矩3.012D,更大于b_INT3的偶极矩0.979D,在强极性溶剂水中,水的极化使平衡强烈地向b_INT4移动.
第5基元反应: 第4中间体b_INT4经过渡态b_TS5,实现了羧基内的质子迁移,构型异构成第5中间体b_INT5,过渡态矢量是21H从10O到22O.从b_INT4到b_TS5过程,键长10O—21H从0.0964nm 拉伸至0.1267nm断裂,一个化学键幅度不小的拉伸,需要一定的能量;又键角10O—21H—22O是112.28°,远远偏离平角,氢键极弱,四元环过渡态b_TS5张力较大,因此b_TS5产生的能垒比较高,是105.18kJ·mol-1.与文献[18]中气相的此基元反应能垒116.29kJ·mol-1相比较发现,水溶剂对此基元反应有助催化作用.原因之一是b_TS5的偶极矩(7.213D)大于b_INT4的偶极矩(4.638D),极性溶剂水的极化使b_TS5变得相对稳定,原因之二是水液相环境下10O—21H键的拉伸小于气相的.结构分析表明,b_INT5的构象全同于a_INT3,其以后的异构历程同于a_INT3之后的历程,不再赘述.
从图3可以看出,在a通道S-Phe实现手性对映体转变反应需要6个基元反应,第2和4基元是速控步骤,内禀能垒分别是252.16和155.90kJ·mol-1.在b通道S-Phe实现手性对映体转变反应需要8个基元反应,第1基元是速控步骤,内禀能垒是302.86kJ·mol-1.由于水液相环境下分子间碰撞失活,反应活化能应取总包能垒(表观能垒),从图3可以看出,S-Phe的手性对映体转变反应在a通道具有优势,反应活化能是260.36kJ·mol-1.这能量远高于质子迁移的“极限能垒”167.00kJ·mol-1[26],说明水液相环境下质子直接迁移时S-Phe很难消旋.
2.2 水分子(簇)作质子迁移媒介时S-Phe分子的手性对映体转变
水液相环境下水分子(簇)作为质子迁移媒介时S-Phe分子的手性对映体转变,只需讨论质子迁移的基元反应,非质子迁移过程同于2.1节的讨论.研究表明: 水分子(簇)作为质子迁移媒介时在b通道比前面2.1节讨论的情况多了α-氢只以羰基氧为桥迁移的新路径,这里称其为b*路径,原b通道这里称为b路径,下面对它们分别进行讨论.
2.2.1 水分子簇对S-Phe分子在a通道手性对映体转变的催化
计算表明,对于质子在α-碳和氨基氮间的迁移,2个水分子簇与3个水分子簇的催化作用相差很小,为节约篇幅,本工作只考察2个水分子簇对a通道上的质子迁移反应(第2和4基元)的催化作用.反应历程见图5,反应过程的势能面见图6(a).

图5 水液相环境下2个水分子簇对S-Phe分子在a通道手性对映体转变反应的催化历程Fig.5 The catalytic process of chiral enantiomorphism transformation reaction for S-Phe molecule through the a channel of two water molecules in water liquid environment
第2基元: 先是a_S-INT1的1N和23H与2聚水氢键作用,形成前驱络合物a_S-INT1·(H2O)2(m).然后,a_S-INT1·(H2O)2(m)经2聚水作质子转移媒介的过渡态a_TS2·(H2O)2(m),构型异构,形成中间体络合物a_INT2·(H2O)2(m),实现了质子从3C向1N的净迁移.a_TS2·(H2O)2(m) 几乎是接近产物,是很靠后的晚期过渡态.a_S-INT1和(H2O)2间的氢键结合能是23.11kJ·mol-1,亦即a_S-INT1和(H2O)2络合成a_S-INT1·(H2O)2(m)时放热,但是水液相环境下分子间频繁的碰撞会使这部分能量迅速被溶剂吸收,所放热量不能作为a_S-INT1·(H2O)2(m)继续反应的资用能.a_INT2·(H2O)2(m)的a_INT2和(H2O)2之间的氢键解离能是28.64kJ·mol-1.从a_S-INT1·(H2O)2(m)到a_TS2·(H2O)2(m)过程,键长3C—23H、21O—27H、28O—25H和3C—1N从0.1092、0.0972、0.0992和0.1457nm分别拉伸至0.1368、0.1731、0.1898和0.1491nm;反应活性中心二面角1N—3C—4C—5C从128.66°变为132.35°.3个化学键的大幅拉伸,再加上骨架形变,需要一定的能量.计算表明,过渡态a_TS2·(H2O)2(m)的七元环结构中,氢键角24O—23H—3C、24O—27H—28O和28O—25H—1N、分别是168.63°、166.64°和155.32°,3个氢键较强,a_TS2·(H2O)2(m)的七元环结构较稳定.因此a_TS2·(H2O)2(m)产生的内禀能垒又不会太高,只有107.64kJ·mol-1.与裸反应的此基元的内禀能垒259.71kJ·mol-1相比较大幅降低,与水汽环境下2个水分子簇作氢迁移媒介时的能垒126.47kJ·mol-1相比较也明显降低.水液相环境下2个水分子簇起了更好的催化作用,说明水溶剂起了较好的助催化作用.原因是气相a_TS2·(H2O)2(m)的偶极矩(5.114D)大于a_S-INT1·(H2O)2(m) 的偶极矩(2.981D),在强极性溶剂水中,水的极化使a_TS2·(H2O)2(m)变得相对稳定,而a_S-INT1·(H2O)2(m)变得相对不稳定.
计算表明,a_INT2·(H2O)2(m)解离与否,对后续的反应通道及反应能垒没有明显的影响,所以本工作为了使计算简化,对没有参与反应水分子(簇)不给予考虑.
由于第4基元并非决速步,只做一般讨论: a_INT3的3C和25H与其后面的二聚水氢键作用,形成前驱络合物a_INT3·(H2O)2(n),a_INT3与(H2O)2的结合能为27.74kJ·mol-1.然后,a_INT3·(H2O)2(n)经过渡态a_TS4·(H2O)2(n)异构成中间体产物络合物a_R-INT4·(H2O)2(n),实现了质子从1N向3C的净迁移,至此S-Phe实现了手性转变.a_TS4·(H2O)2(n)很靠近反应物,是早期过渡态.从a_INT3·(H2O)2(n)到a_TS4·(H2O)2(n)过程,键长1N—25H、28O—27H、24O—23H和3C—1N从0.1036、0.09776、0.0979和0.1473nm分别拉伸至0.1036、0.0991、0.1244和0.1490nm;活性中心二面角1N—3C—4C—5C从-161.50°变为-132.50°,3个化学键的拉伸及骨架形变需要一定的能量.但α-碳从sp2杂化向sp3杂化过渡,释放能量,a_TS4·(H2O)2(n)的七元环结构比较稳定,因此a_TS4·(H2O)2(n)产生的能垒又不会太高,只有16.83kJ·mol-1.结构分析表明,a_R-INT4·(H2O)2(n) 体系存在氨基与苯环间的π氢键、1条分子内的弱双氢键、1个分子间的弱氢键和2分子间的强氢键,a_R-INT4·(H2O)2(n)很稳定.

图6 水液相环境下水分子簇对S-Phe分子手性对映体转变反应催化过程的势能面Fig.6 The potential energy surfaces of chiral enantiomorphism transformation reaction for S-Phe molecule through water cluster in water liquid environment
2.2.2 水分子簇对S-Phe分子在b通道手性对映体转变的催化
计算表明: 对于质子在α-碳和羰基氧之间以及羧基内的迁移,2个水分子簇与3个水分子簇的催化作用相差很小,本工作只考察2个水分子簇的作用;对于质子在羰基氧和氨基氮之间的迁移,1个水分子的催化作用好于2个水分子簇与3个水分子簇的催化作用,本工作只考察1个水分子的作用.
S-Phe分子在b通道手性对映体转变的第1、4和5基元是质子迁移反应,分别给予讨论.2聚水作为质子迁移媒介,质子从α-碳迁移到羰基氧后,经裸反应的第2基元反应过程,完成R-基的镜像对称异构.之后的过程是两个路径,一个是2聚水作为质子迁移媒介,质子从羰基氧迁移到α-碳的b*路径,另一个是原来的b通道仍命名为b路径.反应历程见图7,反应过程的势能面见图6(b),下面分别进行讨论.

图7 水液相环境下水分子(簇)对S-Phe分子在b通道手性对映体转变反应的催化历程Fig.7 The catalytic process of chiral enantiomorphism transformation reaction for S-Phe molecule through the b channel of water molecules in water liquid environment
第1基元反应: 首先,S-Phe的25H和9O与其前面的2个水分子簇通过氢键作用形成前驱络合物b_ S-Phe·(H2O)2(m),S-Phe和(H2O)2(m)之间的氢键结合能是17.30kJ·mol-1.然后,b_S-Phe·(H2O)2(m)经过渡态b_TS1·(H2O)2(m),异构成中间体络合物b_INT1·(H2O)2(m),过渡态矢量是25H从3C到28O、27H从28O到24O和23H从24O到9O.最后,b_INT1·(H2O)2(m)获得26.31kJ· mol-1的能量,解离成b_INT1和(H2O)2.从反应物b_S-Phe·(H2O)2(m)到过渡态b_TS1·(H2O)2(m),键长3C—25H、28O—27H和24O—23H从0.1092、0.0976和0.0975nm分别拉伸至0.1308、0.1595和0.1487nm,3个化学键的大幅拉伸,需要一定的能量.但活性中心二面角1N—3C—4C—5C从123.32°变为129.80°,骨架形变很小;结构分析表明,b_TS1·(H2O)2(m)的七元环结构中存在3个较强的氢键,但七元环结构偏离平面比较严重,七元环结构不稳定稳定.因此b_TS1·(H2O)2(m)产生的内禀能垒较高,是161.81kJ·mol-1.这与文献[18]的水汽环境下此基元反应的内禀能垒153.54kJ·mol-1相比较略有升高.说明水溶剂对此基元反应起了负催化作用.主要原因是水溶剂环境下,b_S-Phe·(H2O)2(m)的偶极矩(6.394D)大于b_TS1·(H2O)2(m)的偶极矩(5.222D),水的极化作用使b_S-Phe·(H2O)2(m)变得相对更稳定,而使b_TS1·(H2O)2(m)变得相对不稳定.
b*分路径是第1基元的逆反应,b_INT2与(H2O)2通过氢键作用形成的络合物b*_INT2·(H2O)2(n),经二聚水做质子转移媒介的过渡态b*_TS3·(H2O)2(n),实现了质子从9O向3C的净迁移,构型异构成b*_P_R-Phe·(H2O)2(n).b*_TS3·(H2O)2(n)产生的内禀能垒是66.62kJ·mol-1,详细的机理从略.结构分析表明: 至此S-Phe实现了手性对映体转变.b*_INT2与(H2O)2(n)的氢键结合能是25.48kJ·mol-1,b*_P_R-Phe与(H2O)2(n)的氢键解离能是17.35kJ·mol-1.
b路径的第4基元,络合物b_INT3·H2O(u)经过渡态b_TS4·H2O(u),实现了质子从22O向1N的净迁移,得到中间体产物络合物b_INT4·H2O(u),过渡态矢量是从22O到24O和从24O到1N.b_INT3与H2O(u)之间的氢键结合能是14.14kJ·mol-1,b_INT4与H2O(u)之间的氢键解离能是15.33kJ·mol-1.从前驱络合物b_INT3·H2O(u)到过渡态b_TS4·H2O(u),22O—23H和24O—25H键长从0.0981和0.0991nm分别拉伸到0.1054和0.1325nm,拉伸幅度不是很大;七元环过渡态b_TS4·H2O(u)的2条氢键角22O—23H—24O和24O—25H—1N分别是172.52°和170.28°,氢键较强,又结构分析表明,七元环结构基本共面.因此b_TS4·H2O(u)较稳定,其产生的能垒不高,只有13.05kJ·mol-1,这比文献[18]中此基元气相反应的能垒28.38kJ·mol-1大幅降低.原因是气相b_TS4·H2O(u)的偶极矩(3.474D)大于b_INT3·H2O(u)的偶极矩(2.041D),强极性溶剂水的极化使前者变得相对稳定.文献[18]研究表明,经过零点振动能校正后,气相环境下从b_INT4·H2O(u)经b_TS4·H2O(u)到b_INT3·H2O(u)为无势垒过程,而本工作的水液相环境下,从b_INT4·H2O(u)经b_TS4· H2O(u)到b_INT3·H2O(u)为有势垒过程,能垒是20.40kJ·mol-1.原因是气相b_INT4·H2O(u)的偶极矩(4.150D)大于气相b_TS4·H2O(u)的偶极矩(3.474D),强极性溶剂水的极化使前者变得相对稳定.
b路径的第5基元: 第4中间体络合物b_INT4·(H2O)2(v)经过渡态b_TS5·(H2O)2(v),实现了质子在羧基内从10O向21O的净迁移,构型异构为中间体络合物b_INT5·(H2O)2(v),过渡态矢量是从10O到24O、24O到29O和29O到21O.b_INT4与(H2O)2(v)的氢键结合能是27.06kJ·mol-1,b_INT5与(H2O)2(v)的氢键解离能是27.86kJ·mol-1.从b_INT4·(H2O)2(v)到b_TS5·(H2O)2(v)过程,键长10O—23H、24O—25H和29O—26H分别从0.0981、0.0978和0.09868nm 拉伸至0.1032、0.1212和0.1491nm断裂,3个化学键的断裂需要一定的能量.但活性中心骨架二面角3C—6C—10O—21O从178.84°到-179.94°,骨架结构基本没变;结构分析表明: 八元环过渡态b_TS5·(H2O)2(v)的3条氢键较强,八元环骨架共面程度较好.因此,b_TS5·(H2O)2(v)产生的能垒只有16.15kJ·mol-1.这远低于文献[18]报道的气相环境下此基元反应的能垒40.75kJ·mol-1,主要原因是气相的b_TS5·(H2O)2(v)的偶极矩(6.699D)大于b_INT4·(H2O)2(v)的偶极矩(6.057D),强极性溶剂水的极化使前者变得相对稳定,水的极化又使液相环境下b_TS5·(H2O)2(v)的偶极矩(16.232D)与b_INT4·(H2O)2(v)的偶极矩(10.387D)之差显著增大,使b_TS5·(H2O)2(v)变得相对更稳定.
从图6可以看出,水液相环境下水分子(簇)催化的S-Phe分子手性对映体转变反应的优势通道是a.若考虑到溶剂环境下a_S-INT1和(H2O)2形成络合物a_S-INT1·(H2O)2(m)时所放热量不能被后续的反应利用,并且不考虑a_INT2·(H2O)2(m)的解离过程,则在此通道反应的活化能是内禀能垒(绝对能垒)107.64kJ·mol-1;第4基元是强烈的放热反应.在b通道的活化能(内禀能垒)是161.81kJ·mol-1;b*路径的第2基元是强烈的放热反应;b路径的第2基元也是强烈的放热反应,第5基元是所需能量很小的吸热反应.161.81kJ·mol-1已接近质子迁移的“极限能垒”167.00kJ·mol-1[26],107.64kJ·mol-1远低于质子迁移的“极限能垒”167.00kJ·mol-1[26],因此S-Phe分子手性对映体转变反应的产物主要来自a通道,在b通道只有微量或痕量的S-Phe消旋.
3 结 论
综上得到如下主要结论:
(1) 质子直接迁移时,水液相环境下苯丙氨酸分子手性对映体转变反应有2个通道a和b: a是α-氢以氨基氮为桥迁移,b是α-H以羰基氧和氨基氮顺次为桥迁移.水分子(簇)作质子迁移媒介时,在b通道又多了α-H只以羰基氧为桥迁移的路径.
(2) 水液相环境与气相环境相比较,质子从α-碳向羰基氧直接迁移的内禀能垒小幅升高,质子从α-碳向氨基氮直接迁移的内禀能垒小幅降低;2个水分子簇催化的质子从α-碳向羰基氧迁移的内禀能垒小幅升高,质子从α-碳向氨基氮迁移的内禀能垒显著降低.
(3) a是反应的优势通道,质子直接迁移时反应的活化能是260.36kJ·mol-1,2个水分子簇作质子迁移媒介时反应的活化能是107.64kJ·mol-1,水液相环境下水分子(簇)的催化可以使Phe分子实现手性对映体转变.
(4) 水溶剂的作用使质子在羰基氧和氨基氮之间的迁移无论有无水分子作媒介,都从单向有势垒变成了双向都有势垒的反应.

