头灯下经口直视的大鼠非暴露式气管滴注法的建立
龙隆, 谭红, 杨鸿波
(1. 中国铁路成都局集团有限公司重庆疾病预防控制所, 重庆400014;2. 贵州省分析测试研究院, 贵阳550000)
呼吸暴露是外界物质进入人机体最主要途径之一,气管滴注法在呼吸系统相关研究中因其具有稳定和精准等特点得到广泛应用[1,2], 虽然近年来自然吸入染毒法的应用呈上升趋势, 但其成本较高,还存在暴露仓内浓度分布不均, 均一性和稳定性都难以满足实验要求等诸多问题,气管滴注法在国内仍然拥有较高的使用率。由于大鼠声门位置较高,插管时声门暴露困难,迅速而准确行气管滴注操作十分关键,暴露式气管滴注方法虽然简便快捷,但对动物机体损伤比较大,在慢性或亚慢性实验中,往往需要反复多次滴注,组织反复损伤及术后感染都会对实验动物的机体造成损伤。本研究在总结了既往国内外相关研究和探索改良的基础上, 设计出一种兼顾安全和高效的非暴露式气管滴注方法, 为今后相关实验研究提供参考。
1 材料与方法
1.1 实验动物与材料
SPF级雄性SD大鼠20只, 体质量200~350 g,购自北京维通利华实验动物技术有限公司[SCXK(京)2012-0001],常规饲养于贵州健安德科技有限公司实验动物中心屏障系统(IVC)中[SYXK(黔)2016-005]。12 h明暗昼夜交替, 设施温度22~24 ℃,相对湿度50%~70%,正常饮食饮水。
将22G Y型静脉留置针针芯的针尖磨平去掉约2 mm(以免插管时损伤气管)后回插入留置针套管, 但不完全插入, 针尖与套管前端保留大约3 mm的距离,防止针尖对动物气道造成损伤(图1)。强光变焦头灯(直径65 mm,深度60 mm)(图2)。其他材料包括棉签、纱布、胶带缠绕过的小夹子、解剖板、皮筋、丝线、1 mL注射器。
1.2 方法
1.2.1 麻醉与固定采用腹腔注射1%戊巴比妥钠按30 mg/kg体质量进行麻醉,用丝线套住大鼠上切牙,仰卧吊于45~60°倾斜的解剖板上固定,用皮筋将大鼠四肢固定于解剖板,并在动物颈后部垫一块纱布抬高气管位置,便于后续插管。
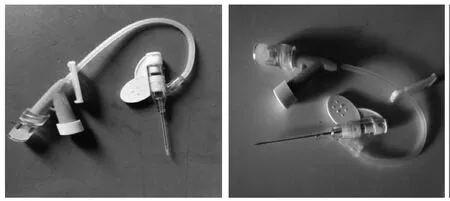
图 1 自制滴注装置

图 2 强光变焦头灯
1.2.2 气管插管和滴注 实验人员带好头灯,将台灯发散的光源照进动物口腔,左手拇指和食指将动物舌体轻轻牵拉至一侧后用包裹了胶带的小夹子将舌体轻轻夹住,再用棉签擦拭动物咽部分泌物的同时轻压舌体并固定,左手中指用于调整动物体位,调整好操作手法以及头灯角度后可以清晰看见咽部和忽明忽暗的声门裂,右手持含有针芯的磨钝的自制静脉留置针套管在头灯的辅助下迅速插入气管口约3 cm,轻轻将针芯从套管中抽出,并用胶带将套管固定,松开牵出的舌体,此时可以观察到导管内有呼吸所致蒸气贴壁现象,将细棉丝放置于套管的注射器接口,能够看见细棉丝伴随着大鼠呼吸而飘动,如若不然,则需重新插管。用1 mL注射器吸取0.1 mL生理盐水后连接套管并缓慢注入,再注入同体积空气。
1.2.3 滴注后操作 迅速拔出静脉留置针套管, 关闭光源, 悬挂约半分钟后平放于手术台上旋转, 模拟真实给药染毒, 使生理盐水在两肺内均匀分布。
2 结果
本实验采用隔日滴注,每只动物分7 d滴注4次,共进行40次大鼠气管滴注操作,全部一次性成功,滴注操作大约3 min,每只实验动物在操作过程中没有出现呼吸急促等现象均能保持较平稳呼吸,没有出现窒息或死亡,动物苏醒后进食、饮水、活动等一般观察均无异常,解剖后检查也未见气管损伤等情况。
3 讨论
方法建立注意事项: ①掌握合适的麻醉深度是完成气管插管的前提。麻醉过浅会导致实验动物不能进入麻醉状态或进入麻醉状态较慢, 甚至在气管滴注过程中出现强烈的应激反应, 从而影响动物生理状态。麻醉剂量过大容易造成实验动物发生呼吸抑制而死亡,这就要求我们需要协调麻醉速度与气管滴注操作速度, 使其稳步有序。经过前期的预实验和大量文献的收集, 我们发现腹腔注射1%戊巴比妥钠按30 mg/kg体质量进行麻醉能使动物较快、较好进入麻醉状态, 并且用小镊子轻夹大鼠的四趾脚趾, 大鼠无任何反应。②牵拉实验动物舌体时手法要轻柔, 在保证撑开口腔的同时要避免损伤到动物。③行气管滴注操作前要对套管插入深度进行解剖观察,切勿盲插,减少对动物的损伤。④正式实验前需进行滴注液体体积的测试。在预实验中, 使用不同的静脉留置针和注射器在行滴注操作过程时, 实际的滴注剂量有所偏差,并且滴注时使用的注射器底部容易残留液体, 导致实际给药往往小于理论给药, 偏差大约在0.01 mL以内。因此在进行正式滴注染毒操作前需先测试其体积, 反复充盈整个滴注装置, 观察实际剂量与注射剂量的差值, 确保染毒剂量的精准。⑤滴注完毕后可以适当补气, 防止动物窒息, 同时应注意控制补气速度和补气量。根据既往研究和预实验,我们在滴注完毕后将1 mL空气1.5 s内注入气道,达到分散染毒物质以及避免动物窒息等问题。⑥整个滴注操作过程应尽量迅速, 笔者认为,滴注操作应控制在2 min以内为宜, 若滴注时间较长容易发生缺氧或窒息。同时动物在麻醉期间体温容易下降,需要采取一定的保温措施。
现阶段与呼吸系统相关的研究呈逐年上升的趋势,但自然吸入法受到多种条件的限制并未广泛开展,目前国内外采用气管滴注法还是比较常见,但操作方式并不一致[2-4]。本文介绍的气管滴注法与既往的滴注法相比具有更安全、廉价和更快捷、高效等特点。
早在1980年代就有学者采用盲探插管法成功率高达90%[5],但插管耗时较长,同时还存在需反复试插,对动物咽喉部及气道造成损伤的缺点,该法对实验人员的技术要求较高,因此并未广泛开展,高效而精准的气管滴注法仍需借助其他设备。有学者[6,7]使用自制的光纤引入口腔内照明进行气管插管,成功率较高,但成本高、过程较慢。Fuentes等[8]使用电子内镜辅助操作,保证了成功率,但操作繁杂无法达到快速插管的缺点。有研究提出将显微导丝应用于气管滴注[9],但也存在上述问题。据报道,在透射灯以及额镜下行气管滴注效果较好[10]。
本研究通过总结国内外气管滴注相关实验研究, 探索出头灯下经口直视气管滴注法, 事先将动物分批麻醉, 然后使用头灯行气管滴注的操作, 不仅廉价安全而且可靠, 仅需一个实验人员便能完成整个滴注操作, 与传统滴注需要两位实验人员相比,效率进一步提高。综上所述,应用头灯行气管滴注操作简单,快速,安全,廉价,可重复性强,可广泛应用于大鼠呼吸道给药染毒等相关研究。

