MicroRNA-200a通过抑制上皮-间充质转化影响乳腺癌细胞的恶性生物学行为*
窦 艳, 邱 鹏, 陈江伟
(1邢台市人民医院病理科, 2邢台市人民医院肿瘤内科, 河北 邢台 054000)
乳腺癌是世界范围内最常见的恶性肿瘤,目前其发病率居世界第1位,死亡率居世界第5位[1],是女性死亡的首要原因。近年来,虽然手术治疗联合新的放疗、化疗等手段已大大提高了早期乳腺癌患者的生存率,但晚期患者的临床生存率仍不容乐观[2]。分子靶向药物被认为是乳腺癌治疗的新途径[3],但仍有部分患者的分子分型难以匹配分子靶点。因此,进一步阐明乳腺癌的发病机制,寻找新的治疗靶点,对提高乳腺癌的疗效和改善患者的预后具有重要的作用。
微小RNA(microRNA, miRNA,miR)是一种非编码单链RNA分子,参与调控靶基因的翻译过程,在多种恶性肿瘤的发生发展过程中发挥作用。miR-200家族是一种上皮细胞标志物,是参与上皮-间充质转化(epithelial-mesenchymal transition, EMT)的主要调节分子[4],其基因被认为是一种抑癌基因。然而,综合目前的研究结果发现,miR-200家族成员在不同肿瘤的发展中发挥的作用并不完全相同。 miR-200家族在鼻咽癌中表达下调,在鼻咽癌细胞系中内源性miR-200a的表达随细胞分化程度的增加而增加[5]。在肾癌中miR-200a可以靶向β-catenin,抑制转化生长因子β1诱导的近端肾小管的上皮-间充质转化[6]。在缺乏甲基饮食诱导的大鼠肝癌模型中miR-200b的表达也表现为下调[7],而在相对于正常的黑色素细胞中miR-200家族的表达则是增加的[8],但增加miR-200家族的表达水平并不能抑制黑色素瘤细胞的侵袭,而只是引起癌细胞侵袭方式的改变。miR-200c表达高的胰腺癌患者预后指标更好,但增加胰腺癌细胞中miR-200c的表达虽能抑制胰腺癌的侵袭,却会增强胰腺癌细胞的增殖能力[9]。这说明miR-200家族成员在不同肿瘤的发生发展中发挥的作用并不一致。miR-200a是miR-200家族的成员,其在乳腺癌中的表达水平发生改变会发挥怎样的作用尚不清楚。本实验筛选了乳腺癌细胞系中miR-200a的表达情况,构建了miR-200a 的模拟物(mimic)及抑制剂(inhibitor),并转染作用于乳腺癌细胞,探讨其对乳腺癌恶性生物学行为的影响及其作用机制,为乳腺癌的靶向治疗提供参考资料。
材 料 和 方 法
1 主要试剂
人乳腺癌细胞株MDA-MB-231、MDA-MB-468和MCF-7购自中国科学院生物化学与细胞生物学研究所;人乳腺上皮细胞株MCF-10A购自上海丰寿生物科技有限公司。BCA蛋白浓度测定试剂盒、PVDF膜和ECL发光液购自中国上海碧云天生物技术有限公司;凋亡试剂盒和Transwell 试剂盒购自Corning; TRIzol RNA提取试剂盒和逆转录试剂盒购自Qiagen;miRNA荧光定量PCR试剂盒和反转录引物购自广州市锐博生物科技有限公司;miR-200a mimic 和inhibitor购自上海吉玛生物;Western抗体购自Proteintech;转染试剂Lipofectamine® 2000购自Invitrogen;CCK-8试剂购自日本同仁生物。
2 方法
2.1细胞培养和转染 复苏乳腺癌细胞,培养于含10%胎牛血清的DMEM培养液中,置于37 ℃、5%CO2标准培养箱中培养,显微镜下观察,当细胞状态良好,密度达到80%时开始传代。应用Lipo fectamine 2000转染,参照说明书进行,用不含有抗生素含血清的DMEM培养液重悬乳腺癌细胞,调整细胞浓度,接种于96孔细胞培养板中,放置于37 ℃、5%CO2孵箱中过夜。转染前24 h 细胞接种至6 孔板中,密度为1×105,采用含有10% 胎牛血清的DMEM培养液培养细胞,使转染时的细胞密度能够达到50%~80%。细胞转染按照riboFECTTM CP 转染试剂盒说明书进行操作。实验设置3个组:阴性对照(miR-negative control, miR-NC)组,加入阴性对照mimic及riboFectTMCP 试剂;模拟物(miR-mimic)组,加入miR-200a mimics及riboFectTMCP 试剂;抑制剂(miR-inhibitor)组,加入miR-200a 抑制剂及riboFectTMCP 试剂。之后将6 孔板放入CO2培养箱中培养6 h。然后更换新鲜的含10%新生牛血清的DMEM全培养液,培养48 h后可直接收集细胞,检测细胞周期和凋亡,检测相关蛋白表达。
2.2CCK-8法检测细胞活力 使用CCK-8试剂盒检测细胞增殖能力, 按照试剂盒说明书操作。选择对数生长期的细胞,以3×106/L的密度接种于96孔细胞培养板,每孔加100 μL培养液,培养6 h,行瞬时转染,转染细胞后的96孔板置于标准细胞恒温培养箱中培养。后续培养24、48和72 h后分别加入10 μL CCK-8试剂,37 ℃孵育2 h,酶标仪上机检测波长为450 nm处的吸光度(A)值,计算每组细胞增殖能力,实验重复验证3次。
2.3细胞凋亡检测 细胞转染处理48 h后,收集培养液上清,PBS清洗细胞2次,加入2 mL 0.25%不含EDTA的胰酶消化液处理细胞,显微镜下观察到细胞形态开始变圆并脱离培养皿底部时,加入3 mL含有10%胎牛血清的DMEM培养液终止消化,轻柔吹打分散细胞团;将含有细胞的混合液全部取到15 mL无菌离心管中,600×g离心5 min,弃掉上清,加入500 μL Binding Buffer悬浮细胞,加入5 μL Annexin V-FITC混匀,避光染色15 min,加入5 μL PI染液,室温避光染色5 min,流式细胞仪检测细胞凋亡,FlowJo软件分析凋亡检测结果。
2.4细胞侵袭检测 无菌24孔板按实验需求放置Transwell小室,小室内按1∶10比例铺入80 μL基质胶,将铺好基质胶的24孔板置于细胞恒温培养箱中沉降4 h,小室外的孔中加入600 μL含10%胎牛血清的DMEM培养液,小室内按200 μL不含血清的细胞悬液中铺入5×104转染6 h后的细胞,24孔板置于细胞恒温培养箱中培养48 h。48 h后取出小室,PBS清洗小室底部2次,用棉棒将小室内面未穿透的细胞擦干净,小室置于4%多聚甲醛中固定30 min,PBS洗净固定液,结晶紫染液30 min,PBS清洗结晶紫2次,倒置晾干小室后在倒置显微镜下观察,随机取5个视野计数细胞,比较各组细胞侵袭能力。
2.5Real-time PCR 检测miR-200a以及EMT相关指标mRNA的表达水平 TRIzol试剂盒提取细胞中总RNA,用NanoDrop 2000测量各组RNA浓度将RNA反转录为cDNA。
用两步法染料试剂盒检测SIP1、E-cadherin、N-cadherin、Snail、Twist、ZEB1和ZEB2 mRNA的表达情况,以β-actin为内参照;用两步探针法试剂盒检测miR-200a的表达情况,以U6为内参照。2-ΔΔCt法表示SIP1、E-cadherin、N-cadherin、Snail、Twist、ZEB1、ZEB2和miR-200c的相对表达量,实验中所用到PCR引物见表1。反应程序为:预变性94 ℃ 10 min;95 ℃ 15 s, 60 ℃ 1 min, 40个循环。熔解曲线分析: 95 ℃ 15 s, 65 ℃ 1 min, 95 ℃ 15 s。采集信号进行定量分析。
2.6Western blot 细胞转染处理48 h后抽提蛋白,采用BCA蛋白浓度定量试剂盒检测蛋白样品的浓度,计算上样量。取适量的蛋白与5×蛋白上样缓冲液混合(4∶1),95 ℃金属浴煮沸5 min蛋白变性。按照实验需求配置聚丙烯酰凝胶。蛋白上样,电泳,转膜,封闭,4 ℃孵育Ⅰ抗过夜,TBST洗膜3次,加入相应Ⅱ抗,室温摇床孵育2 h,TBST洗膜2次,ECL发光,照相,Scion Image软件测灰度值定量分析。
3 统计学分析
采用SPSS 17.0软件进行统计学分析,各组实验数据以均数±标准差(mean±SD)表示,用单因素方差分析 (one-way ANOVA) 进行统计学分析,以P<0.05为差异有统计学意义。
结 果
1 miR-200a在乳腺细胞系中的表达情况
RT-qPCR结果显示,与正常乳腺上皮细胞MCF-10A相比,miR-200a在MDA-MB-231和MDA-MB-468细胞中表达降低(P<0.05),在MDA-MB-231细胞中表达量最低,在MCF-7细胞中表达无显著差异,见图1。后续实验选择MDA-MB-231作为miR-200a的转染对象。转染miR-200a mimic后,miR-200a在MDA-MB-231细胞中的表达显著增加,转染miR-200a inhibitor后miR-200a在MDA-MB-231细胞中的表达显著降低(P<0.05),见图2,说明miR-200a序列设计有效。

表1 RT-qPCR引物序列
F: forward; R: reverse.
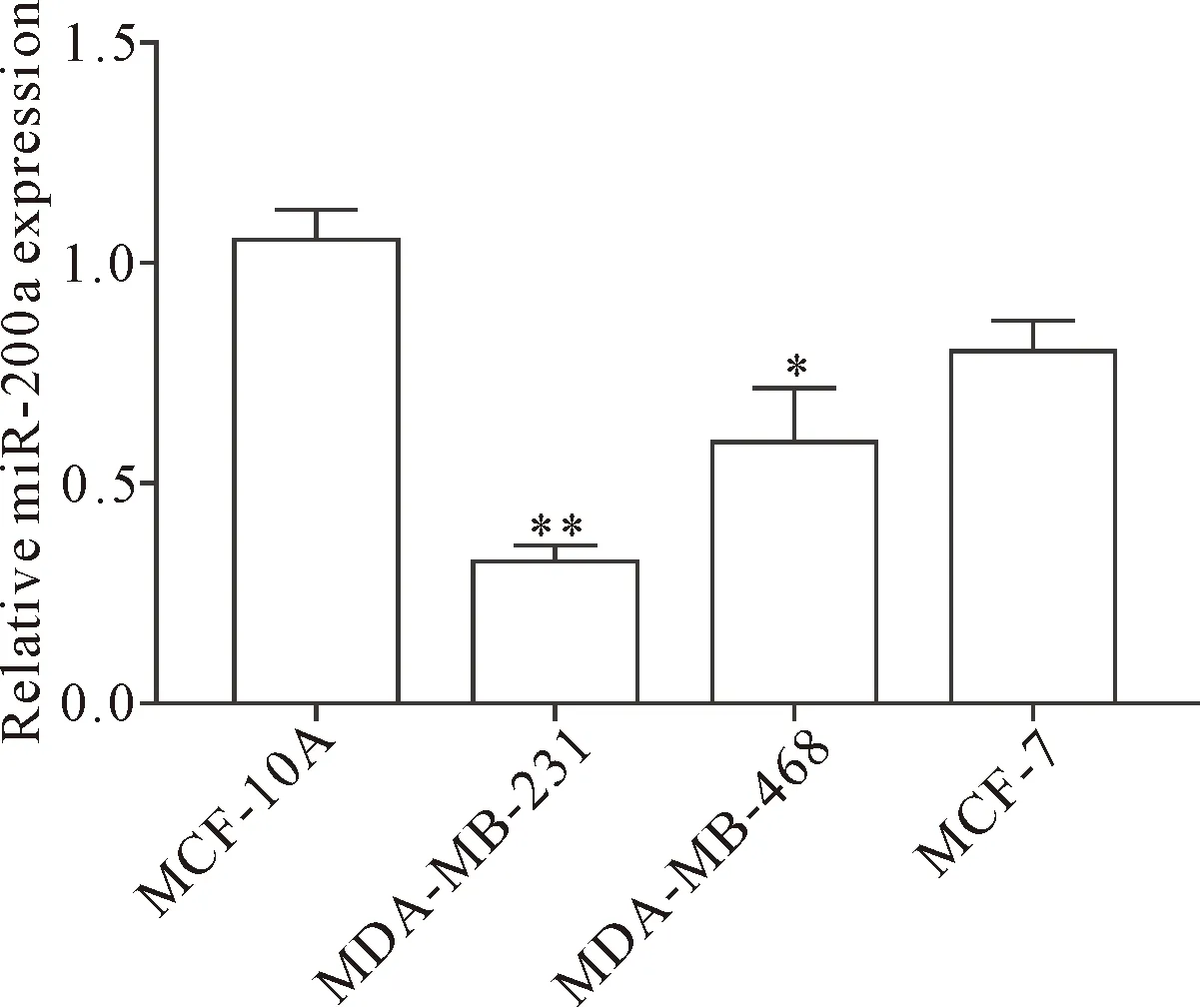
Figure 1. The relative expression of miR-200a in human normal breast epithelial cells and breast cancer cells. Mean±SD.n=3.*P<0.05,**P<0.01vsMCF-10A cells.
图1 正常乳腺上皮细胞及乳腺癌细胞中miR-200a的表达情况
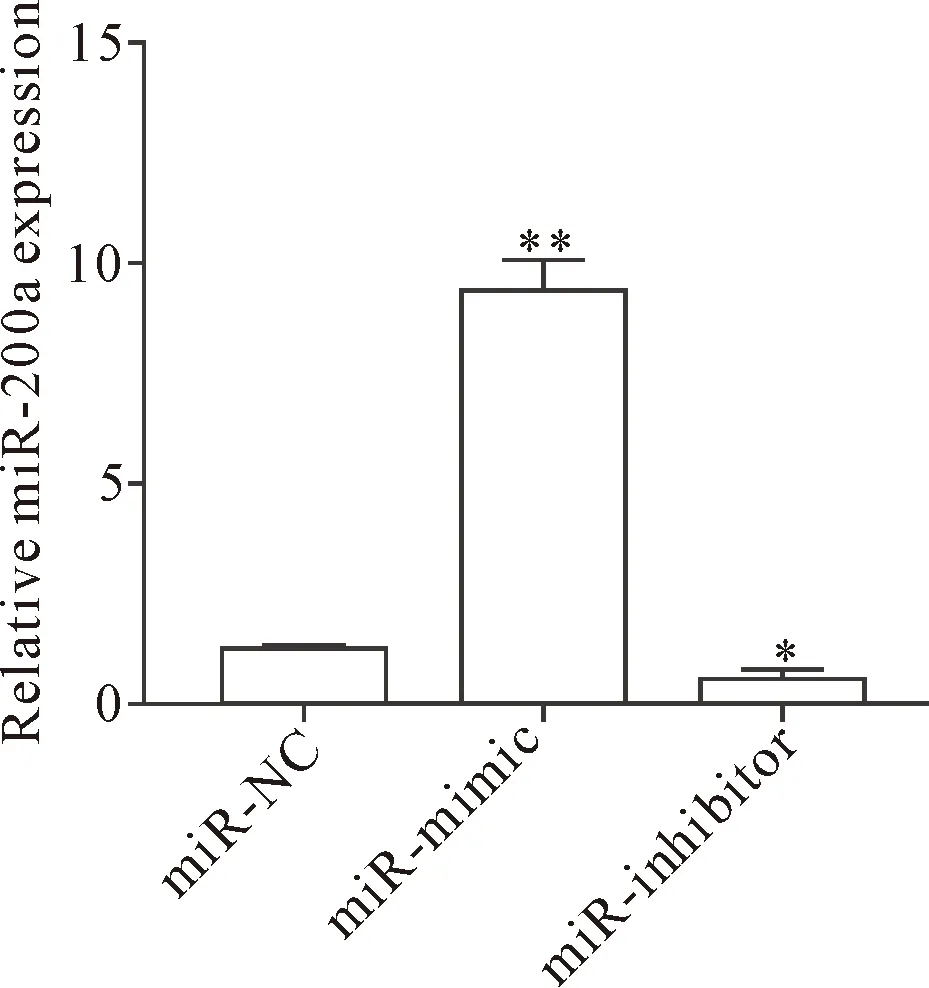
Figure 2. The relative expression of miR-200a after transfection. Mean±SD.n=3.*P<0.05,**P<0.01vsmiR-NC group.
图2 转染处理后MDA-MB-231细胞中miR-200a的表达情况
2 转染miR-200a对MDA-MB-231细胞恶性表型的影响
转染miR-200a mimic和inhibitor 组24 h后,与miR-NC组相比,细胞增殖活力无显著差异(P>0.05);转染48和72 h后,miR-mimic组的细胞增殖活力显著低于miR-NC组(P<0.05),见图3。转染24 h后,miR-mimic组MDA-MB-231细胞的早期凋亡率为(12.7±4.27)%,miR-NC组MDA-MB-231细胞的早期凋亡率为(4.61±4.07)%,miR-inhibitor 组MDA-MB-231细胞的早期凋亡率为(1.48±4.81)%,即miR-mimic组的细胞凋亡率显著增加(P<0.01),而miR-inhibitor组的细胞凋亡率显著降低(P<0.01),见图4。
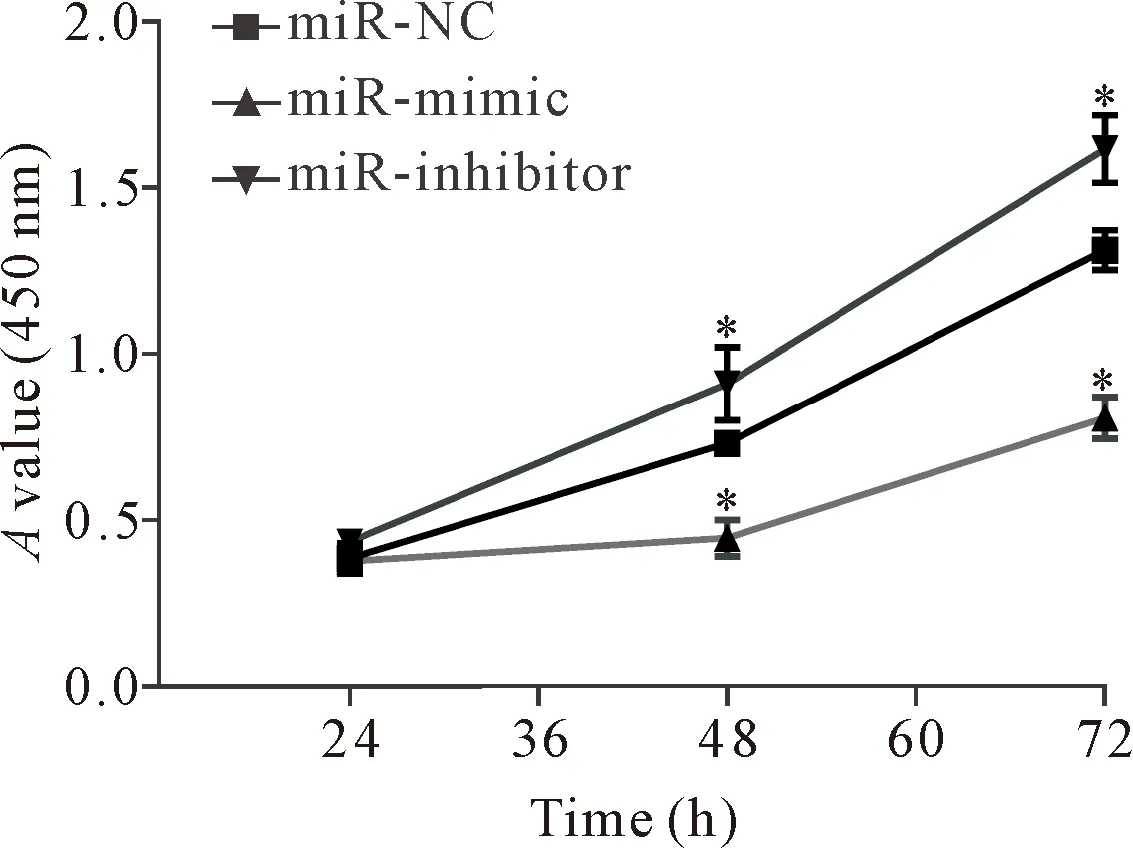
Figure 3. The viability of the MDA-MB-231 cells after miR-200a mimic or inhibitor transfection. Mean±SD.n=3.*P<0.05vsmiR-NC group.
图3 miR-200a转染后MDA-MB-231细胞活力的改变情况
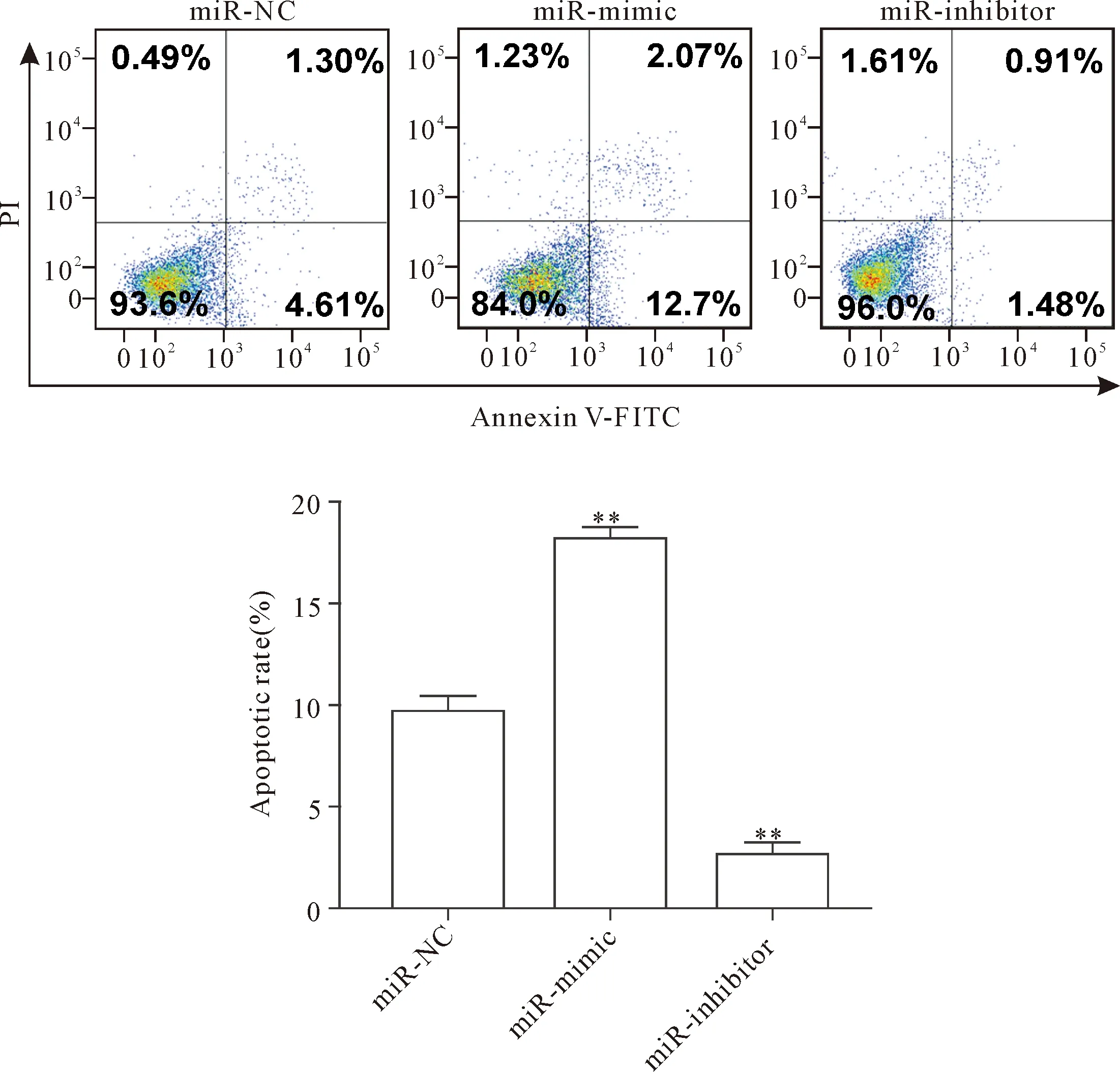
Figure 4. The apoptosis of MDA-MB-231 cells after miR-200a mimic or inhibitor transfection. Mean±SD.n=3.**P<0.01vsmiR-NC group.
图4 miR-200a转染后MDA-MB-231细胞凋亡的改变情况
Transwell侵袭实验结果显示,MDA-MB-231细胞转染24 h后,miR-mimic组的跨膜细胞数较miR-NC组显著减少(P<0.05),miR-inhibitor 组的跨膜细胞数显著增多(P<0.05),即miR-mimic组的细胞侵袭力能力显著减弱,而miR-inhibitor组的细胞侵袭力显著增加,见图5。
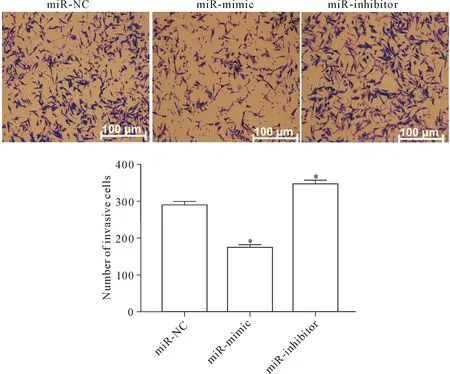
Figure 5. The invasion ability of MDA-MB-231 cells after miR-200a mimic or inhibitor transfection. Mean±SD.n=3.*P<0.05vsmiR-NC group.
图5 miR-200a转染处理后MDA-MB-231细胞侵袭能力的改变情况
3 miR-200a表达改变对MDA-MB-231细胞表型及EMT通路相关mRNA和蛋白表达的影响
RT-qPCR及Western blot结果显示,MDA-MB-231细胞转染24 h后,miR-mimic组SIP1、N-cadhe-rin、Snail、Twist、ZEB1和ZEB2的mRNA和蛋白水平上较阴性对照表达显著下调,E-cadherin在mRNA和蛋白水平上较阴性对照表达显著上调(P<0.05);miR-inhibitor组SIP1、N-cadherin、Snail、Twist、ZEB1和ZEB2在mRNA和蛋白水平上较阴性对照表达显著上调,E-cadherin在mRNA和蛋白水平上较阴性对照表达显著下调(P<0.05),见图6、7。
讨 论
MicroRNA 是一类非编码小分子RNA,可通过碱基互补的方式与靶分子mRNA特异性结合,影响mRNA的降解和翻译,在调控基因表达、细胞周期、生物体发育时序等生命过程中发挥着重要作用[10]。miR-200家族是上皮细胞的标志物,是EMT的主要调节分子之一,在多种肿瘤和正常组织间存在差异表达,其基因可作为癌基因或抑癌基因参与肿瘤的发生发展[8-9, 11-12]。然而,同一种miR-200家族分子在不同肿瘤中表现出不同的作用。在胰腺癌中miR-200a呈低表达,在癌旁正常组织中呈高表达,高表达miR-200a的胰腺癌患者预后更好,但miR-200a高表达的胰腺癌细胞的增殖能力更强。在黑色素瘤细胞中,miR-200c高表达导致较高比例的细胞以圆形“阿米巴样”的方式侵袭,而miR-200a高表达使细胞以拉长“间质型”方式侵袭。研究证实,miR-200a能通过促进PTEN的表达,抑制TGF-β1诱导的胰腺形状细胞的活化和细胞外基质的形成,并抑制AKT和mTOR的磷酸化[13]。miR-200a和miR-200b可靶向抑制PTEN的表达,促进子宫内膜细胞的体外增殖[14]。这些研究表明,miR-200家族的功能在不同类型的肿瘤或细胞中有很大的异质性,其不同亚型在乳腺癌中的具体作用尚未见报道。本项工作显示,在乳腺癌中,miR-200a的过表达可抑制癌细胞的增殖及侵袭,促进乳腺癌细胞的凋亡,提示miR-200a在乳腺癌中可发挥抑制乳腺癌恶性生物学行为的抑癌作用。
恶性肿瘤的侵袭和转移由肿瘤细胞与其存在的微环境相互作用而产生,其中EMT是肿瘤进展和肿瘤恶性表型转化的首要迹象[15]。EMT可使上皮来源的肿瘤细胞失去正常极性,失去与基底膜的连接,促进细胞外基质的沉积,肿瘤细胞获得干细胞样特性和较高迁移与侵袭能力,甚至获得耐药性[16-17]。新近研究表明,miRNA和EMT之间关系密切,过表达miR-186可抑制E-cadherin的表达从而促进肝癌细胞的侵袭[18]。在前列腺癌细胞中,miRNA-29b的高表达可以通过靶向Snail分子,逆转EMT进程,抑制细胞的浸润表型[19]。miR-200a一方面通过靶向ZEB1/ZEB2,调节cadherin复合体,从而影响Wnt/β-catenin信号通路的活性,另一方面直接抑制β-catenin的表达,进而引起细胞内β-catenin分布改变,抑制Wnt/β-catenin信号通路的活性,抑制胃癌细胞的恶性生物学表型[20]。研究证实[21],Snail、Slug、ZEB1、ZEB2以及SIP1 等转录因子可以直接结合在 E-cadherin基因上游的启动子区域,通过降低 E-cadherin表达促进EMT的发生,且这类转录因子还可以促进细胞内 ERK、NF-κB和 PI3K 等信号通路的传导,促进肿瘤的恶性生物学行为。本项工作显示,在乳腺癌中miR-200a 表达增加,癌细胞中SIP1、N-cadherin、Snail、Twist、ZEB1和ZEB2在mRNA和蛋白水平上较阴性对照均发生表达下调,E-cadherin在mRNA和蛋白水平上表达显著上调,而转染miR-200c inhibitor后上述结果被逆转,这表明miR-200a在乳腺癌中可抑制EMT进程,而miR-200a 表达增加乳腺癌细胞恶性生物学行为被抑制可能是通过抑制EMT的进程来实现的。
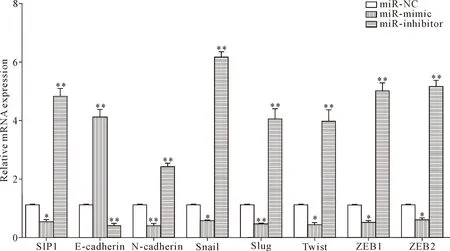
Figure 6. The changes of the mRNA expression in MDA-MB-231 cells after miR-200a mimic or inhibitor transfection. Mean±SD.n=3.*P<0.05,**P<0.01vsmiR-NC group.
图6 miR-200a转染处理后MDA-MB-231细胞mRNA表达的改变情况
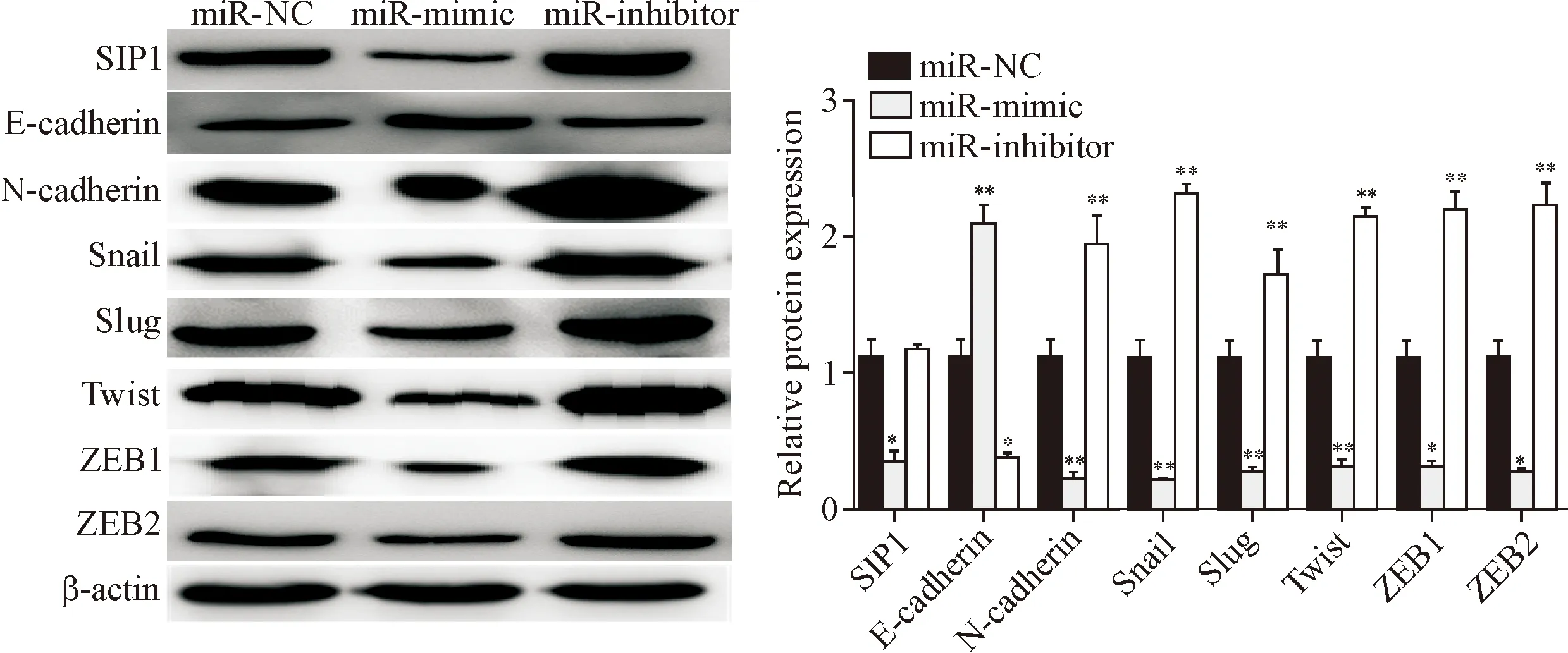
Figure 7. The changes of the proteins related to EMT signaling pathway in MDA-MB-231 cells after miR-200a mimic or inhibitor transfection. Mean±SD.n=3.*P<0.05,**P<0.01vsmiR-NC group.
图7 miR-200a转染处理后MDA-MB-231细胞EMT信号通路相关蛋白的改变情况
总之,我们通过体外研究证实,miR-200a可以抑制乳腺癌细胞的增殖,侵袭,促进乳腺癌细胞的凋亡,其可能机制是通过调节乳腺癌细胞的EMT来实现的,miR-200a可作为乳腺癌患者潜在的生物治疗靶点。但是miR-200a对乳腺癌细胞EMT表型的靶向调控方式,miR-200a表达改变对乳腺癌细胞EMT相关信号通路的影响,miR-200a表达水平与乳腺癌患者临床病理特征及预后之间的关系等尚不清楚,有待深入研究。

