CART肽通过激活ERK抑制氧糖剥夺诱导的星形胶质细胞AQP-4上调*
刘丽冰, 王 伟, 李 烁, 祝世功△
(1潍坊市益都中心医院, 山东 青州 262500; 2北京大学医学部基础医学院, 北京 100191)
可卡因-苯丙胺调节转录(cocaine- and amphetamine-regulated transcript,CART)肽是一种在体内广泛分布的神经内分泌活性肽,具有广泛的生理作用[1-2]。近年来的研究证实CART肽可通过多种途径发挥神经保护作用,例如Sha等[3]报道,CART肽可增加线粒体呼吸链复合物II活性并减轻糖氧剥夺(oxygen-glucose deprivation,OGD)诱导的神经元损伤。Jia等[4]证实CART肽可通过激活细胞外信号调节激酶(extracellular signal regulated kinase,ERK)通路显著减轻脑缺血再灌注引起的神经元损伤。我们前期的部分工作也证实CART肽能抑制N-甲基门冬氨酸(N-methyl-D-aspartic acid,NMDA)诱导的海马神经元凋亡[5],还可通过上调脑源性神经营养因子(brain derived neurotrophic factor,BDNF)的合成与分泌减轻脑缺血再灌注后的内质网应激反应[6]。
研究显示,水通道蛋白4(aquaporin 4,AQP-4)为水通道蛋白家族的重要成员之一,在脑内主要分布于脑微血管周围星形胶质细胞的终足和室管膜细胞上,在脑水肿的形成过程中起着重要作用[7-8]。本研究室前期工作证实,CART肽能够抑制缺血再灌注小鼠脑组织水通道蛋白 4的表达和减轻脑水肿[9],还观察到CART肽激活 ERK通路促进海马神经元合成脑源性神经生长因子[10]。
我们推测ERK通路可能参与CART肽对AQP-4表达的调节,但具体的机制尚待阐明。
材 料 和 方 法
1 实验分组
培养的小鼠脑皮层星形胶质细胞鉴定成功后接种于培养板,2代星形胶质细胞共分为4组。对照(control)组加药时只添加等量PBS,模型组(OGD组)仅给予OGD处理,CART组给予OGD加用CART肽处理,CART+PD98059组给予OGD、CART肽并加用PD98059处理。CART及CART+PD98059组在OGD开始同时便加入CART肽,剂量参照实验室前期工作[11],选用10 nmol/L,复氧复糖后加入含CART肽的高糖培养基。CART+PD98059组在OGD前加入PD98059预处理30 min,剂量为25 μmol/L[10]。
2 主要试剂
DNA酶Ⅰ、胎牛血清(fetal bovine serum,FBS)、山羊血清、DMEM培养基和胰蛋白酶均购自Gibco;CART肽购自Phoenix;PD98059(MEK抑制剂)购自Calbiochen;兔抗胶质细胞原纤维酸性蛋白(glial fibrilillary acidic protein, GFAP)多克隆抗体、兔抗AQP-4抗体、兔抗-ERK单克隆抗体和兔抗ERK多克隆抗体均购自Santa Cruz;兔抗β-actin抗体购自CST;Biotin标记的山羊抗兔Ⅱ抗和TRITC标记的山羊抗兔Ⅱ抗均购自北京中杉金桥生物技术公司;4’,6-二脒基-2-苯基吲哚(DAPI)、MTT、RIPA裂解液和BCA蛋白定量试剂盒购自碧云天生物技术公司;蛋白质分子量预染marker购自Pierce。
3 实验方法
3.1星形胶质细胞培养及鉴定 小鼠脑皮层星形胶质细胞培养按本研究室前期实验方法进行并稍加修改[12]。简言之,选用出生24 h内的ICR小鼠[购自北京大学医学部实验动物中心,动物合格证号:SYXK(京)2016-0041]。无菌条件下分离小鼠的大脑皮层,在预冷的DMEM液中去除脑膜和血管,用眼科剪切成约1 mm×1 mm×1 mm的组织块,加0.25%的胰蛋白酶溶液,37 ℃水浴消化10 min,再加入含有10% 胎牛血清的高糖 DMEM 进行终止消化,然后加入适量 DNA酶Ⅰ(1×105U/L), 进行反复吹打制成细胞悬液,100目筛网过滤和离心后; 重悬于培养液中,接种于多聚赖氨酸预包被的细胞培养板中。置于 37 ℃、5% CO2培养箱中进行培养,每3 d换液1次。10 d后于37 ℃恒温摇床 180 r/min 振荡5 h,去除小胶质细胞和少突胶质细胞,再使用2.5 g/L 胰蛋白酶消化传代。将所传第2代的星形胶质细胞接种于多聚赖氨酸预包被的盖玻片上,48 h后取出,PBS 洗3次,每次5 min;4%多聚甲醛固定 30 min,PBS 洗3次,每次5 min;再用10%山羊血清封闭30 min,加兔抗GFAP抗体(1∶500),4 ℃冰箱孵育过夜,PBS 洗3次,每次5 min;加入TRITC标记的山羊抗兔Ⅱ抗,室温下孵育 2 h,PBS 洗3次,每次5 min;细胞核用DAPI染色显示,缓冲甘油封片,荧光显微镜下观察。
3.2OGD模型制作 参照实验室前期工作[6],需要行OGD处理的细胞培养板更换无糖的DMEM培养液,放入含有95% N2和5% CO2的37 ℃培养箱中培养4 h;然后复氧复糖,更换高糖DMEM培养基,再置于37 ℃、5% CO2培养箱中培养24 h。
3.3MTT法检测细胞活力 参考本实验室前期所使用方法[5]。简言之,培养在 96孔板的细胞,每孔加入MTT溶液。活细胞内线粒体琥珀酸脱氢酶能将淡黄色的MTT还原为蓝紫色结晶甲臜,所以甲臜的数量与活细胞成正比,酶标仪检测每孔的吸光度(absorbance,A;检测波长 560 nm,参比波长 630 nm)。相对细胞活力(%)=A(各组)/A(control)×100%。
3.4Western blot检测 同样参照实验室前期使用方法[10],简言之,经过处理后的各组细胞,弃去上清液,用预冷的PBS清洗 2 次,加入RIPA裂解液,冰面上裂解15 min,然后12 000 r/min,4 ℃离心15 min,取上清,通过蛋白定量试剂盒进行蛋白定量。以 10% SDS-PAGE分离,半干电转移法转移至NC膜,裁剪相应分子量的NC膜条带,室温下用封闭液封闭1 h,然后加入使用封闭液稀释的相应的Ⅰ抗,4 ℃孵育过夜,TBST洗膜,然后用封闭液稀释的相应Ⅱ抗室温孵育1 h,TBST洗膜后加入适当等比例混合好的ECL发光试剂,孵育1 min,暗室中曝光。曝光后的胶片经显影定影处理后,获得实验结果。
4 统计学处理
以GraphPad Prism 5.0软件分析作图。所有实验结果以均数±标准差(mean±SD)表示,组间比较采用单因素方差分析(one-way ANOVA),若方差齐,则选用Bonferroni法进行组间比较;若方差不齐,则选用Tamhane法进行组间比较,以P<0.05为差异有统计学意义。
结 果
1 CART肽提高OGD后星形胶质细胞的活力
所传的第2代细胞,以GFAP抗体标记星形胶质细胞,以DAPI标记细胞核,培养的细胞中,星形胶质细胞比例在90%以上,见图1A。以MTT法检测OGD处理后各组星形胶质细胞的活力,OGD组细胞相对活力为63.32%±7.42%,较control组显著降低(P<0.01),而CART肽显著提升了OGD处理后的星形胶质细胞存活率(P<0.01),见图1B。
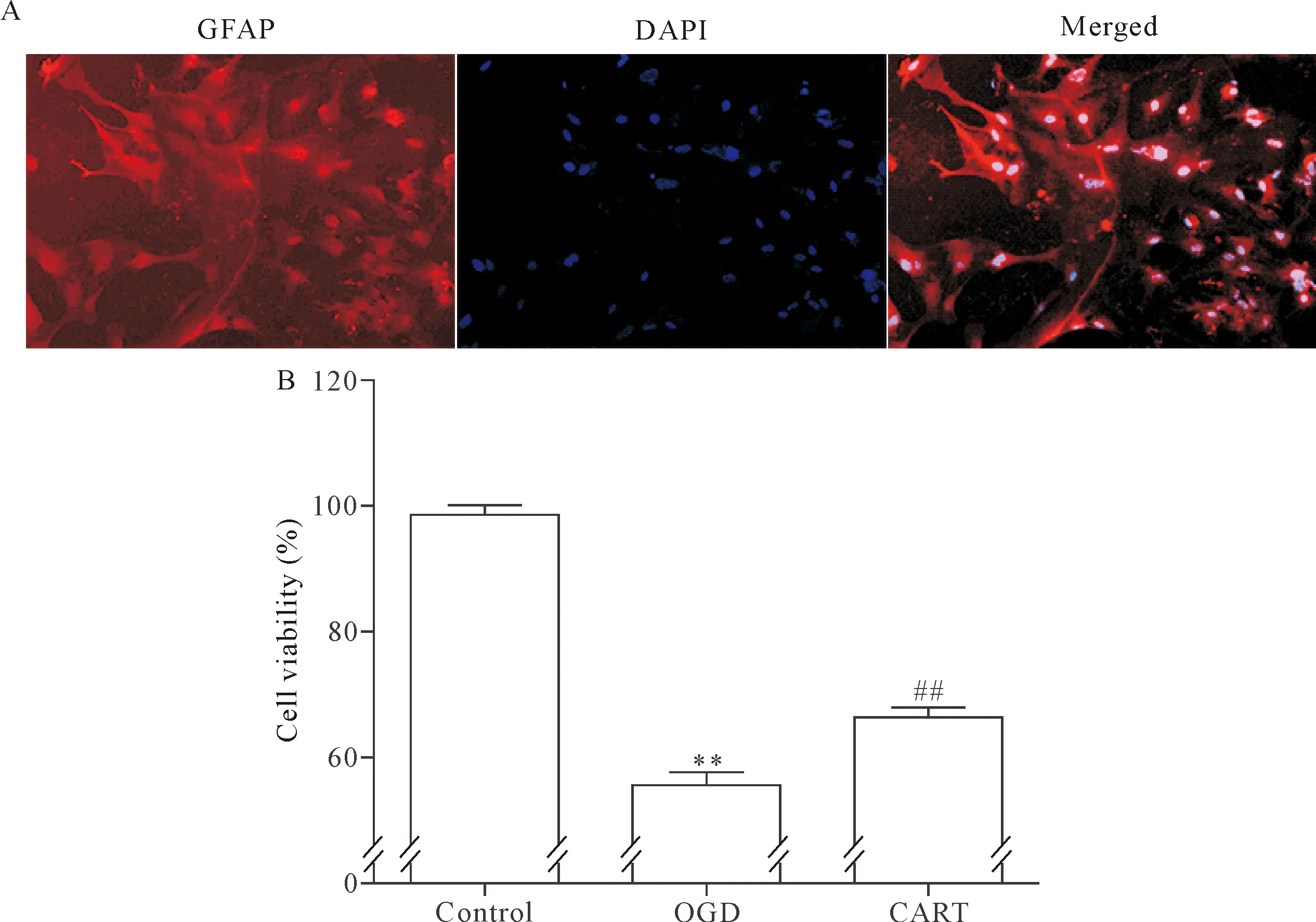
Figure 1. CART peptide induced a significant increase in the cell viability after OGD. A: DAPI and GFAP staining (×400); B: cell viability was determined by MTT assay. Mean±SD.n=6.**P<0.01vscontrol group;##P<0.01vsOGD group.
图1 CART肽提高OGD后星形胶质细胞的活力
2 CART肽促进星形胶质细胞ERK的磷酸化
Western blot检测各组星形胶质细胞ERK磷酸化的程度,结果显示,各组的ERK总量并无明显差异;而在ERK磷酸化方面,与control组量化后,OGD组的p-ERK蛋白水平为106.9%±11.51%,给予CART肽能显著引起星形胶质细胞p-ERK蛋白水平(126.4%±12.55%)的增加(P<0.05);而采用ERK上游激酶MEK的拮抗剂PD98059处理后, p-ERK的蛋白水平(102.2%±12.73%)显著减少(P<0.01),见图2。
3 PD98059减弱CART肽抑制OGD后星形胶质细胞AQP-4表达的作用
Western blot检测各组细胞AQP-4的含量,结果显示,OGD组的AQP-4蛋白水平为171.4%±15.9%,CART肽能够抑制OGD后星形胶质细胞AQP-4的表达(138.8%±16.89%;P<0.01),而给予PD98059后,CART肽的作用显著受到抑制,AQP-4的表达(162.1%±18.79%)较CART组升高(P<0.05),见图3。

Figure 2. CART peptide enhanced the phosphorylation level of ERK after OGD, which was inhibited by PD98059 pretreament. Mean±SD.n=6.##P<0.01vsCART group;*P<0.05vsOGD group.
图2 CART肽促进星形胶质细胞ERK的磷酸化
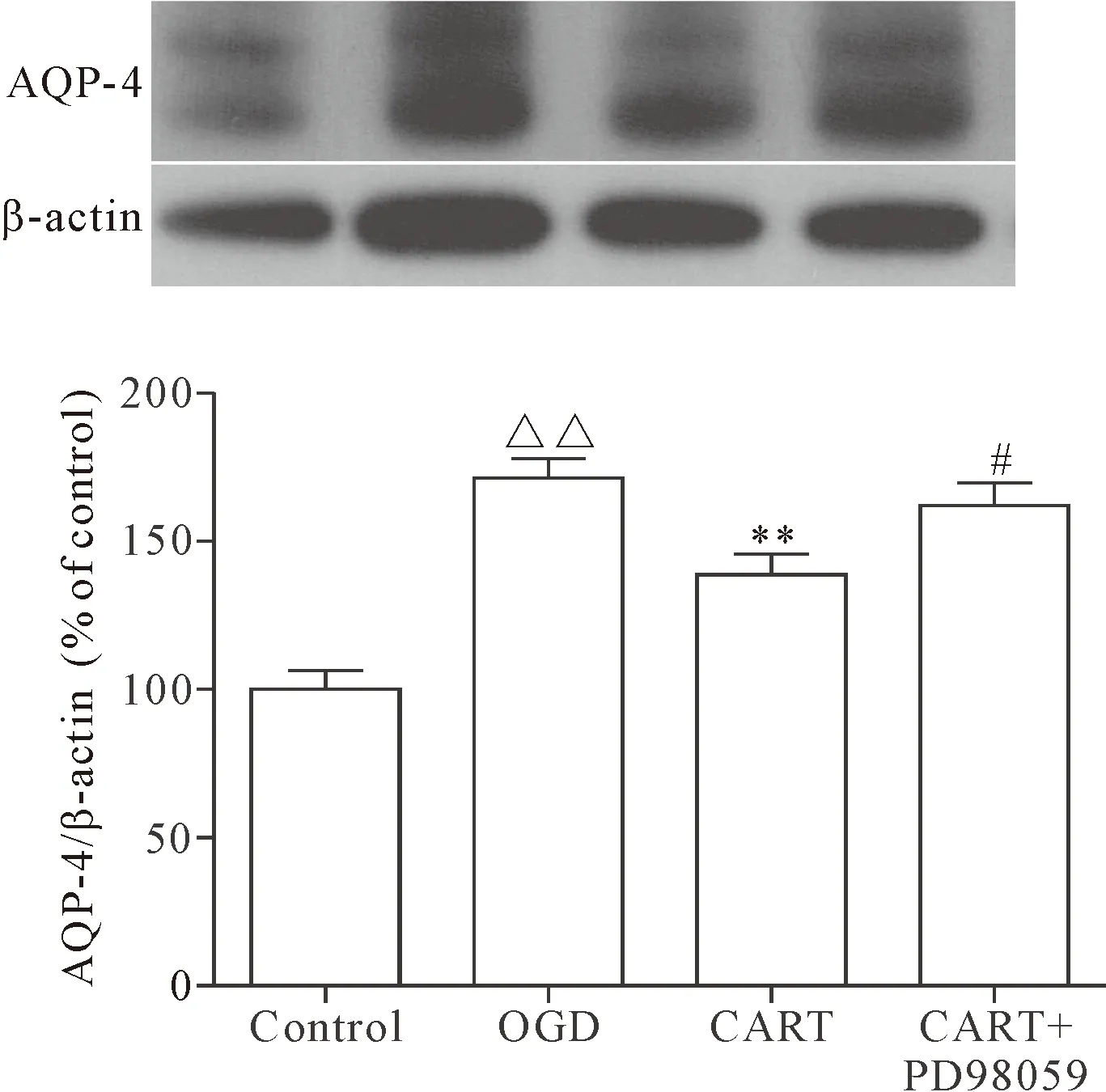
Figure 3. PD98059 inhibited down-regulation of AQP-4 expression induced by CART peptide after OGD. Mean±SD.n=6.#P<0.05vsCART group;**P<0.01vsOGD group;△△P<0.01vscontrol group.
图3 PD98059减弱CART 肽对OGD后星形胶质细胞AQP-4表达的抑制作用
讨 论
缺血性脑血管疾病是目前临床上常见的一类疾病,具有高致残和并发症难以治愈等特点,而脑缺血所引起的脑水肿,是目前导致患者死亡的最主要原因,因此防治脑水肿一直是临床上治疗相关疾病的重点。研究证明AQP-4在脑内的表达与脑水肿的形成密切相关[7],其上调可加重脑缺血后脑水肿的形成[13-14]。
CART肽是近些年新发现的在体内广泛分布的神经内分泌活性肽,具有多种生物学作用,近年来对于其与一些临床疾病的相关研究已经积累了大量资料。我们的前期工作发现CART肽具有脑保护作用,可以起到神经营养作用,并通过多种途径可以提高神经元在受到损伤后的生存率[5-6, 10]。我们近期的研究还发现,CART肽可以通过抑制AQP-4的上调,减轻脑缺血再灌注后的脑水肿[9],这证明AQP-4是CART肽在脑缺血再灌注损伤中发挥脑保护作用的重要靶点之一。本文进一步探索CART肽调节AQP-4的分子机制。
AQP-4在脑内主要分布于脑微血管周围星形胶质细胞的终足和室管膜细胞上[8],故本实验通过小鼠脑星形胶质细胞氧葡萄糖剥夺诱导损伤模型进行研究。我们先前的研究已经证明了CART肽的脑保护作用,但实验对象多为神经元,本实验证明,CART肽同样能够提高氧糖剥夺后星形胶质细胞的活力,进一步完善了对CART肽脑保护作用的认识。 我们先前的动物实验证明[9],CART肽能够减轻脑缺血再灌注后的脑水肿及抑制AQP-4的表达,本实验采用小鼠星形胶质细胞进行OGD实验,取得结果与动物实验保持了一致。本实验室的前期工作证实,CART肽能够通过激活ERK促进海马神经元合成 BDNF,进而抑制内质网应激,减少脑缺血再灌注引起的神经元凋亡[6, 10, 12],Jia等[4]的相关研究也指出,CART肽可通过激活ERK通路减轻小鼠脑缺血再灌注后的损伤。本研究证明CART可以提高星形胶质细胞在予氧糖剥夺-再灌注处理后ERK的磷酸化水平,而这种变化可被ERK上游激酶MEK的拮抗剂PD98059拮抗。目前的国内外资料已经证实了CART肽的脑保护作用,可以调节AQP-4并减轻脑水肿,但目前对于CART肽如何调控AQP-4尚未有报道,本研究通过星形胶质细胞氧糖剥夺模型并加入PD98059证实,CART肽可通过激活ERK通路抑制AQP-4的上调,进而减轻脑水肿,起到脑保护作用。
综上所述,CART肽作为一种内源性肽,可以提高氧糖剥夺后星形胶质细胞的活力,并可通过激活ERK通路抑制AQP-4的表达。这些结果对于探寻脑缺血再灌注损伤的治疗可能具有重要意义。

