miR-486调控PTEN影响LPS诱导的肺泡上皮细胞A549凋亡的实验研究*
戴春威, 贾 珊, 陈 敏, 樊 琳, 何赛飞
(1庆阳市人民医院儿科, 甘肃 庆阳 745000; 2上海市中医药大学附属第七人民医院核医学科, 上海 200137)
肺泡上皮细胞是肺组织损伤发生时的靶细胞之一,其中肺泡Ⅱ型上皮细胞过度凋亡是肺损伤发生的重要原因[1]。内毒素是引起肺损伤发生的诱导因子,而脂多糖(lipopolysaccharide,LPS)是内毒素的主要成分,由LPS诱导的肺泡上皮细胞凋亡也是目前研究肺损伤发生机制的常见模型[2]。随着分子生物学的不断发展,微小RNA(microRNA,miRNA)在肺泡上皮细胞损伤中的作用受到广泛关注,肺泡上皮细胞中某些miRNA异常表达导致细胞特性异常,从而诱发肺组织功能缺失[3]。由于原代肺泡Ⅱ型上皮细胞对于微环境等要求极高,目前常用肺泡Ⅱ型上皮细胞来源的A549细胞作为研究对象[4]。miR-486是一个与细胞凋亡关系密切的miRNA分子,其在氧化应激条件下的肺泡上皮细胞中发挥保护作用,具有抗细胞凋亡的作用[5]。现阶段对于miR-486在LPS诱导的肺泡上皮细胞中的作用尚不清楚。本次实验以肺泡Ⅱ型上皮细胞来源的A549细胞作为体外实验对象,探讨miR-486在LPS诱导的肺泡上皮细胞凋亡中的作用和机制。
材 料 和 方 法
1 材料
肺泡Ⅱ型上皮细胞A549购自ATCC。LPS购自杭州联科生物技术股份有限公司;引物由南京金斯瑞生物科技有限公司合成;miR-486 mimics、mimics control、pcDNA 3.1-PTEN和pcDNA 3.1均由上海吉玛制药技术有限公司构建并合成;抗第10号染色体同源缺失性磷酸酶-张力蛋白(phosphatase and tensin homolog deleted on chromosome 10,PTEN)抗体购自Abcam;抗cleaved caspase-3(C-caspase-3)抗体和C-caspase-9抗体购自上海碧云天生物技术有限公司;MicroRNA Reverse Transcription Kit购自QIAGEN;萤光素酶报告载体由湖南普拉特泽生物科技有限公司构建。
2 方法
2.1RT-qPCR检测LPS诱导后肺泡上皮细胞中miR-486表达变化 肺泡上皮细胞用含150 mg/L LPS[2]的细胞培养液培养,记为LPS组,用不含LPS的细胞培养液培养记为对照(control)组,细胞培养24 h以后,用RT-qPCR检测细胞中miR-486的表达变化。RT-qPCR步骤为:利用TRIzol分别提取细胞中的总RNA,依照MicroRNA Reverse Transcription Kit进行反转录,利用SYBR Premix Ex Taq进行RT-qPCR,U6为内参照,反应结束以后根据每个反应的Ct值按照2-△△Ct方法分析miR-486表达变化。miR-486的上游引物序列为5’-ACACTCCAGCTGGGTCCTGTACTGACCTGCCC-3’,下游引物序列为5’-CTCAACTGGTCTCGTGGA-3’;U6的上游引物序列为 5’-CTCGCTTCGGCAGCACATATACT-3’,下游引物为5’-ACGCTTCACGAATTTGCGTGTC-3’。PCR仪参数为:95℃ 30s;95℃ 5s,60℃ 30s,共40个循环。
2.2细胞转染 用转染试剂Lipofectamine 2000分别把miR-486 mimics和mimics control转染到肺泡上皮细胞中,转染步骤完全按照转染试剂操作说明进行。细胞转染后,用含有150 mg/L LPS的细胞培养液培养24 h,分别记为miR-486+LPS组和miR-NC+LPS组,按照方法2.1中RT-qPCR方法测定细胞中miR-486的表达变化。
2.3流式细胞术测定细胞凋亡 取培养24 h以后的各组细胞,PBS洗涤后每组每个样品收集约1×106个细胞,把细胞悬浮在500 μL的Binding Buffer溶液中,继续添加5 μL的PI及Annexin V-FITC,孵育完毕立即用流式细胞仪测定各组细胞凋亡变化。
2.4Western blot检测细胞中C-caspase-3和C-caspase-9蛋白表达水平 在培养24 h以后的各组细胞中分别加入添加PMSF的RIPA蛋白提取试剂,均匀振混合以后,在冰上完全裂解,把裂解溶液转移到4℃中高速离心(12 000×g,离心10 min),得到的上清溶液转移到EP管内,采用BCA法定量检测以后,进行SDS-PAGE。在电泳前将蛋白样品同上样缓冲液混合煮沸5 min,每个上样孔内添加30 μg蛋白样品。使用10%的分离胶进行电泳,采用恒压90 V电泳约3 h,观察染料进入到底部边缘以后终止电泳。转膜电流为250 mA恒流,转膜持续60 min。转膜后的PVDF膜放在提前配制的5%牛血清白蛋白封闭液中室温孵育1.5 h,再分别与I抗(4 ℃反应过夜)、II抗(37 ℃反应1 h)依次反应以后,按照常规ECL方法显色,用Image J软件分析条带的灰度值,β-actin作为内参照,对蛋白水平进行分析比较。
2.5靶基因预测及萤光素酶报告系统鉴定 利用靶基因预测软件预测PTEN可能是miR-486的靶基因,miR-486与PTEN的3,UTR端有互补结合位点,把PTEN的互补结合位点突变,构建突变型(MUT)萤光素酶报告载体,同时构建没有突变的野生型(WT)萤光素酶报告载体,用Lipofectamine 2000分别将WT、MUT与miR-486 mimics、mimics control共转染至细胞中,继续培养24 h以后,利用萤光素酶活性测定试剂盒检测萤光素酶活性变化。
2.6上调PTEN后,观察miR-486 mimics对LPS诱导的肺泡上皮细胞凋亡的影响 用Lipofectamine 2000分别将miR-486 mimics和pcDNA 3.1-PTEN、miR-486 mimics和pcDNA 3.1共转染至肺泡上皮细胞中,使用含150 mg/L LPS的细胞培养液培养记为miR-486+pcDNA3.1+LPS组和miR-486+PTEN+LPS组。流式细胞术测定细胞凋亡变化,Western blot检测细胞中PTEN、C-caspase-3和C-caspase-9蛋白表达变化,步骤均同上。
3 统计学分析
实验数据用SPSS 21.0软件分析,计量资料用均数±标准差(mean±SD)表示,两组数据间比较采用t检验,多组差异比较用单因素方差,组间比较采用SNK-q检验,以P<0.05为差异有统计学意义。
结 果
1 miR-486 mimics上调LPS诱导的肺泡上皮细胞中miR-486的表达水平
肺泡上皮细胞经过LPS处理以后,细胞中的miR-486水平显著降低(P<0.05),说明LPS诱导肺泡上皮细胞中miR-486表达下调;肺泡上皮细胞转染miR-486 mimics后,LPS刺激的细胞中miR-486的表达水平显著升高(P<0.05),说明miR-486 mimics可以显著上调LPS诱导的肺泡上皮细胞中miR-486的表达水平,见表1。
表1 miR-486 mimics上调LPS诱导的肺泡上皮细胞中miR-486表达水平
Table 1. miR-486 mimics up-regulate the expression of miR-486 in LPS-induced alveolar epithelial cells (Mean±SD.n=3)

GroupmiR-486Control1.00±0.10LPS0.64±0.08∗miR-NC+LPS0.63±0.05miR-486+LPS1.35±0.12#
*P<0.05vscontrol group;#P<0.05vsmiR-NC+LPS group.
2 miR-486 mimics减少LPS诱导的肺泡上皮细胞凋亡
肺泡上皮细胞经过LPS刺激以后,细胞凋亡率显著升高,细胞中C-caspase-3和C-caspase-9蛋白水平也显著升高(P<0.05);转染miR-486 mimics后,LPS诱导的细胞凋亡率显著下调,并且细胞中的C-caspase-3和C-caspase-9蛋白水平显著降低(P<0.05),见图1。结果提示miR-486 mimics减少LPS诱导的肺泡上皮细胞凋亡。
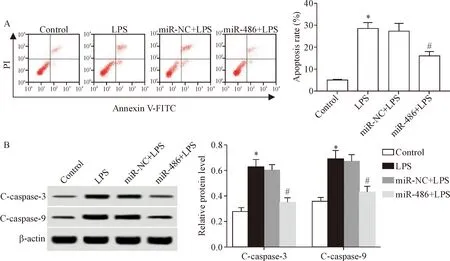
Figure 1. Effects of miR-486 mimics transfection on apoptosis of alveolar epithelial cells after LPS treatment.A: flow cytometry was used to detect apoptotic rate in each group; B: Western blot was used to detect the expression of C-caspase-3 and C-caspase-9 in cells of each group.Mean±SD.n=3.*P<0.05vscontrol grpup;#P<0.05vsmiR-NC+LPS group.
图1 miR-486 mimics转染对LPS诱导的肺泡上皮细胞凋亡的影响
3 miR-486靶向调控PTEN的表达
靶基因预测软件发现miR-486同PTEN的3’-UTR端有互补结合位点,见图2;经过双萤光素酶报告系统鉴定发现PTEN为miR-486的靶基因,见表2。
Position 719-726 of PTEN 3’ UTR 5’...UGAAUCUGUAUUGGGGUACAGGA
hsa-miR-486 3’ GAGCCCCGUCGAGUCAUGUCCU
Figure 2. Target gene prediction software predicts that there are binding sites at the 3’UTR ends of PTEN and miR-486.
图2 靶基因预测软件预测miR-486与PTEN的3’UTR端有结合位点
表2 萤光素酶报告系统测定萤光素酶活性变化
Table 2. Luciferase activity changes determined by luciferase reporting system(Mean±SD.n=3)
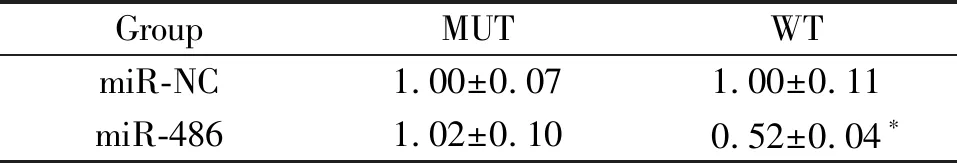
GroupMUTWTmiR-NC1.00±0.071.00±0.11miR-4861.02±0.100.52±0.04∗
*P<0.01vsmiR-NC group.
4 miR-486 mimics下调LPS诱导的肺泡上皮细胞中PTEN的表达
LPS处理后的肺泡上皮细胞中的PTEN蛋白表达水平显著升高(P<0.05),转染miR-486 mimics后的肺泡上皮细胞中PTEN蛋白表达水平显著下降(P<0.05),见图3,说明miR-486负调控PTEN蛋白的表达。

Figure 3. Effects of miR-486 mimics transfection on PTEN expression in LPS-treated alveolar epithelial cells.Mean±SD.n=3.*P<0.05vscontrol group;#P<0.05vsmiR-NC+LPS group.
图3 miR-486 mimics转染对LPS处理的肺泡上皮细胞中PTEN蛋白表达的影响
5 上调PTEN逆转miR-486 mimics对LPS诱导的肺泡上皮细胞凋亡影响
将miR-486 mimics和pcDNA 3.1-PTEN共转染可以显著提高LPS诱导的肺泡上皮细胞凋亡水平,并促进细胞中PTEN、C-caspase-3和C-caspase-9蛋白的表达,与共转染miR-486 mimics和pcDNA 3.1的细胞比较,差异显著(P<0.05),见图4,说明上调PTEN可逆转miR-486 mimics对LPS诱导的肺泡上皮细胞凋亡的影响。
讨 论
肺泡Ⅱ型上皮细胞具有分泌活性物质、维持肺泡气体交换等作用,在肺组织功能维持中具有关键作用[6]。LPS是内毒素的主要成分,也是肺组织中肺泡Ⅱ型上皮细胞损伤发生的直接诱导因子[7]。我们的实验以LPS刺激肺泡Ⅱ型上皮细胞来源的A549细胞,观察到LPS刺激可以提高细胞凋亡水平,说明成功构建了LPS诱导的肺泡上皮细胞损伤模型。
miR-486是近年发现在人体组织中具有一系列生物学作用的miRNA分子,与造血细胞分化和干细胞衰老等正常生理学过程有关,还与心肌纤维化和肿瘤等有关[8-11]。miR-486在氧化应激及PM2.5诱导的肺泡上皮细胞凋亡中表达下调,并且上调miR-486可以减少细胞凋亡发生,从而发挥细胞保护的作用[5]。本实验观察到,LPS处理后的肺泡上皮细胞中的miR-486的表达水平下降,通过细胞转染的方法上调miR-486后可以显著减少LPS诱导的肺泡上皮细胞凋亡,这提示miR-486在肺组织损伤中可能发挥抗损伤作用。
现阶段对于miRNA的研究表明,其可以通过靶向调控靶基因的表达发挥各种生物学作用,并且同一个miR-486可能同时含有多个靶基因[12]。研究者们发现miR-486有GAB2、CLDN10、CITRON和Sirt1等多个靶基因,参与不同组织细胞的病理及生理过程[13-15]。本实验检测miR-486与PTEN有靶向结合互补位点,经过双萤光素酶系统鉴定PTEN为miR-486的靶基因。PTEN是一个与细胞凋亡有关的凋亡促进因子,其可以激活细胞中caspase级联反应诱导凋亡,在心肌缺血损伤、缺氧神经元损伤和脊柱损伤等过程中发挥保护作用[16-18]。caspase-3和caspase-9是caspase蛋白家族成员,只有被活化后形成C-caspase-3和C-caspase-9才可以诱导细胞凋亡的发生[19-21]。本研究显示,过表达miR-486可以降低肺泡上皮细胞中PTEN的表达,并且PTEN上调可以逆转miR-486 mimics对LPS诱导的肺泡上皮细胞凋亡及C-caspase-3、C-caspase-9表达的抑制作用,这提示miR-486可能通过靶向负调控PTEN的表达影响caspase级联反应从而减少LPS诱导的肺泡上皮细胞凋亡发生。
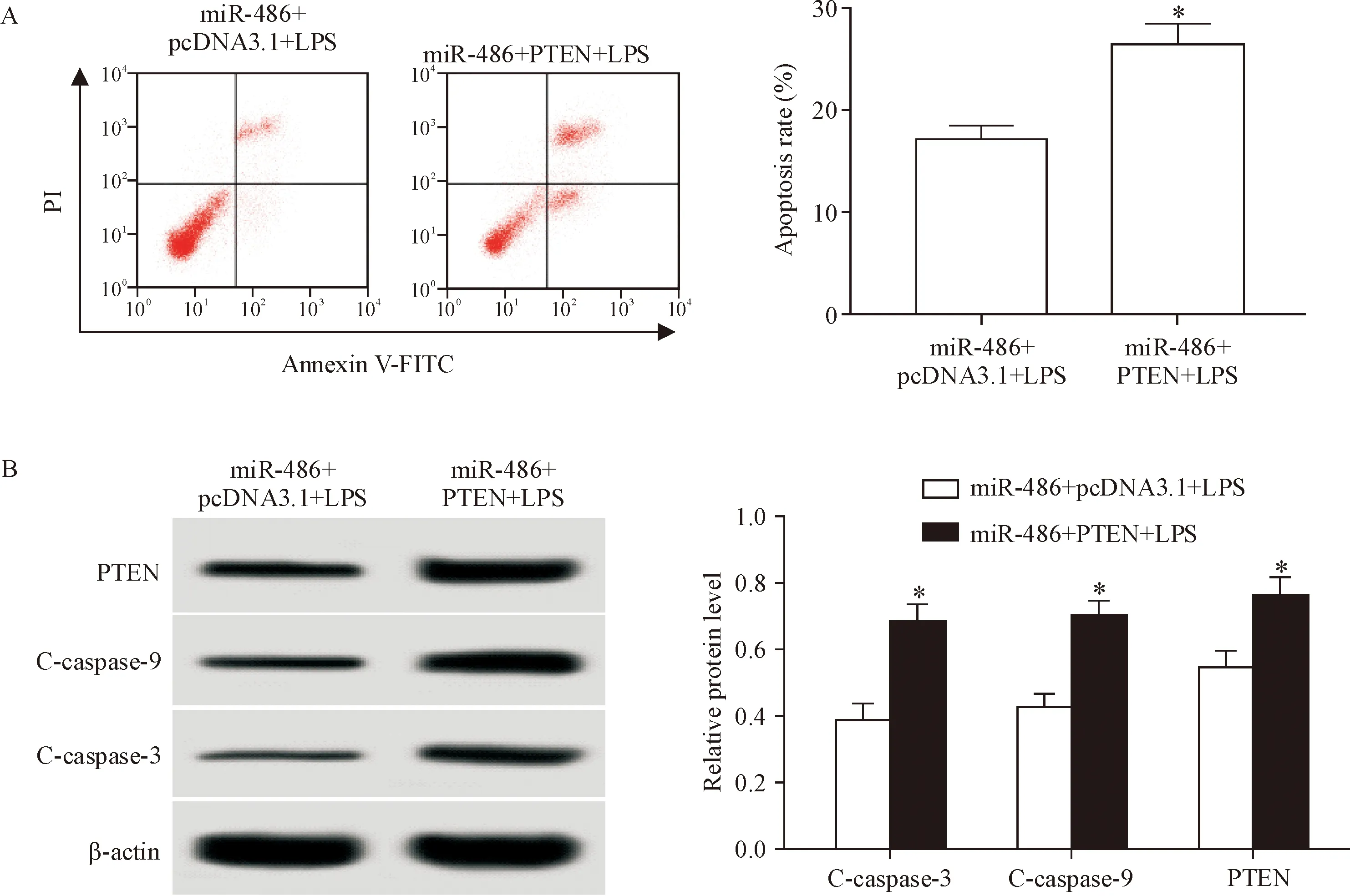
Figure 4. Effects of co-transfection of miR-486 mimics and pcDNA 3.1-PTEN on LPS-induced apoptosis of alveolar epithelial cells.A:the apoptotic rate of alveolar epithelial cells were detected by flow cytometry;B:Western blot was used to detect the expression of PTEN, C-caspase-3 and C-caspase-9 in alveolar epithelial cells. Mean±SD.n=3.*P<0.05vsmiR-486+pcDNA 3.1+LPS group.
图4 miR-486 mimics和pcDNA 3.1-PTEN共转染对LPS诱导的肺泡上皮细胞凋亡的影响
本次实验没有探讨PTEN通过何种靶向关系调控细胞凋亡,对于miR-486在原代肺泡Ⅱ型上皮细胞中的作用还不明确,在以后的实验中会进行具体的探讨。本次实验证实了miR-486在LPS诱导的肺泡上皮细胞凋亡中的作用,并且对于其机制进行了初步探讨,这对于研究miR-486在肺组织损伤中的调控网络具有参考价值。

