p53转录激活的miR-192在小鼠急性肝损伤发病过程中的表达变化*
杨 雅, 王 鸣, 艾 国
(华中科技大学同济医学院附属同济医院 1感染科, 2儿科, 湖北 武汉 430030)
急性肝损伤(acute liver injury,ALI)是临床上常见的一种疾病,病情发展迅速、凶险,临床典型特征表现为肝功能衰竭,肝组织中大量肝细胞坏死和凋亡[1],若未得到及时的诊断和治疗,将会发展为病死率非常高的重症肝炎和肝功能衰竭等不可逆性疾病。导致急性肝损伤的因素包括肝炎病毒、化学性毒物或药物、酒精及放射性刺激因素等。虽然已有较多研究探讨了其致病机制,但目前尚未完全清楚。作为一种应激蛋白,肿瘤抑制因子p53在组织细胞受损时会出现反应性升高,转录激活下游mRNA引起细胞周期停滞及凋亡等,然而有研究表明p53的表达增加对受损细胞还能起到保护作用[2-3],但尚未明确p53的这种作用是如何实现的。除了通过对下游mRNA的调控来发挥相应功能,转录因子p53还能转录激活或抑制下游的微小RNA(microRNA,miRNA,miR)的表达,从而在转录后水平行使其功能[4-5]。近年来,microRNA在疾病的发生发展过程中的重要作用已受到越来越多的关注,其中microRNA-192(miR-192)由p53蛋白转录激活[6],并在肝组织中表达丰度高,具有一定的组织特异性,但它在急性肝损伤中的作用及机制目前尚并不明确。因此,本实验通过建立细菌脂多糖(lipopolysaccharide,LPS)联合D-氨基半乳糖(D-galactose,D-GalN)诱导的小鼠内毒素性急性肝损伤模型,以期发现p53转录激活的miR-192在肝损伤中的表达变化,以及p53、p21和miR-192在肝损伤过程中的对应关系。
材 料 和 方 法
1 动物和主要试剂
SPF 级雄性BALB/c小鼠24只,6~8 周龄,体重 18~22 g,购自湖北省实验动物研究中心,许可证编号为SYXK(鄂2014-0049)。实验前1 d领取动物,分笼饲养,自由进食和饮水。D-GalN和 LPS均购自Sigma-Aldrich;TRIzol试剂购自Invitrogen;PrimeScriptTMRT Master Mix试剂盒、TaqDNA聚合酶和SYBR GreenⅠ荧光染料购自TaKaRa;小鼠引物由北京擎科生物有限公司合成;miR-192及U6的引物由广州锐博生物合成;Western blot 相关抗体购自Abcam。
2 主要方法
2.1急性肝衰竭小鼠模型的建立 将小鼠随机分为对照(0 h)组及3个不同处理时间的模型(1 h、3 h和6 h)组,共4组,每组 6只。模型组给予D-GalN(每只20 mg)和 LPS(每只0.5 mg)混合后腹腔注射,对照组注射同等剂量的生理盐水。具体过程如下:对照组和6 h组分别给予生理盐水和药物腹腔注射,对于3 h和1 h组小鼠,分别间隔3 h和5 h后注射药物;最后同时摘掉此24只小鼠眼球取血并颈椎脱臼处死,解剖小鼠、取出肝脏。取部分肝组织固定于4%多聚甲醛溶液中,用于石蜡包埋及HE 染色;剩余部分冻存在-80 ℃冰箱中,用于组织mRNA和蛋白的提取。本实验已通过本院动物伦理委员会批准。
2.2小鼠血浆丙氨酸氨基转移酶(alanine amino-transferase,ALT)和天门冬氨酸氨基转移酶(aspartate aminotransferase,AST)水平的检测 各组小鼠经乙醚麻醉后摘取眼球采集外周血,离心后收集血清送本院检验科检测生化指标。
2.3肝组织病理学观察 肝脏用4%多聚甲醛固定并石蜡包埋、切片,然后行HE染色,显微镜下观察肝组织病理变化。
2.4小鼠肝组织miR-192、p53 mRNA和p21 mRNA水平的检测 (1) RNA提取:取肝组织约50 mg加入TRIzol 1 mL, 剪碎并用超声裂解仪充分裂解后,加入氯仿 0.2 mL,剧烈振荡15 s后静置5 min,4 ℃、12 000×g离心 15 min。取上层液,转移至另一新的离心管中,加入等体积异丙醇,上下颠倒充分混匀后,室温静置10 min,4 ℃、12 000×g离心10 min;小心弃去上清, 加入75%乙醇 1 mL,上下颠倒、洗涤管壁,4 ℃、7 500×g离心 5 min 后,弃去上清;打开离心管盖,室温干燥沉淀。待沉淀干燥后,加入适量的无酶水溶解沉淀。置于-80 ℃冰箱冻存。(2)RNA反转录成cDNA:按 PrimeScriptTMRT Master Mix试剂盒说明书配制RT 反应液,反应液体系为 20 μL, 轻柔混匀后进行反转录反应,条件:37℃,15 min;85 ℃,5 s。(3)实时荧光定量PCR:PCR的反应体系为 10 μL, 其中上、下游引物各0.5 μL,cDNA 3 μL,DEPC 水 1 μL,SYBR Green 5 μL。PCR 仪型号为StepOne Plus Real-Time PCR System。GAPDH的上游引物序列为5’-AGGTCGGTGTGAACGGATTTG-3’,下游引物序列为5’-GGGGTCGTTGATGGCAACA-3’;p53的上游引物序列为5’-CCCCTGTCATCTTTTGTCCCT-3’,下游引物序列为5’-AGCTGGCAGAATAGCTTATTGAG-3’;p21的上游引物序列为5’-CCTGGTGATGTCCGACCTG-3’,下游引物序列为5’-CCATGAGCGCATCGCAATC-3’; miR-192的上游引物序列为5’-ACTCTGGCCCCCTATTGTCT-3’,下游引物序列为5’-CACCCTTGTGTCCTTTGGTT-3’;U6的上游引物序列为5’-CTCGCTTCGGCAGCACA-3’,下游引物序列为5’-AACGCTTCACGAATTTGCGT-3’。PCR扩增程序:热激活,95 ℃ 30 s;变性,95 ℃ 5 s,退火及延伸60 ℃ 30 s,共40个循环。miR-192及U6的引物由广州锐博生物提供,miRNA的反转录及PCR操作均按照试剂盒说明书进行。
2.5Western blot检测蛋白表达 用RIPA提取组织总蛋白,并用 BCA 法测定蛋白浓度, 绘制标准曲线后,按每孔30 μg计算上样量。浓缩胶以恒压80 V电泳,待蛋白预染标记物完全分开后,120 V继续电泳分离胶; 充分分离后,恒流250 mA电转至PVDF膜上;膜在室温下用 5%的脱脂牛奶在摇床上封闭1 h,再孵育I抗(GAPDH、p53和p21抗体均以 1 ∶1 000比例稀释),置于4 ℃过夜; 次日将膜放入 TBST中洗3遍,每次5 min,然后室温孵育II抗(1 ∶3 000)1 h,之后再将膜用 TBST 洗 3 次;最后曝光显影。
3 统计学处理
采用SPSS 15.0统计软件进行统计分析。计量资料以均数±标准差(mean±SD)表示,组间比较采用双侧t检验,以P<0.05为差异具有统计学意义。GraphPad prism 5.0作统计绘图。
结 果
1 小鼠肝脏组织病理变化的观察
模型组在给药1 h后,肝组织示轻度炎症反应;3 h后炎症明显加重,可见大量炎性细胞浸润,部分肝细胞坏死;6 h后肝小叶结构消失,大量肝细胞坏死,见图1。
Figure 1. The pathological changes of liver tissues in the mice at different time points after injection (HE staining, ×200).
图1 各组小鼠肝组织的病理学变化
2 小鼠血浆 ALT 和 AST 水平的变化
模型组小鼠在给药1 h后,ALT和AST无明显变化;3 h后其血浆中水平出现明显增加; 6 h后,血浆ALT和AST水平进一步增加(P<0.01),见图2。从以上肝组织学检查和血浆 ALT 和 AST 水平变化证实造模成功。
3 肝组织miR-192相对表达水平的变化
RT-qPCR检测肝组织miR-192的表达,在反应体系中miR-192都能有效扩增。小鼠肝组织miR-192在给药1 h后表达明显增加,随后的3 h和6 h出现了进行性下调。对比ALT和AST水平发现,miR-192在反映肝细胞损伤方面更加敏感,见图3。
4 肝损伤小鼠肝组织中p53和p21的mRNA及蛋白表达
在给药1 h后,作为应激蛋白p53的mRNA表达出现反应性升高,在3 h及6 h后又出现了下降;p21的mRNA表达出现更为明显的改变,见图4A。如图4B所示,p53蛋白在给药1 h后较对照组明显增高,结合mRNA的结果(p53的mRNA升高不明显)推测这种情况主要是应激后p53蛋白的降解减少造成的,在此之后p53蛋白量再次降低;p21作为调控细胞周期的关键蛋白,给药1 h后,p21蛋白无明显改变,然而随后出现了上升,这与mRNA的结果并不一致,可能是由于存在转录后的调控。
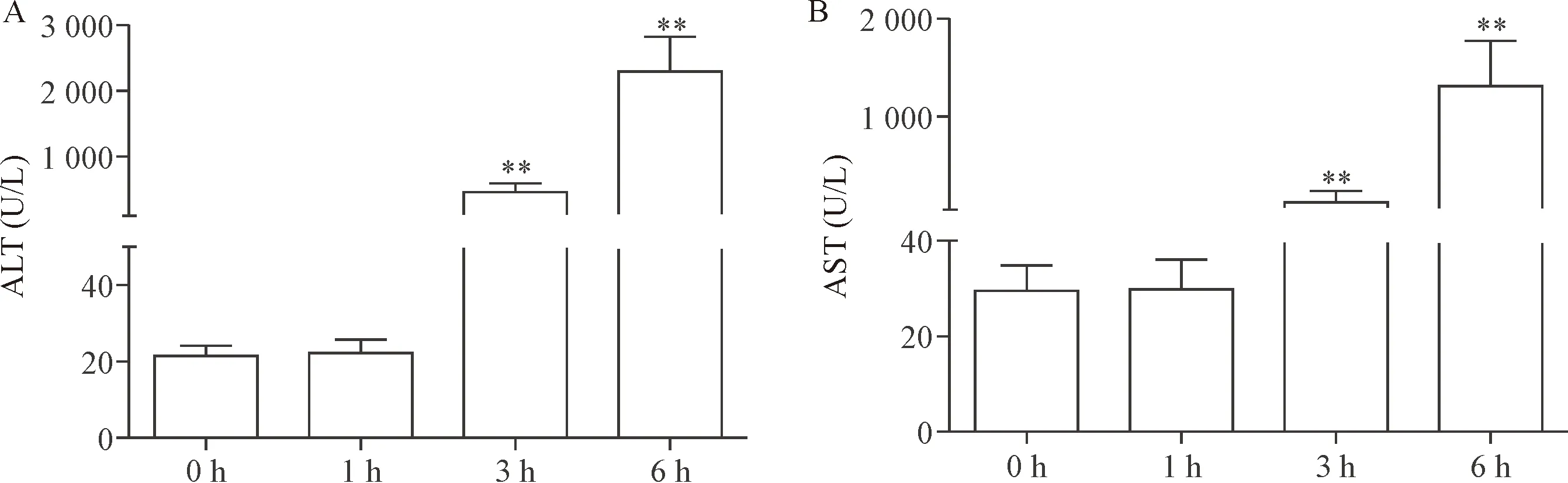
Figure 2. The change of plasma ALT (A) and AST (B) levels of the mice at different time points. Mean±SD.n=6.**P<0.01vs0 h group.
图2 不同时点各组小鼠血浆ALT和AST的变化
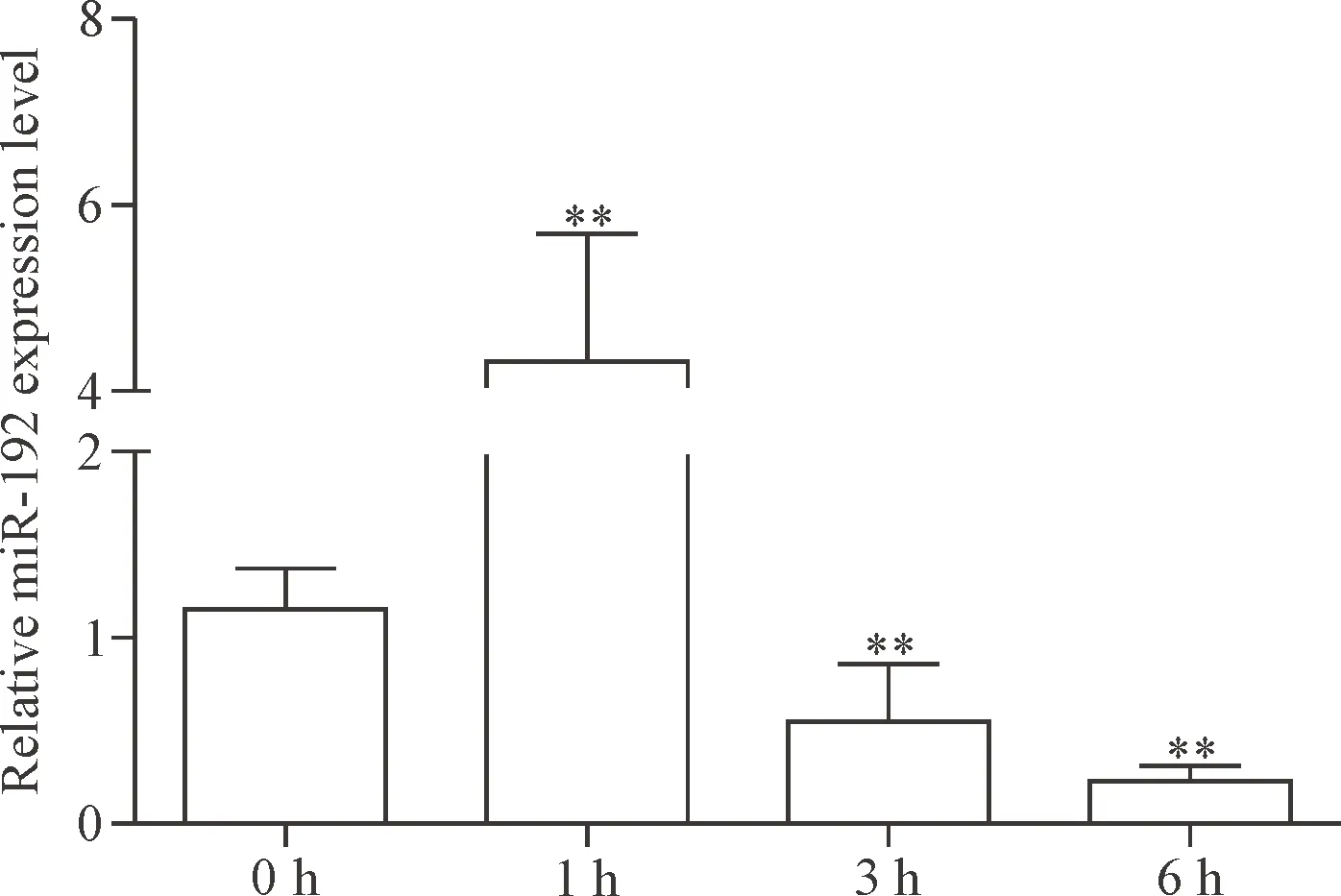
Figure 3. The expression of miR-192 in the mouse liver tissues at different time points. Mean±SD.n=6.**P<0.01vs0 h group.
图3 各组小鼠肝组织miR-192相对表达量的变化
讨 论
肝脏是人体最大的解毒器官, 有毒物质(包括药物)绝大部分在肝脏被处理后变得无毒或低毒,因此肝脏也极易受到外界因素的入侵, 导致肝脏损伤;然而目前对于肝细胞损伤程度的判断尚缺乏较为敏感、特异的指标。ALT和AST作为当前评估肝细胞功能的常用指标,由于其自身的缺点,其变化并不能完全反映肝细胞损伤的程度。近年来,随着对miRNA生物学功能研究的开展,学者们发现miRNA参与正常的生理活动如细胞的增殖和分化等,其表达失调还与肿瘤等疾病的发生、发展密切相关。此外,由于miRNA是具有20个碱基左右的单链RNA,这使得其在血液及其它体液中比较稳定,不易被降解,因此它还可作为预测肝癌、结肠癌和心肌梗死等疾病的新的生物学标志物[7-8]。miR-122与miR-192均在肝组织中丰度高,已有许多研究结果显示miR-122的表达变化与众多肝脏疾病密切相关,如病毒性肝炎、肝细胞癌和酒精性肝炎等,并发现miR-122的变化可反映药物性肝损伤的程度,可作为判断药物性肝损伤的生物学标志物[9-11],相较而言,miR-192在这些方面的研究尚少;再者,miR-192的特殊性在于其受抑癌基因p53转录调控,细胞受损伤时p53蛋白将反应性升高,miR-192也会有相应的改变,那么miR-192只是单纯增高并不发挥某些功能吗?在急性肾损伤时已有研究发现肾组织p53蛋白表达增加并可能参与介导细胞凋亡[12],而在急性肝损伤时p53及miR-192的表达和作用仍不明确。
我们用D-GalN和 LPS建立急性肝损伤模型,观察在不同时点下肝脏损伤情况以及对应肝组织miR-192的表达情况,初步探讨了肝组织中miR-192和肝损伤之间的关系。由于所采集的小鼠血样只够用于ALT和AST的生化检测,本实验并未检测血清中miR-192的变化,但仍然能够为以后研究肝损伤血清中miR-192的变化奠定一定的基础。我们的研究结果显示,在肝损伤过程中伴随着miR-192表达水平的变化。正常小鼠肝脏内miR-192含量丰富,D-GalN/LPS给药1 h后miR-192即出现了明显的表达上调,可能为药物刺激后的一个反应性变化,这与p53蛋白的变化一致;之后其表达进行性下调,推测可能为miR-192由受损肝细胞释放到外周血中;而ALT和AST于给药1 h后无明显变化,说明ALT和AST的变化并不能及时反映肝细胞损伤。有学者发现p53的表达增加对受损细胞还能起到保护作用,当细胞损伤出现时,p53会激活下游基因p21的转录从而使细胞周期出现停滞,以便于损伤修复;一旦损伤不可修复时便会通过对凋亡相关基因的转录调控促进细胞凋亡。这种保护作用可能是通过p53转录调控下游mRNA来实现的,结合本实验结果,推测p53转录激活的miR-192和其它miRNA可能参与其中。亦有学者发现在氧化应激引起的肝损伤中,miR-192下调能够起到肝脏保护作用[13]。然而p53在细胞受到氧化应激时表达升高,同时受p53转录激活的miR-192的表达也会相应上调,究竟miR-192扮演何种角色有待进一步研究确认。
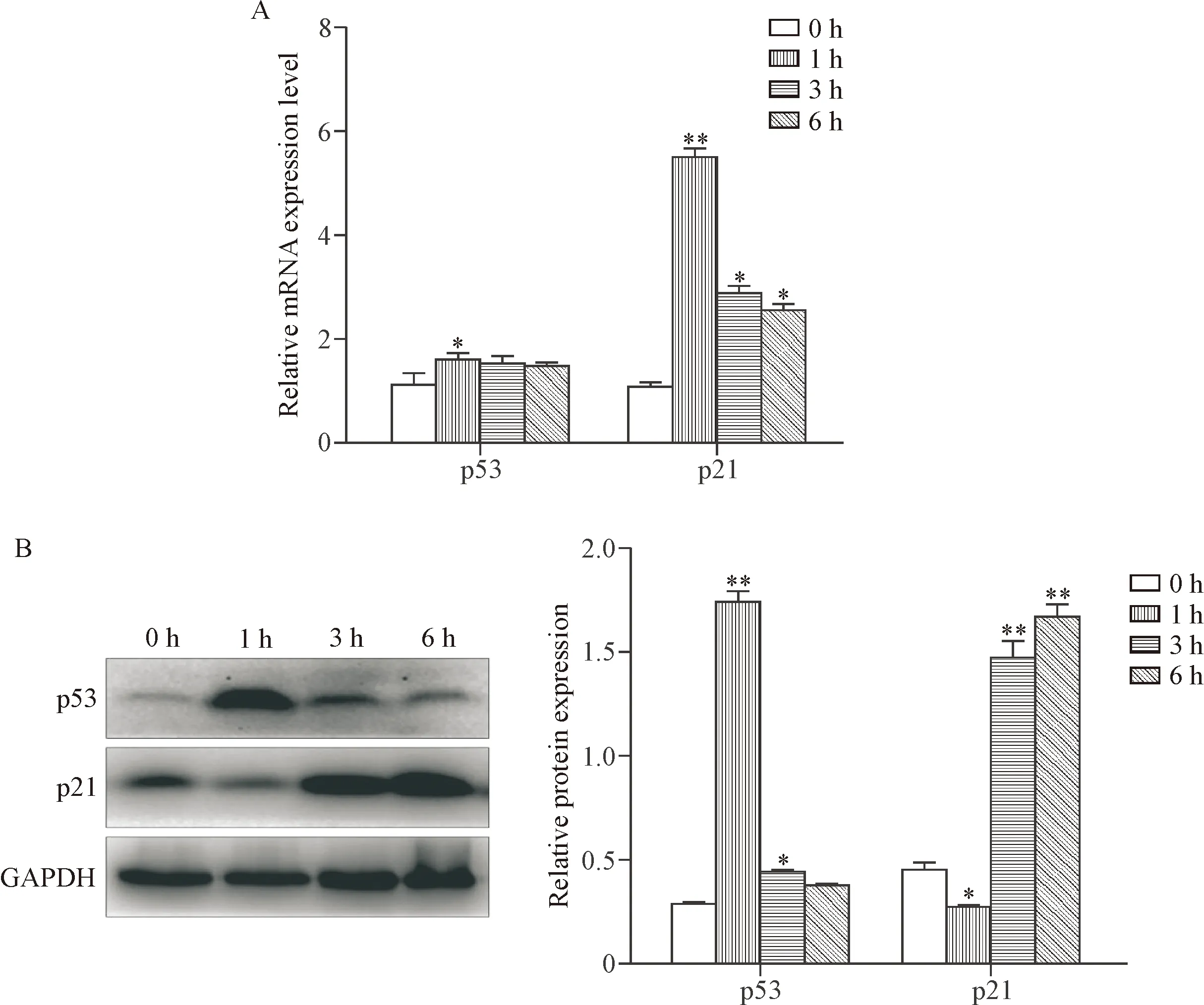
Figure 4. The expression of p53 and p21 at mRNA (A) and protein (B) levels. Mean±SD.n= 6.*P<0.05,**P<0.01vs0 h group.
图4 各组小鼠肝组织p53及p21的mRNA和蛋白的表达
综上所述,miR-192的表达水平不仅可以作为肝损伤的标志物,随着相关研究的深入,越来越多的miR-192下游靶基因将会被发现,miR-192在肝脏损伤时“主动”发挥的功能会得到更多的验证。

