多花黄精多糖对STZ 诱导的Ⅰ型糖尿病小鼠影响作用研究*
王秋丽,童小慧,李小东,韩荣春,彭代银,俞年军△
(1. 安徽中医药大学 安徽省中医药科学院 中药资源保护与开发研究所,安徽 合肥231200;2. 安徽中医药大学中西医结合学院,安徽 合肥230012)
糖尿病是一种以高血糖为特征的代谢紊乱性疾病,在发展过程中易累及多脏器,比如肝脏脂质的堆积、炎细胞浸润等[1]。多花黄精Polygonatum cyrtonema Hua 属百合科黄精属植物,与滇黄精Polygonatum kingianum Coll.et Hemsl.、黄精Polygonatum sibiricum Red.一同收录于《中国药典》(2015 年版一部)。黄精系药食同源的多年生草本植物,是我国传统大宗药材[2],具有补气养阴、健脾、润肺、益肾之效[3]。现代研究表明,黄精主要成分多糖具有降血糖、血脂[4-6],抗肿瘤[7-9],抑菌[10],抗炎[11],抗病毒[12],增强免疫[13]等作用。目前,多花黄精多糖的降血糖研究鲜有报道。
STZ 是目前最广泛的用来诱导I 型糖尿病动物模型的化学物质,通过葡萄糖转运体2(glucose transporter 2,GLUT2)产生毒性作用,破坏胰岛β 细胞,导致胰岛素分泌绝对不足[14]。因此,本实验拟运用STZ 诱导高血糖,探讨多花黄精多糖对糖尿病小鼠血糖及肝脏等影响以及相关作用机制。
1 材料和仪器
1.1 材料 多花黄精药材由安徽省青阳县九华中药材科技有限公司提供,经安徽中医药大学药学院俞年军教授鉴定为多花黄精。链脲佐菌素(美国Sigma,批号:S0130-500);血糖试纸(美国强生,批号:4489872);伊红染液(索莱宝,批号:G1100);苏木素染色液(博士德生物,批号:AR1180-1);Trizol 试剂盒(Invitorgen,USA,批 号:135404);FastQuant RT kit(天根,批号:KR151125)。6 周龄SPF 级雌性C57 BL/6 小鼠(18.0±1.0 g),购自安徽医科大学动物实验中心,动物生产许可证编号:SCXK(皖)2016-001。小鼠适应性饲养1 周。饲养条件为:温度(25±1)℃,12 h光照/12 h 黑暗,于早晨7:00 开灯。常规饲料饲养,自由饮食。
1.2 仪器 稳豪血糖仪(UltraEasy);真空冷冻干燥机(北京松源华兴科技发展有限公司);旋转蒸发仪(日本EYELA);体重秤(上海光正医疗仪器有限公司);倒置显微镜DMIL LED(德国莱卡);超微量核酸蛋白测定仪(德国耶那分析仪器股份公司);荧光定量PCR 仪(上海罗氏诊断产品有限公司)。
2 方法
2.1 多糖的制备 取干燥的多花黄精适量,经研磨粉碎过筛后,加入10 倍量的95%乙醇溶液回流提取1 h,抽滤收集滤渣,干燥。然后将多花黄精滤渣与8倍量水混合均匀,回流提取2 次,回流提取1 h,抽滤并收集滤液,所得滤液在60 ℃条件下减压浓缩至一定体积,缓慢滴加无水乙醇同时不断揽拌,至乙醇的终浓度为80%,放入4 ℃冰箱中过夜。次日进行抽滤,滤饼放置于真空冷冻干燥机冷冻干燥,所得粉末即为多花黄精粗多糖[15]。
2.2 分组及给药 90 只雌性C57BL/6c 小鼠分两组:正常对照组(n=6)及模型组(n=84)。
模型组小鼠隔夜禁食后,腹腔注射新鲜制备的冷STZ 溶液(溶解于柠檬酸缓冲液中,pH 4.2)。STZ注射剂量为70 mg·kg-1/d,连续5d,监测小鼠血糖变化。于首次注射STZ 1 周后,开始分组给药。从模型组小鼠中选出72 只血糖水平相近、体重相近的小鼠依次分为:模型组(n=24)、多花黄精多糖低剂量(450 mg·kg-1,n=24)和多花黄精高剂量组(900 mg·kg-1,n=24)。各组小鼠分别灌胃给予相应药物,空白对照组以及模型组给予等量生理盐水。
2.3 记录小鼠死亡率 于首次给药后,记录小鼠状态以及死亡情况。
2.4 记录小鼠体重以及测定血糖水平 给药期间监测小鼠体重变化。以首次分组给药第1 天为D1,于给药10 d 后采用血糖试纸,尾尖取血测定各组小鼠随机血糖水平。
2.5 肝脏组织学观察 于给药10 d 后,颈椎脱臼处死各组小鼠。肝脏组织样本迅速浸泡在10%的福尔马林溶液中固定24 h,脱水、石蜡包埋,切成6 μm 厚的薄片,经苏木精-伊红(hematoxylin-eosin,HE)染色后进行组织形态学分析。肝脏病变的程度由专业技术人员进行双盲评分,评分范围为0~3。
2.6 qPCR 检测肝脏IL-6、IL-1β、IRS-1 mRNA 水平如2.5 项下处死动物,取肝脏液氮速冻,-80 ℃保存。采用TRIzol 提取总RNA,500ng RNA 反转录合成cDNA,采用qPCR 检测肝脏中IL-6、IL-1β、IRS-1 mRNA 水平。反应条件为95 ℃10 min,95 ℃10 s,60 ℃10 s,72 ℃10 s,45 次循环。以GAPDH Ct 值校正,采用2-△△CT法计算IL-6、IL-1β、IRS-1 mRNA相对表达水平。引物序列见表1。
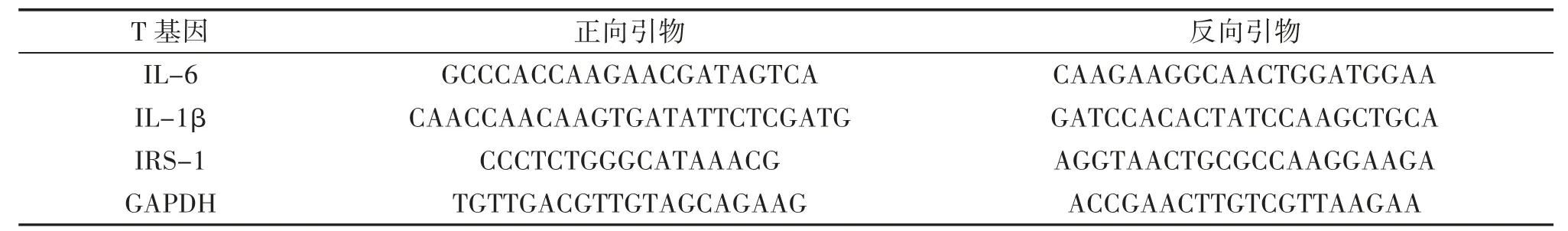
表1 qPCR 所需引物序列
2.7 统计学方法 所有实验结果以均值±标准差表示,采用数据分析软件Graph Pad Prism 6 采用t 检验,生存率曲线显著性采用Log-rank(Mantel-Cox)检测。P<0.05 表示差异具有统计学意义。
3 结果
3.1 STZ 诱导T1DM 模型 采用STZ 诱导T1DM 模型。每只小鼠连续5 d 腹腔注射STZ(70 mg·kg-1),并检测小鼠血糖变化。于首次给予STZ 后检测血糖,其值变化明显。如图1 所示,与正常对照组相比,模型组小鼠的血糖于首次STZ 注射第5 天后开始显著升高(20.08±3.397 vs.7.25±0.728 mmol·L-1)。并且持续升高至首次STZ 注射第7 天。观察小鼠发现,正常对照组小鼠饮食、饮水正常,体毛光泽,体重增加明显。而STZ 注射小鼠出现消瘦、体表皮毛无光泽以及活动减少等现象,同时饲养笼垫料脏湿加速。以上变化符合糖尿病病症中的“三多一少”(多饮、多食、多尿及体重减少)的特征[16]。
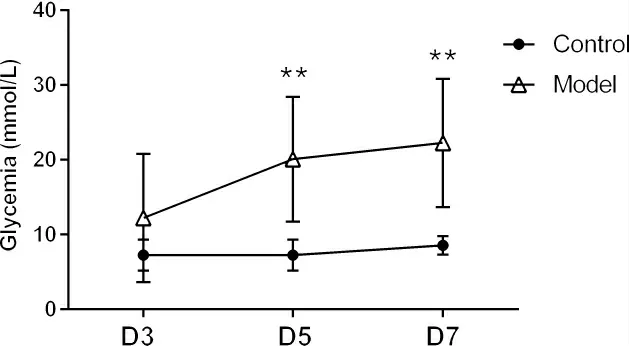
图1 连续给予5 次STZ(70 mg·kg-1)对小鼠随机血糖的影响
因此,本实验采用连续5d 腹腔注射STZ(70 mg·kg-1)并于1 周后进行多花黄精多糖干预的实验方案。
3.2 多花黄精多糖提高T1DM 模型小鼠的存活率实验中发现,正常组小鼠在实验期间内的存活率为100%.与正常对照组相比,模型组小鼠死亡率明显增加,多数动物出现后肢红肿、断足等症状。于正式实验的10 d 内存活率仅为16.67%(4/24)。而与模型组相比,多花黄精多糖高剂量组(900 mg·kg-1)小鼠的死亡率处于较低水平,于实验10d 后存活率为66.67%(16/24)。并且,动物未出现后肢红肿、断足等异常情况。多花黄精多糖低剂量组(450 mg·kg-1)小鼠的存活率与模型组相比无显著性差异25%(6/24)。结果如图2 所示。
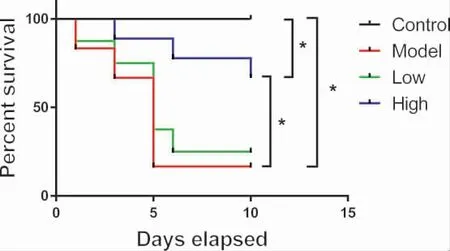
图2 多花黄精多糖对T1MD 小鼠存活率的影响
因此,该结果提示多花黄精多糖高剂量显著降低T1DM 模型小鼠的急性死亡率。
3.3 多花黄精多糖对T1DM 模型小鼠体重的影响本实验同时测定多花黄精多糖对小鼠体重的影响,结果如图3 所示。与正常对照组相比,模型组小鼠体重下降约40%(19.6±0.945 vs.31.9±1.862 g)。多花黄精多糖低剂量组(450 mg·kg-1)小鼠的体重相比模型组小鼠显著增加(23.3±1.358 vs.18.9±0.945 g)。并且,与低剂量组相比,多花黄精高剂量组(900 mg·kg-1)有增加小鼠体重的趋势,但数据检测无显著性差异(24.7±0.928 vs.23.3±1.358 g)。
以上实验结果提示,尽管不能完全逆转T1DM 小鼠体重的下降,多花黄精多糖低剂量及高剂量均有显著增加糖尿病小鼠体重的作用。
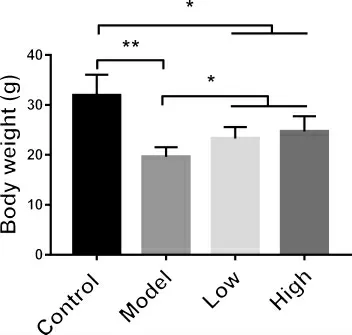
图3 多花黄精多糖对T1MD 小鼠体重的影响
3.4 多花黄精多糖对T1DM 模型小鼠随机血糖的影响 根据实验观测到的多花黄精多糖显著增加高血糖小鼠的存活率以及逆转其体重下降,本研究同时对各组小鼠随机血糖进行检测,探究多花黄精多糖以上的作用是否与影响小鼠血糖水平相关。于实验结束处死小鼠前测定血糖水平,结果如图4 所示。与正常对照组相比,模型组小鼠血糖显著升高(8.08±0.3597 vs.30.7±1.664 mmol·L-1)。多花黄精高剂量组(900 mg·kg-1)小鼠与模型组小鼠相比,血糖水平下降有显著性差异。而低剂量多花黄精多糖对模型小鼠的血糖水平影响较弱。
以上实验结果提示,多花黄精多糖高剂量(900 mg·kg-1)具有一定程度的降低T1DM 小鼠随机血糖水平的作用。
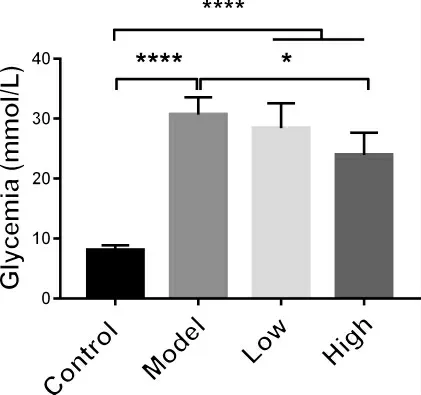
图4 多花黄精多糖对T1MD 小鼠随机血糖的影响
3.5 多花黄精多糖改善T1DM 模型小鼠肝损伤 实验采用HE 染色法检测多花黄精多糖是否通过影响小鼠肝脏状态从而改善T1DM 小鼠的生存率。结果如图5 所示,正常对照组小鼠肝细胞以索状顺序排列,环绕中央静脉成放射状。细胞核位于细胞质中央(如图5A 中宽箭头所示),肝细胞之间由肝窦连接,肝窦清晰(如图-5A 中细箭头所示)。与正常对照组小鼠相比,模型组小鼠肝脏实质局部出现大量单核样炎症细胞的浸润(如图5B 中方框所示),肝细胞变性明显:大量的肝细胞出现浓的嗜酸性细胞质和固缩的细胞核(如图5B 中宽箭头所示),并且肝细胞排列杂乱、肝窦分辨不清,提示肝脏出现硬化。低剂量多花黄精多糖组小鼠肝脏的仍然存在一定程度的病变:炎症细胞浸润明显、一部分的肝细胞变性以及肝脏细胞排列结构紊乱(如图5C 所示)。而高剂量多花黄精多糖显著改善模型小鼠肝脏的病变:炎症细胞浸润相对减少、肝细胞变性明显得到改善以及肝细胞排列整齐等(如图5D 所示)。
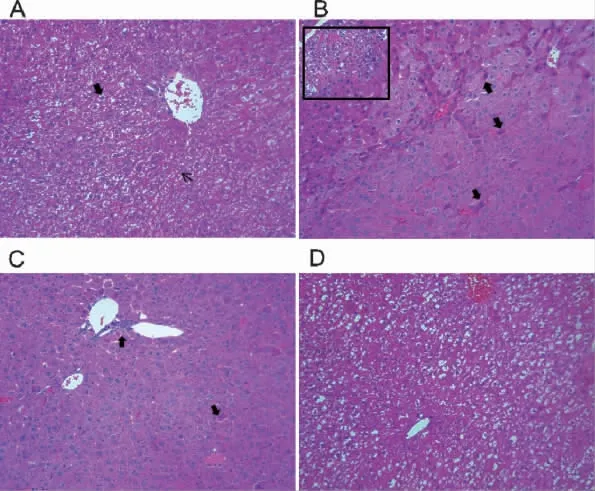
图5 多花黄精多糖对T1MD 小鼠肝脏病理形态改变的影响(HE,×200)

表2 多花黄精多糖对模型小鼠肝脏病理形态影响的双盲评分
各组小鼠HE 染色切片随机选取10 个不同部位拍摄,并对各组小鼠肝脏病变进行双盲定性评分。评分结果如表2 所示,结果提示黄精多糖高剂量可以显著改善模型小鼠肝脏炎症细胞清润以及肝细胞变性等病理改变。
3.6 多花黄精多糖对T1DM 模型小鼠肝脏IL-6、IL-1β、IRS-1 mRNA 水平 实验继续采用qPCR 对小鼠肝脏炎症因子IL-6 和IL-1β 的基因表达水平进行检测。结果如图6A、6B:与正常组相比,模型小鼠肝脏IL-6、IL-1β 表达水平显著升高,与肝脏组织病变结果(图5)相吻合。多花黄精高、低剂量均能显著降低TD1M 小鼠肝脏IL-6、IL-1β 的过表达。由于炎症是导致肝脏胰岛素抵抗的重要原因,我们检测了胰岛素通路中胰岛素底物1(IRS-1)的表达水平。结果如图6C:高血糖显著降低小鼠肝脏中IRS-1 mRNA 水平,提示胰岛素通路受损。而多花黄精剂量依赖性的升高TIDM 小鼠肝脏中的下降的IRS-1 的基因表达。
以上数据表明,多花黄精多糖能够改善糖尿病肝脏的炎症和胰岛素敏感性。
4 讨论
目前全世界有超过3 亿人罹患糖尿病,具有流行病学趋势[17]。糖尿病主要包括Ⅰ型糖尿病以及Ⅱ型糖尿病。T1DM 是一种自身免疫性疾病,由于胰腺胰岛β 细胞遭受机体异常免疫的攻击,导致胰岛素分泌障碍及血糖水平上升[18]。
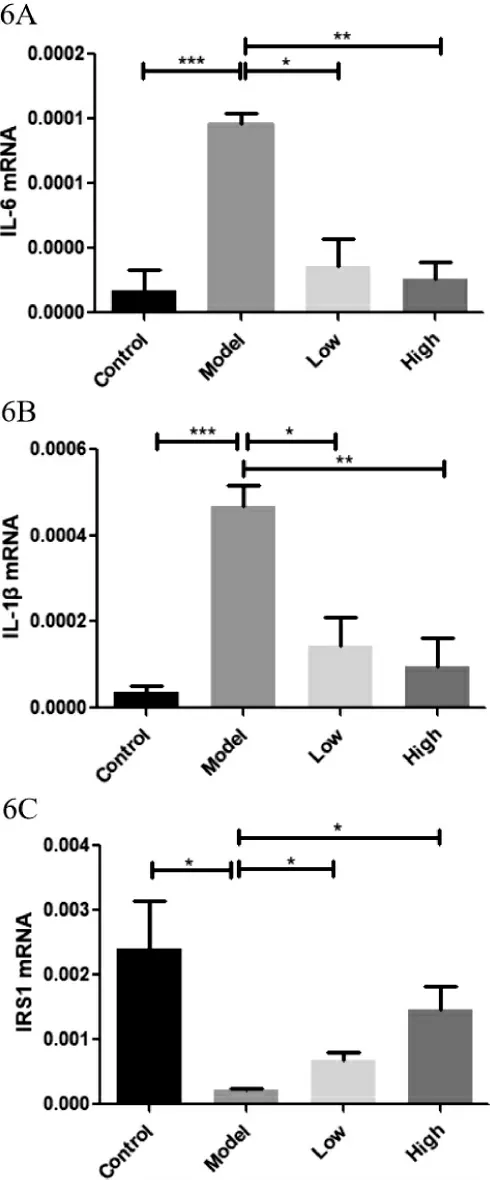
图6 多花黄精多糖对各组小鼠肝脏IL-6、IL-1β、IRS-1基因水平的影响
由于胰岛素对葡萄糖、脂质等营养物质的合成效应,胰岛素的缺乏将引起机体一系列的代谢异常,比如肝脏中失控的糖原分解、糖异生、酮体生成以及脂肪组织中甘油三酯的分解。这些变化将导致机体处于持续的能量分解状态,最终引起体重下降[19],并最终引起死亡率升高。本实验结果中多花黄精高剂量(900 mg·kg-1)显著降低T1DM 模型小鼠的急性死亡率,提示多花黄精多糖具有积极干预T1DM 发展的作用。
STZ 诱导模型能够通过减少胰岛素释放,导致动物体重下降。例如,Viviane El-Helou 等报道,9~11 周龄的雄性SD 大鼠单次腹腔注射STZ(60 mg·kg-1),3周后大鼠的体重下降约34%,同时血糖上升至28 mmol·L-1左右[20]。此外,Sisse A Nørgaard 等报道:6-8周龄的雄性129S2/SvPastCrl 鼠,两次腹腔注射STZ(100 mg·kg-1/次,间隔3 d),3 周后体重小鼠体重下降约10%[21]。
而相比雄性小鼠,15 周龄雌性C57BL/6 小鼠经STZ 诱导高血糖后,体重下降更加明显[22]。另外,临床数据提示糖尿病女性患者较男性患者,某些并发症的发病率显著偏高[23]。Harmesh N.Chaudhari 等报道,雌性SD 大鼠较雌性大鼠更容易受高血糖影响。11 周龄SD 大鼠腹腔注射STZ(50 mg·kg-1),两周后雌性大鼠胰岛素水平显著低于雄性大鼠。另外,雌性小鼠肝脏中抗氧化蛋白DJ1 显著降低[24]。
推测雌性动物更容易受到胰岛素缺乏的影响。本实验中在首次注射STZ(70 mg·kg-1)第10 天,小鼠的体重下降约40%与文献报道基本相符合。而450~900 mg·kg-1的多花黄精多糖能够显著降低T1DM 模型小鼠的体重下降,900 mg·kg-1的多花黄精多糖显著抑制T1DM 模型小鼠的随机血糖水平。提示多花黄精多糖可能具有保护胰岛β 细胞免受STZ 诱导的凋亡,或者能够通过改善T1DM 小鼠代谢紊乱的作用。因此,本实验采用HE 染色法探究多花黄精多糖对机体中代谢重要器官肝脏的影响。
高血糖会导致脏器损伤,比如肝脏[25]。非酒精性脂肪肝包括硬化和非酒精性硬化性肝炎是糖尿病肝脏主要的病变,并且是肝脏损伤的主要原因[26]。据报道:STZ 诱导的T1DM 大鼠,肝脏超微结构显著改变。出现细胞核固缩,染色质缩合,线粒体肿大,粗内质网膨胀等病变[27]。本实验HE 染色结果STZ 诱导的高血糖导致小鼠肝脏出现明显病变如肝细胞变性、坏死,肝细胞结构紊乱等,与文献报道相符。并且,肝脏实质中出现大量的炎细胞浸润。
肝脏在机体固有免疫反应中具有重要作用,肝脏细胞中包含多种免疫细胞,包括单核细胞,巨噬细胞,淋巴细胞,自然杀伤细胞以及肝星状细胞等[28-29]。高血糖能够通过促进骨髓中髓系祖细胞的增殖和分化从而升高循环系统中单核细胞以及嗜中性粒细胞的数量[30]。Yong-Sun Lee 等研究证明:STZ 诱导的高血糖通过促进肝脏Treg 细胞迁移,显著增加小鼠肝脏中单核细胞核嗜中性粒细胞的数量。并且促进单核细胞前炎症因子如:TNF-α,IL-1β,TFN-γ 及IL-6 等的表达[31]。因此,本实验采用qPCR 检测多花黄精多糖对其肝脏炎症因子IL-1β 和IL-6 mRNA 的表达,结果显示,450~900 mg·kg-1的多花黄精多糖能够显著降低其 基因的表达。此外,多花黄精多糖能够显著上调糖尿病肝脏中IRS-1 的基因水平。
综上所述,本研究表明,多花黄精多糖显著改善STZ 诱导的雌性T1DM 小鼠的存活率。可能与其有效抑制T1DM 过程中小鼠体重下降,并且抑制肝脏炎症细胞浸润、抑制炎症因子的表达及提高胰岛素受体底物的表达,从而改善肝脏免疫反应的作用相关。为进一步研究多花黄精多糖治疗血糖代谢紊乱等疾病提供初步的实验依据。

