艾纳香中的黄酮类化合物及其抗菌活性
王鸿发 元超 庞玉新
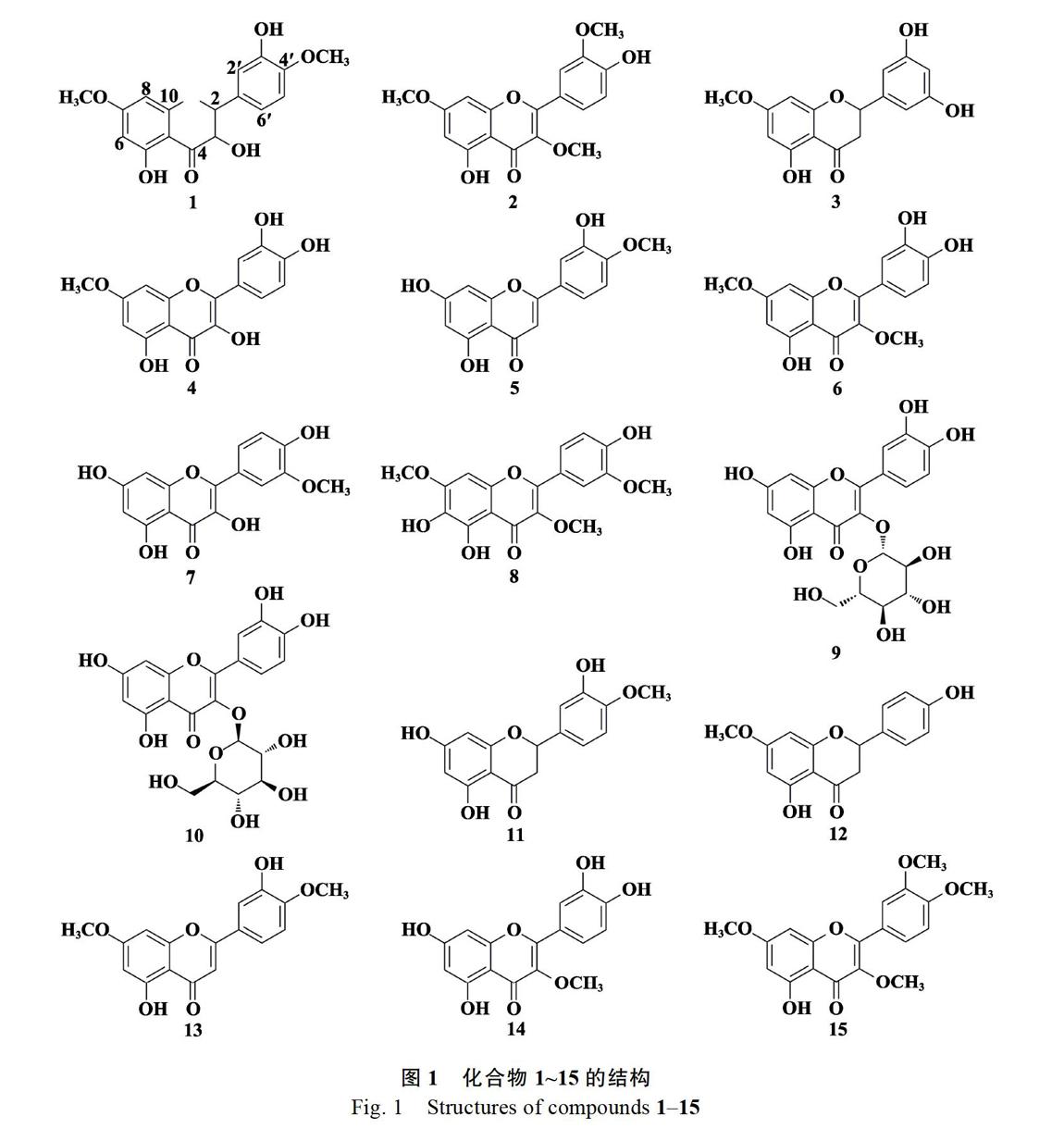
摘 要 為明确艾纳香抗菌药效物质基础,采用硅胶柱色谱, 凝胶色谱和反相色谱等技术从艾纳香乙酸乙酯部位中分离获得15个单体化合物,经波谱学鉴定分别为:3,3?,5-三羟基-4?,7-二甲氧基二氢黄酮 (1)、4?,5-二羟基-3,3?,7-三甲氧基黄酮 (2)、艾纳香素 (3)、3,5,3?,4?-四羟基-7-甲氧基黄酮 (4)、香叶木素 (5)、3?,4?,5-三羟基-3,7-二甲氧基黄酮 (6)、异鼠李素 (7)、chrysosplenol C (8)、金丝桃苷 (9)、异槲皮苷 (10)、3?,5,7-三羟基-4?-甲氧基二氢黄酮 (11)、sakuranetin (12)、pilloin (13)、5,7,3?,4?-四羟基-3-甲氧基黄酮 (14)、5-羟基-3,7,3?,4?-四甲氧基黄酮 (15),其中化合物7、11、12和13为首次从该植物中分得。抗菌活性评价结果显示:化合物1、3、6、8和12对3株细菌具有不同程度的抑制活性,其中化合物3对金黄色葡萄球菌抑制活性最强, 最低抑菌浓度MIC值为32 ?g/mL。
关键词 艾纳香;化学成分;黄酮;抗菌活性中图分类号 R284; S567 文献标识码 A
Antibacterial Activity of Flavonoids from Blumea balsamifera
WANG Hongfa1, YUAN Chao2,3*, PANG Yuxin2,3*
1. College of Agronomy, Heilongjiang Bayi Agricultural University, Daqing, Heilongjiang 163319, China; 2. Tropical Crops Genetic Resources Institute, Chinese Academy of Tropical Agricultural Sciences, Danzhou, Hainan 571737, China; 3. Hainan Engineering Research Center forBlumea balsamifera(L.) DC, Danzhou, Hainan 571737, China
Abstract To investigate the pharmacodynamic substance basis ofBlumea balsamifera (L.) DC., fifteen compounds were isolated from the EtOAc fraction by silica gel, sephadex LH-20 and ODS-A column chromatography. The structures were determined based on the analysis of the spectroscopic data as 3,3?,5-trihydroxy-4?,7-dimethoxy flavanone (1), 4?,5-dihydroxy-3,3?,7-trimethoxy flavone (2), blumeatin (3), 3,5,3?,4?-tethydroxy-7-methoxy flavone (4), diosmetin (5), 3?,4?,5-trihydroxyl-3,7-dimethoxy flavone (6), isosamicin (7), chrysosplenol C (8), hyperoside (9), isoquercitrin (10), 3?,5,7-trihydroxy-4?-methoxy flavanone (11), sakuranetin (12), pilloin (13), 5,7,3?,4?-tetrahydroxy-3-methoxyflavone (14) and 5-hydroxy-3,7,3?,4?-tetramethoxy flavone (15). Compounds7,11,12and13are isolated from the plant for the first time. Antibacterial test indicated that1,3,6,8 and12displayed different inhibition against three bacteria, and3significantly inhibitedStaphylococcus aureussubsp.aureus(DSM 799) with a MIC value of 32 ?g/mL.
Keywords Blumea balsamifera (L.) DC.; chemical constituents; flavonoids; antibacterial activities
DOI10.3969/j.issn.1000-2561.2019.09.020
艾纳香Blumea balsamifera (L.) DC.属于菊科艾纳香属植物, 别名大风艾、牛耳艾、冰片艾等,主要分布于我国云南、贵州、广西、广东和海南等地 [1]。艾纳香最早记载于公元741年陈藏器编著的《本草拾遗》,其性微温,味辛、微苦,具有祛风除湿、温中、杀虫等功效,可用于跌打损伤、疮疖痈肿、皮肤瘙痒等症的治疗[2]。艾纳香作为传统黎药在海南黎族百姓中通常用于妇女产后沐浴,以减少妇科疾病的发生[3]。现代药理学研究亦显示,艾纳香提取物具有非常好的抑菌效果,如邹婧等[4]报道艾纳香提取物可抑制白色念珠菌、金黄色葡萄球菌和大肠埃希菌等口腔细菌;张颖等[5]研究显示艾纳香挥发油对大肠杆菌和金黄色葡萄球菌均有抑制作用;闻庆等[6]报道艾渣不同提取部位对多种细菌表现出较强抑制活性。为进一步系统阐明传统黎药艾纳香抗菌药效物质基础,我们在前期研究基础上,对艾纳香醇提物的乙酸乙酯萃取部位进行了化学成分研究,共获得15个单体黄酮类化合物,并对单体化合物进行了体外抗菌活性评价。
1 材料与方法
1.1材料
1.1.1 艾纳香样品 实验用艾纳香叶片于2017年5月采自农业农村部儋州药用植物种质资源圃, 并由中国热带农业科学院热带作物品种资源研究所庞玉新研究员鉴定,标本存放于中国热带农业科学院热带作物品种资源研究所南药室。
1.1.2 供试菌株 金黄色葡萄球菌Staphyloco ccus aureussubsp.aureus (DSM 799), 大肠埃希菌Escherichia coli(DSM 1116) 和枯草芽孢杆菌Bacillus subtilis(DSM 1088) 均由青岛大学药学院李刚老师提供。
1.1.3 仪器与试剂 Bruker Avance-500MHz型核磁共振仪(Bruker公司);SYNAPT G2 MS型质谱仪(Waters Corporation, Milford, MA, USA);Waters 2487半制备液相色谱系统(Waters Corporation, Milford, MA, USA);CPA225D 精密电子分析天平(北京赛多利斯科学仪器有限公司);XFS-280A手提式压力蒸汽灭菌锅(浙江新风医疗器械有限公司);R206B旋转蒸发仪(上海申生科技有限公司);SW-CJ-1F超净工作台(苏州广源净化科技有限公司);DNP-9052BS-Ⅲ电热恒温培养箱(上海申苗医疗器械制造有限公司);KQ-500DB型台式数控超声波清洗器(昆山市超声仪器有限公司);SHB-Ⅲ循环水式多用真空泵(郑州世纪双科实验仪器有限公司);ZF-7A型紫外分析仪(上海勤科分析仪器有限公司);YMC-PACK ODS-A半制备型色谱柱(250 mm×10.0 mm,5 ?m)。sephadex LH-20葡聚糖凝胶(GE Healthcare Bio-Sciences AB, Sweden);ODS-A反相键合硅胶(北京慧德易科技有限责任公司);GF254薄层硅胶板、柱层析硅胶(青岛海洋化工厂);硅胶柱(60 cm×8 cm,40 cm×4 cm);凝胶柱(140 cm×2 cm,110 cm×1.5 cm);试验所用试剂均为分析纯。
1.2方法
1.2.1 提取分离 艾纳香叶片(6 kg)阴干,揉碎,用95%甲醇回流提取2次,每次提取3 h,抽滤,合并滤液,减压浓缩成浸膏。5倍体积的水悬浮,依次用石油醚、乙酸乙酯萃取,其中乙酸乙酯相减压浓缩得浸膏70 g,经硅胶柱(100~200目)层析,二氯甲烷-甲醇(100∶0、99∶1、98∶2、 97∶3、95∶5、10∶1、1∶1、0∶1,V/V)梯度洗脱,各梯度分别洗脱10个柱体积,根据薄层检测,合并得9个组分,分别编号A~ I。
组分B静置,底部析出浅黄色粉末,滤出得到化合物1(60 mg)。滤液减压浓缩,经ODS-A反相柱层析,甲醇-水(1∶9、2∶8、3∶7、4∶6、5∶5、6∶4、7∶3、8∶2、9∶1,V/V)梯度洗脱,每个梯度洗脱8个柱体积,根据薄层合并得7个流分(BFr.1~7),BFr.5静置析出化合物2(30 mg)。组分C经ODS-A反相柱层析,甲醇-水(1∶9、2∶8、3∶7、4∶6、5∶5、6∶4、7∶3、8∶2、9∶1,V/V)梯度洗脱,各梯度分别洗脱8个柱体积,根据薄层合并得6个流分(CFr.1~6)。CFr.4经sephadex LH-20柱层析,甲醇洗脱,得化合物8(40 mg)、11(30 mg)和12(35 mg)。CFr.5经sephadex LH-20柱层析,甲醇洗脱,得到化合物13(50 mg)。CFr.6经sephadex LH-20柱层析,甲醇洗脱,得化合物14(40 mg)。组分D经ODS-A反相柱层析,甲醇-水(1∶9、2∶8、3∶7、4∶6、5∶5、6∶4、7∶3、8∶2、9∶1,V/V)梯度洗脱,各梯度分别洗脱8个柱体积,根据薄层合并得到8个流分(DFr.1~8)。DFr.5静置析出化合物3(20 mg)。DFr.6与DFr.7合并,经HPLC制备,甲醇 水(77∶23 ,V/V)为流动相,得到化合物4(20 mg,tR=22.3 min,流速2 mL/min)和化合物5(15 mg,tR=22.8 min,流速2 mL/min)。DFr.4经sephadex LH-20柱层析,甲醇洗脱,得到化合物6(25 mg)。组分E经ODS-A反相柱层析,甲醇-水(1∶9、2∶8、3∶7、4∶6、5∶5、6∶4、7∶3、8∶2、9∶1,V/V)梯度洗脱,各比例分别洗脱5个柱体积,根据薄层检测得7个流分(EFr.1~7)。EFr.2经HPLC制备,甲醇-水(1∶1,V/V)为流动相,得到化合物7(10 mg,tR=23.8 min,流速为2 mL/min)。组分H经ODS-A反相柱层析,甲醇-水(3∶97、5∶95、1∶9、2∶8、3∶7、4∶6、5∶5、6∶4,V/V)梯度洗脱,每个梯度分别洗脱5个柱体积,根据薄层合并得6个流分(HFr.1~6)。HFr.1经sephadex LH-20柱层析,甲醇洗脱,得到化合物15(20 mg)。组分I经ODS-A反相柱层析,甲醇-水(3∶97、5∶95、1∶9、2∶8、3∶7、4∶6、5∶5、6∶4、7∶3,V/V)梯度洗脫,各梯度分别洗脱5个柱体积,根据薄层检测得8个流分(IFr.1~8)。IFr.1经HPLC制备,甲醇-水(1∶1,V/V)为流动相,得到化合物9(10 mg,tR=10.7 min,流速为2 mL/min)和化合物10(15 mg,tR=11 min,流速为2 mL/min)。
1.2.2 纯度检测和结构确证方法 (1)纯度检测方法。纯度检验方法采用2种不同的展开系统在薄层硅胶板上展开目标化合物,显色方法为紫外灯结合碘熏,如果均为单一斑点,则表明化合物纯度合格。(2)结构确证方法。采用波谱学技术(1H-NMR,13C-NMR),质谱技术及物理性质相结合的方法,确证纯化合物结构。
1.2.3 化合物抗菌活性评价方法 将保存于-80 ℃的金黄色葡萄球菌、大肠埃希菌和枯草芽孢杆菌菌株复苏后接种到LB培养基上,37 ℃振荡过夜。经血细胞计数板计数,调整菌悬液浓度约1×108CFU/mL,再用MHB培养基稀释100倍至106CFU/mL,作为供试菌悬液。采用96孔板倍比稀释法[7]测定化合物1~15对3株供试细菌的抑制活性,测定时每孔中最终菌悬液体积均为100 ?L,化合物1~15的浓度范围为8~128 ?g/mL,置37 ℃恒温培养箱中培养24 h,计算最低抑菌浓度(MIC),链霉素为阳性对照,所有实验重复3次。
2 结果与分析
2.1结构鉴定
化合物1,浅黄色粉末,ESI-MSm/z: 333.1 [M+H]+,分子式为C17H16O7,1H-NMR (500 MHz, CD3OD)δ: 7.00 (1H, d,J=2.5 Hz, H-2?), 6.96 (1H, dd,J=8.5, 2.5 Hz, H-6?), 6.95 (1H, d,J=8.5 Hz, H-5?), 6.08 (1H, d,J=2.0 Hz, H-6), 6.05 (1H, d,J=2.0 Hz, H-8), 4.98 (1H, d,J=11.5 Hz, H-2), 4.54 (1H, d,J=11.5 Hz, H-3), 3.87 (3H, s, 7-OCH3), 3.81 (3H, s, 4?-OCH3);13C-NMR (125 MHz, CD3OD)δ: 199.7 (C-4), 170.7 (C-7), 165.9 (C-5), 165.1 (C-9), 150.5 (C-4?), 148.4 (C-3?), 131.9 (C-1?), 121.6 (C-6?), 116.5 (C-5?), 113.2 (C-2?), 103.4 (C-10), 96.9 (C-6), 95.9 (C-8), 85.9 (C-2), 74.6 (C-3), 57.3 (7-OCH3), 57.2 (4?-OCH3)。以上數据与文献[8]对照基本一致,故鉴定该化合物为3,3?,5-三羟基-4?,7-二甲氧基二氢黄酮(图1)。
化合物2,淡黄色针状结晶,ESI-MSm/z: 345.1 [M+H]+,分子式为C18H16O7,1H-NMR (500 MHz, CD3OD)δ: 7.72(1H, d,J=2.0 Hz, H-2?), 7.67 (1H, dd,J=8.5, 2.0 Hz, H-6?), 6.93 (1H, d,J=8.5 Hz, H-5?), 6.62 (1H, d,J=2.0 Hz, H-8), 6.32 (1H, d,J=2.0 Hz, H-6), 3.94 (3H, s, 3-OCH3), 3.88 (3H, s, 3?-OCH3), 3.80 (3H, s, 7-OCH3);13C-NMR (125 MHz, CD3OD)δ: 178.7 (C-4), 165.9 (C-7), 161.4 (C-5), 156.9 (C-9), 156.8 (C-4?), 150.5 (C-2), 147.7 (C-3), 138.4 (C-3?), 122.5 (C-2?), 121.1 (C-6?), 115.2 (C-1?), 111.4 (C-5?), 105.3 (C-10), 97.6 (C-6), 91.7 (C-8), 59.2 (3-OCH3), 55.2 (3?-OCH3), 55.1 (7-OCH3)。以上数据与文献[9]基本一致,故鉴定该化合物为4?,5-二羟基-3,3?,7-三甲氧基黄酮(图1)。
化合物3,白色粉末,ESI-MSm/z: 303.3 [M+H]+,分子式为C16H14O6,1H-NMR (500 MHz, CD3OD)δ: 6.92 (1H, s, H-4?), 6.79 (2H, s, H-2?, 6?), 6.05 (1H, d,J=2.5 Hz, H-8), 6.03 (1H, d,J=2.5 Hz, H-6), 5.31 (1H, dd,J=12.5, 3.0 Hz, H-2), 3.80 (3H, s, 7-OCH3), 3.10 (1H, dd,J=17.0, 12.5 Hz, H-3b), 2.73 (1H, dd,J=17.0, 3.0 Hz, H-3a);13C-NMR (125 MHz, CD3OD)δ: 196.8 (C-4), 168.1 (C-7), 163.8 (C-5), 163.3 (C-9), 145.5 (C-3?), 145.1 (C-5?), 130.2 (C-1?), 117.9 (C-4?), 114.8 (C-6?), 113.9 (C-2?), 102.6 (C-10), 94.3 (C-6), 93.5 (C-8), 79.2 (C-2), 54.9 (7-OCH3), 42.7 (C-3)。以上数据与文献[10]基本一致,故鉴定该化合物为艾纳香素(图1)。
化合物4,浅黄色粉末,ESI-MSm/z: 317.3 [M+H]+,分子式为C16H12O7,1H-NMR (500 MHz, CD3OD)δ: 7.72 (1H, d,J=8.0 Hz, H-6?), 7.71 (1H, s, H-2?), 7.01 (1H, d,J=8.0 Hz, H-5?), 6.37 (1H, s, H-8), 6.17 (1H, s, H-6), 3.92 (3H, s, 7-OCH3);13C-NMR (125 MHz, CD3OD)δ: 175.9 (C-4), 164.3 (C-7), 161.1 (C-9), 156.8 (C-5), 149.2 (C-4?), 146.0 (C-2), 145.9 (C-3?), 136.2 (C-3), 124.0 (C-1?), 120.1 (C-6?), 114.2 (C-2?), 110.7 (C-5?), 103.1 (C-10), 97.9 (C-6), 93.0 (C-8), 54.9 (7-OCH3)。以上數据与文献[11]基本一致,故鉴定该化合物为3,5,3?,4?-四羟基-7-甲氧基黄酮(图1)。
化合物5,黄色结晶性粉末,ESI-MSm/z: 301.3 [M+H]+,分子式为C16H12O6,1H-NMR (500 MHz, CD3OD)δ: 7.47 (1H, d,J=8.5 Hz, H-6?), 7.37 (1H, s, H-2?), 7.06 (1H, d,J=8.5 Hz, H-5?), 6.56 (1H, s, H-8), 6.43 (1H, s, H-3), 6.20 (1H, s, H-6), 3.93 (3H, s, 4?-OCH3);13C-NMR (125 MHz, CD3OD)δ: 182.4 (C-4), 165.0 (C-7), 164.5 (C-2), 161.8 (C-9), 158.0 (C-5), 151.2 (C-4?), 146.8 (C-3?), 123.6 (C-6?), 118.6 (C-1?), 112.5 (C-2?), 111.2 (C-5?), 103.9 (C-3), 103.0 (C-10), 98.8 (C-6), 93.7 (C-8), 55.1 (4?-OCH3)。以上数据与文献[12]报道基本一致,故鉴定该化合物为香叶木素(图1)。
化合物6,黄色粉末,ESI-MSm/z: 331.1 [M+H]+,分子式为C17H14O7,1H-NMR (500 MHz, CD3OD)δ: 7.65 (1H, d,J=2.5 Hz, H-2?), 7.56 (1H, dd,J=8.5, 2.5 Hz, H-6?), 6.91 (1H, d,J=8.5 Hz, H-5?), 6.60 (1H, d,J=2.0 Hz, H-8), 6.34 (1H, d,J=2.0 Hz, H-6), 3.89 (3H, s, 7-OCH3), 3.80 (3H, s, 3-OCH3);13C-NMR (125 MHz, CD3OD)δ: 180.9 (C-4), 168.1 (C-7), 163.6 (C-5), 159.2 (C-2), 159.1 (C-9), 150.9 (C-4?), 147.3 (C-3?), 140.5 (C-3), 123.6 (C-1?), 123.2 (C-6?), 117.4 (C-2?), 117.2 (C-5?), 107.5 (C-10), 99.7 (C-6), 93.9 (C-8), 61.3 (7-OCH3), 57.3 (3-OCH3)。以上数据与文献[10]报道基本一致,故鉴定该化合物为3?,4?,5 -三羟基-3,7-二甲氧基黄酮(图1)。
化合物7,黄色粉末,ESI-MSm/z: 317.3 [M+H]+,分子式为C16H12O7, 1H-NMR (500 MHz, CD3OD)δ: 7.71 (1H, d,J=2.0 Hz, H-2?), 7.69 (1H, dd,J=9.0, 2.0 Hz, H-6?), 6.99 (1H, d,J=9.0 Hz, H-5?), 6.35 (1H, d,J=2.0 Hz, H-8), 6.16 (1H, d,J=2.0 Hz, H-6), 3.91 (3H, s, 3?-OCH3);13C-NMR (125 MHz, CD3OD)δ: 175.9 (C-4), 164.6 (C-7), 161.0 (C-9), 156.8 (C-5), 149.2 (C-4?), 145.9 (C-2, 3?), 136.1 (C-3), 123.9 (C-1?), 120.0 (C-6?), 114.2 (C-2?), 110.7 (C-5?), 103.0 (C-10), 98.0 (C-6), 93.2 (C-8), 54.9 (3?-OCH3)。以上数据与文献[13]基本一致,故鉴定该化合物为异鼠李素(图1)。
化合物8,黄色粉末,ESI-MSm/z: 361.1 [M+H]+,分子式为C18H16O8,1H-NMR (500 MHz, CD3OD)δ: 7.71 (1H, d,J=2.0 Hz, H-2?), 7.65 (1H, dd,J=8.5, 2.0 Hz, H-6?), 6.92 (1H, d,J=8.5 Hz, H-5?), 6.74 (1H, s, H-8), 3.96 (3H, s, 3?-OCH3), 3.93 (3H, s, 7-OCH3), 3.78 (3H, s, 3-OCH3);13C-NMR (125 MHz, CD3OD)δ: 178.7 (C-4), 156.7 (C-7), 154.5 (C-5), 149.7 (C-9), 147.5 (C-2), 145.3 (C-4?), 138.1 (C-3?), 129.6 (C-3), 122.3 (C-6), 121.6 (C-1?), 115.1 (C-6?), 111.4 (C-2?), 105.7 (C-5?), 105.4 (C-10), 90.3 (C-8), 59.1 (3-OCH3), 55.5 (7-OCH3), 55.1 (3?-OCH3)。以上數据与文献[10]基本一致,故鉴定该化合物为chrysosplenol C(图1)。
化合物9,黄色结晶性粉末,ESI-MSm/z: 465.4 [M+H]+,分子式为C21H20O12,1H-NMR (500 MHz, CD3OD)δ: 7.84 (1H, d,J=2.0 Hz, H-2?), 7.58 (1H, dd,J=8.0, 2.0 Hz, H-6?), 6.86 (1H, d,J=8.0 Hz, H-5?), 6.38 (1H, d,J=1.5 Hz, H-8), 6.18 (1H, d,J=1.5 Hz, H-6 ), 5.14 (1H, d,J=2.0 Hz, H-1?);13C-NMR (125 MHz, CD3OD)δ: 178.1 (C-4), 164.7 (C-7), 161.5 (C-5), 157.4 (C-9), 157.0 (C-2), 148.5 (C-4?), 144.4 (C-3?), 134.4 (C-3), 121.5 (C-1?), 121.4 (C-6?), 116.4 (C-5?), 114.7 (C-2?), 104.0 (C-10), 103.0 (C-1?), 98.5 (C-6), 93.4 (C-8), 75.7 (C-5?), 73.7 (C-3?), 71.8 (C-2?), 68.6 (C-4?), 60.5 (C-6?)。以上数据与文献[14]报道基本一致,故鉴定该化合物为金丝桃苷(图1)。
化合物10,黄色结晶性粉末,ESI-MSm/z: 465.4 [M+H]+,分子式为C21H20O12,1H-NMR (500 MHz, CD3OD)δ: 7.71 (1H, d,J=1.5 Hz, H-2?), 7.58 (1H, dd,J=8.0, 1.5 Hz, H-6?), 6.86 (1H, d,J=8.0 Hz, H-5?), 6.38 (1H, d,J=1.5 Hz, H-8), 6.18 (1H, d,J=1.5 Hz, H-6), 5.14 (1H, d,J=2.0 Hz, H-1?);13C-NMR (125 MHz, CD3OD)δ: 178.0 (C-4), 164.7 (C-7), 161.6 (C-5), 157.6 (C-9), 157.0 (C-2), 148.4 (C-4?), 144.5 (C-3?), 134.2 (C-3), 121.8 (C-1?), 121.6 (C-6?), 116.2 (C-5?), 114.6 (C-2?), 104.2 (C-10), 100.2 (C-1?), 98.5 (C-6), 93.4 (C-8), 77.0 (C-5?), 76.7 (C-3?), 74.3 (C-2?), 69.8 (C-4?), 61.1 (C-6?)。以上数据与文献[15]报道基本一致,故鉴定该化合物为异槲皮苷(图1)。
化合物11,黄色结晶性粉末,ESI-MSm/z: 303.1 [M+H]+,分子式为C16H14O6,1H-NMR (500 MHz, CD3OD)δ: 6.94 (1H, d,J=2.0 Hz, H-2?), 6.92 (1H, d,J=8.5 Hz, H-5?), 6.90 (1H, dd,J=8.5, 2.0 Hz, H-6?), 5.89 (1H, d,J=2.5 Hz, H-8), 5.87 (1H, d,J=2.5 Hz, H-6), 5.32 (1H, dd,J=12.5, 3.0 Hz, H-2), 3.06 (1H, dd,J=17.0, 12.5 Hz, H-3b), 2.71 (1H, dd,J=17.0, 3.0 Hz, H-3a), 3.86 (3H, s, 4?-OCH3);13C-NMR (125 MHz, CD3OD)δ: 196.1 (C-4), 167.4 (C-7), 164.1 (C-5), 163.3 (C-9), 147.9 (C-4?), 146.4 (C-3?), 131.7 (C-1?), 117.6 (C-6?), 113.1 (C-5?), 111.2 (C-2?), 101.8 (C-10), 95.7 (C-6), 94.9 (C-8), 78.8 (C-2), 55.0 (4?-OCH3), 42.6 (C-3)。以上數据与文献[16]报道基本一致,故鉴定该化合物为3?,5,7-三羟基-4?-甲氧基二氢黄酮(图1)。
化合物12,白色粉末,ESI-MSm/z: 287.1 [M+H]+,分子式为C16H14O5,1H-NMR (500 MHz, CD3OD)δ: 7.24 (2H, d,J=8.5 Hz, H-2?, 6?), 6.80 (2H, d,J=8.5 Hz, H-5?, 3?), 5.95 (1H, d,J=2.5 Hz, H-8), 5.93 (1H, d,J=2.5 Hz, H-6), 5.21 (1H, dd,J=13.0, 3.0 Hz, H-2), 3.01 (1H, dd,J=17.0, 13.0 Hz, H-3b), 2.61 (1H, dd,J=17.0, 3.0 Hz, H-3a), 3.71 (3H, s, 7-OCH3);13C-NMR (125 MHz, CD3OD)δ: 196.7 (C-4), 167.9 (C-4?), 163.7 (C-7), 163.1 (C-5), 157.6 (C-9), 129.5 (C-1?), 127.7 (C-2?, 6?), 115.0 (C-3?, 5?), 102.6 (C-10), 94.4 (C-6), 93.6 (C-8), 79.1 (C-2), 54.9 (7-OCH3), 42.5 (C-3)。以上数据与文献[17]报道基本一致,故鉴定该化合物为sakuranetin(图1)。
化合物13,黄色粉末,ESI-MSm/z: 315.1 [M+H]+,分子式为C17H14O6,1H-NMR (500 MHz, DMSO)δ: 7.57(1H, dd,J=8.5, 2.0 Hz, H-6?), 7.47 (1H, d,J=2.0 Hz, H-2?), 7.09 (1H, d,J=8.5 Hz, H-5?), 6.81(1H, s, H-3), 6.75 (1H, d,J=2.0 Hz, H-8 ), 6.37 (1H, d,J=2.0 Hz, H-6), 3.87(6H, s, 7, 4?-OCH3); 13C-NMR (125 MHz, DMSO)δ: 182.3 (C-4), 165.6 (C-4?), 164.3 (C-7), 161.6 (C-5), 157.7 (C-9), 151.7 (C-2), 147.3 (C-3?), 123.3 (C-1?), 119.3 (C-5?), 113.5 (C-2?), 112.6 (C-6?), 105.2 (C-3), 104.2 (C-10), 98.5 (C-6), 93.1 (C-8), 56.5 (7-OCH3), 56.3 (4?-OCH3)。以上数据与文献[18]报道基本一致,故鉴定该化合物为pilloin(图1)。
化合物14,黄色粉末,ESI-MSm/z: 317.1 [M+H]+,分子式为C16H12O7,1H-NMR (500 MHz, CD3OD)δ: 7.61 (1H, d,J=2.0 Hz, H-2?), 7.51 (1H, dd,J=8.5, 2.0 Hz, H-6?), 6.90 (1H, d,J=8.5 Hz, H-5?), 6.37 (1H, d,J=2.0 Hz, H-8), 6.18 (1H, d,J=2.0 Hz, H-6), 3.78 (3H, s, 3-OCH3);13C-NMR (125 MHz, CD3OD)δ: 178.5 (C-4), 164.5 (C-7), 161.5 (C-5), 156.9 (C-9), 156.5 (C-2), 148.5 (C-4?), 145.0 (C-3?), 138.1 (C-3), 121.5 (C-1?), 120.9 (C-6?), 115.1 (C-5?), 115.0 (C-2?), 104.4 (C-10), 98.4 (C-6), 93.4 (C-8), 59.1 (3-OCH3)。以上数据与文献[19]报道基本一致, 故鉴定该化合物为5,7,3?,4?-四羟基-3-甲氧基黄酮(图1)。
化合物15,黄色粉末,ESI-MSm/z: 359.1 [M+H]+, 分子式为C19H18O7,1H-NMR (500 MHz, CDCl3)δ: 12.63 (1H, s, 5-OH), 7.74 (1H, dd,J=8.5, 2.5 Hz, H-6?), 7.68 (1H, d,J=2.5 Hz, H-2?), 6.99 (1H, d,J=8.5 Hz, H-5?), 6.44 (1H, d,J=2.5 Hz, H-8), 6.34 (1H, d,J=2.5 Hz, H-6), 3.97 (3H, s, 3-OCH3), 3.96 (3H, s, 3?-OCH3), 3.84 (3H, s, 4?-OCH3), 3.86 (3H, s, 7-OCH3);13C-NMR (125 MHz, CDCl3)δ: 178.7 (C-4), 165.4 (C-7), 162.0 (C-9), 156.7 (C-4?), 155.8 (C-5), 151.4 (C-3?), 148.8 (C-3), 138.9 (C-2), 122.9 (C-1?), 122.2 (C-6?), 111.3 (C-5?), 110.8 (C-2?), 106.0 (C-10), 97.8 (C-8), 92.2 (C-6), 60.1 (3-OCH3), 56.1 (3?-OCH3), 55.9 (4?-OCH3), 55.8 (7-OCH3)。以上数据与文献[20]报道基本一致,故鉴定该化合物为5-羟基-3,7,3?,4?-四甲氧基黄酮(图1)。
2.2活性评价
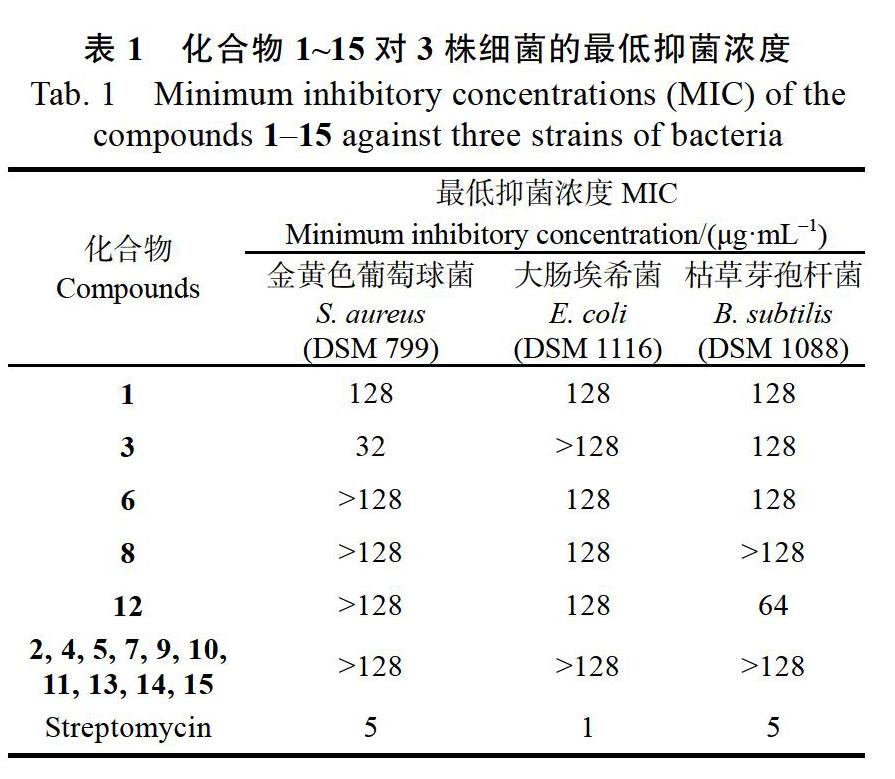
结果显示,化合物1、3、6、8和12对3株细菌具有不同程度的抑制活性,MIC值为32~128 ?g/mL(表1)。其中化合物3对金黄色葡萄球菌抑制活性最强,MIC值为32 ?g/mL,化合物12对枯草芽孢杆菌的抑制活性较强,MIC值为64 ?g/mL。化合物1、6、8对3株细菌表现出较弱的抑制作用,其他化合物均无抑菌活性(MIC>128 ?g/mL)。
3 讨论
艾纳香作为传统民族药具有悠久的用药历史,且为《中华人民共和国药典》2015年版规定的天然冰片唯一来源植物[21],艾纳香的传统药用和现代药理学研究均显示其具有很好的抗菌效果,然而其具体的抗菌成分一直不明确。目前关于艾纳香化学成分研究共报道非挥发性成分80余种,其中萜类13种,黄酮类36种,其单体化合物的活性评价主要集中在抗炎和抗肿瘤方面,而抗菌方面报道很少,仅袁媛等[22]2018年报道艾纳香中6种黄酮单体化合物,并进行了抗菌活性评价。Pang等[23]报道艾纳香总黄酮成分具有保护大鼠伤口避免感染和促进伤口愈合的活性,提示艾纳香黄酮类化合物可能为艾纳香中的主要抗菌活性成分。元超等[24]通过UPLC-Qtof-MS/DAD技术对艾纳香不同提取部位化学成分的分析显示,黄酮类成分主要集中在乙酸乙酯部位,而萜类成分主要分布于石油醚部位。為进一步明确传统黎药艾纳香的抗菌药效物质基础,本研究对乙酸乙酯部位进行了系统研究,共分离获得了15个黄酮类化合物,其中化合物7、11、12和13为首次从该植物分离,通过进一步的体外抗菌活性评价,筛选出1个抗菌活性强的单体化合物-艾纳香素(3),其对金黄色葡萄球菌的最低抑菌浓度(MIC)达到32 ?g/mL,其他化合物亦表现出不同程度的抑菌活性(MIC:32~128 ?g/mL),然而仍有很多化合物无活性(MIC>128 ?g/mL),且单体化合物活性整体上并不强(阳性对照链霉素MIC:1~5 ?g/mL),推测艾纳香发挥药效的主要机制可能是多成分、多靶点的,且各成分间具有协同作用。

