金刚烷胺单克隆抗体的制备和鉴定
范素菊 李嘉 李森 杨兴东

摘要:为制备金刚烷胺(AMD)的单克隆抗体(mAb),改造AMD的半抗原,采用EDC/NHS法合成人工免疫原AMD-BSA和检测抗原AMD-OVA,经紫外扫描和凝胶电泳进行鉴定,AMD与载体蛋白[牛血清白蛋白(BSA)、鸡卵白蛋白(OVA)]成功偶联;用被免疫原(AMD-BSA)免疫BALBC/c小鼠的脾细胞与骨髓瘤细胞进行融合,获得AMD杂交瘤细胞株,腹腔注射小鼠后,得到抗AMD的mAb。小鼠免疫后的多抗血清的效价均在6.4×103以上,所制得的杂交瘤细胞上清液的效价为3.6×102~1.0×103,2D5细胞株的腹水效价为5.12×105,对AMD的IC50值为1.02 μg/L,除与金刚乙胺的交叉反应率为9.82%,与其他结构类似物无交叉反应性。表明获得了高价、敏感和特异的抗AMD的单克隆抗体,为进一步的免疫学快速检测提供了技术支持。
关键词:金刚烷胺;免疫原;单克隆抗体;ELISA;抗体制备;抗体鉴定
中图分类号: S852.4+3
文献标志码: A
文章编号:1002-1302(2019)15-0220-04
金刚烷胺(amantadine,AMD)是一种稳定、无色、结晶的胺,具有特殊的对称性结构。由于其具有干扰M2流感病毒蛋白合成和抗胆碱的作用[1],临床上用作抗帕金森病毒和抗病毒药物[2-3];在动物饲养中,AMD主要用于治疗和预防禽流感和猪的传染性胃肠炎[4-5]。但是,AMD的过度使用会对人类和环境产生不利的生态后果。首先,它的广泛使用可以增加细菌耐药菌株的发生[6-8]。其次,AMD的残留物可能通过食物链进入人体。AMD在人体内蓄积6周以上可以引起恶心、头晕、失眠、心慌等影响[9]。事实上,美国食品和药物管理局已经禁止在牲畜中使用AMD;2005年,中国原农业部(公告号:560)禁止AMD作为家禽的抗病毒兽药。然而,由于其低廉的价格和可用性,家禽业中AMD仍然作为A型禽流感的治疗药在非法使用[6]。因此,已经建立了许多分析方法以检测AMD的残留。
代谢研究结果表明,AMD在体内以原型形式存在并在体内积聚[10]。目前,AMD检测方法包括液相色谱法[11-12]、荧光液相色谱法[13]、高效液相色谱法[14-15]、毛细管区带电泳法[16]、选择性和荧光分光光度法[17]、气相色谱法[18]、毛细管气体色谱法[19]、五氟苯甲酰氯萃取衍生化气相色谱法[20]和液相色谱-串联质谱法[21]。虽然这些方法准确而敏感,但这些色谱方法需要昂贵的设备、繁杂的预处理、技术熟练的操作人员,因此,它们不适合AMD的现场筛查。可见,在动物源性食品中开发直观、灵敏、高效的AMD检测分析方法至关重要。酶联免疫吸附测定(ELISA)[22]和胶体金免疫层析测定[23]代表快速、特异、方便和高度敏感的方法,适用于分析大量样品。在这项研究中,制备了一种针对AMD的新型单克隆抗体,为今后的免疫学快速检测提供技术上的支持。
1 材料与方法
1.1 材料与仪器
金刚烷胺、1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(EDC)、羟琥珀亚酰胺(NHS)、弗氏佐剂,Sigma公司产品;羊抗鼠酶标二抗,洛阳华美生物工程有限公司;其他试剂均为AR级。SPF级雌性BABLC/c小鼠购自郑州大学实验动物中心,由周口师范学院神经转化医学实验动物中心饲养。
仪器设备:Thermo Scientific NanoDrop 2000c紫外分光光度计,Thermo Electron;Multiskan FC型酶标仪,上海赛默飞世尔仪器有限公司;LHS-450恒温培养箱,郑州生元仪器有限公司;AR224CN电子天平,上海奥豪斯仪器有限公司;凝胶成像系统及分析软件,上海天能科技股份有限公司;DYY-6D型电泳仪电源,北京六一生物科技有限公司;90-2定时恒温双向磁力搅拌器,上海精科实业有限公司;HCJ-4A数显恒温磁力搅拌水浴锅,常州市金坛区指前镇旭日实验仪器厂;SW-CJ-2G型超净工作台,苏州净华仪器有限公司;3701型二氧化碳培养箱,USA Precision公司。
1.2 方法
1.2.1 AMD免疫原的合成及鉴定 参考Xu等报道的方法进行AMD免疫原的合成[22]。80 mg AMD充分溶解在 3 mL 的甲苯和一定量的二碳酸二叔丁酯溶液中,然后加入105 mg 6-溴乙酸乙酯,在氮气保护下升温至128 ℃充分回流2 d,旋转蒸发后的产物调节pH值至10,然后调节pH值为1,干燥浓缩后得含有羧基的AMD半抗原(图1-A)。取 12 mg AMD半抗原,加入3 mL N,N-二甲基甲酰胺溶解,依次加入11 mg NHS,17 mg EDC,冰浴条件下搅拌反应18 h,得到A液;30 mg牛血清白蛋白(BSA)加入3 mL PBS溶液中(B液)。将A液慢速滴加到B液中,室温下反应1 d;放入透析袋中用PBS缓冲液透析3 d,制得AMD免疫原,其反应路线见图1-B。利用紫外扫描和十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)[24]来判断AMD和载体蛋白是否成功偶联。
1.2.2 动物免疫 用70 mg免疫原(AMD-BSA)和等体积的弗氏完全佐剂充分乳化后,背部皮下多点注射到3只小鼠,间隔18 d之后用同样的剂量与弗氏不完全佐剂乳化后,对BABLC/c小鼠进行免疫,先后共免疫5次;免疫结束后,小鼠尾静脉采血,得到抗AMD多克隆抗体血清(polyclonal antibody serum,pAbs),并进行鉴定。
1.2.3 单克隆抗体制备 利用融合剂PEG4000,将免疫最优小鼠的脾细胞和骨髓瘤细胞SP2/0按一定比例混合,并加入GNK溶液和HAT培养基,然后将混合液按0.1 m/孔加入到铺有饲养细胞的细胞培养板中,用酶联免疫吸附试验(ELISA)筛选阳性孔,有限稀释法对筛选到的阳性孔进行亚克隆,得到抗AMD的杂交瘤细胞株,将细胞株注入到经液体石蜡处理过的小鼠腹腔中,以此来制備抗AMD mAbs。
1.2.4 AMD mAbs的鑒定
1.2.4.1 抗AMD mAbs效价测定 间接ELISA检测抗AMD mAbs效价[25]:检测抗原(AMD-OVA)包被在ELISA板内;依次加入倍比稀释的AMD mAbs、酶标二抗和显色液,每步孵育一定时间后均用PBST洗板;加入终止液后,放入酶标仪进行测定。
1.2.4.2 抗AMD mAbs敏感性测定 间接竞争ELISA检测mAbs对AMD的半数抑制浓度(IC50),以此来鉴定其敏感性。其操作过程与间接ELISA的区别在于包板后,每孔加入D450 nm值为1.0左右的mAbs和倍比稀释的AMD标准品。
1.2.4.3 AMD mAbs特异性测定 依据交叉反应(cross reaction,CR)试验鉴定AMD的特异性。用间接竞争ELISA测定金刚乙胺、金刚烷、1-金刚烷羧酸、利巴韦林、吗啉胍、阿昔洛韦、呋喃唑酮等类似物的IC50值。CR=(金刚烷胺IC50值/其他化合物IC50值)×100%。
2 结果与分析
2.1 AMD免疫原的鉴定结果
图2显示,BSA的吸收峰(10 mm)在280 nm的位置,AMD的吸收峰在412 nm的位置,AMD-BSA的吸收峰(10 mm)与BSA的吸收峰相比发生了向右偏移,表明半抗原AMD与BSA已经联结。BSA的泳动速率略大于AMD-BSA的泳动速率(图3),分析物分子质量的大小与泳动速率成反比,由此可知BSA与AMD成功联结。
2.2 AMD pAbs的效价、敏感性鉴定结果
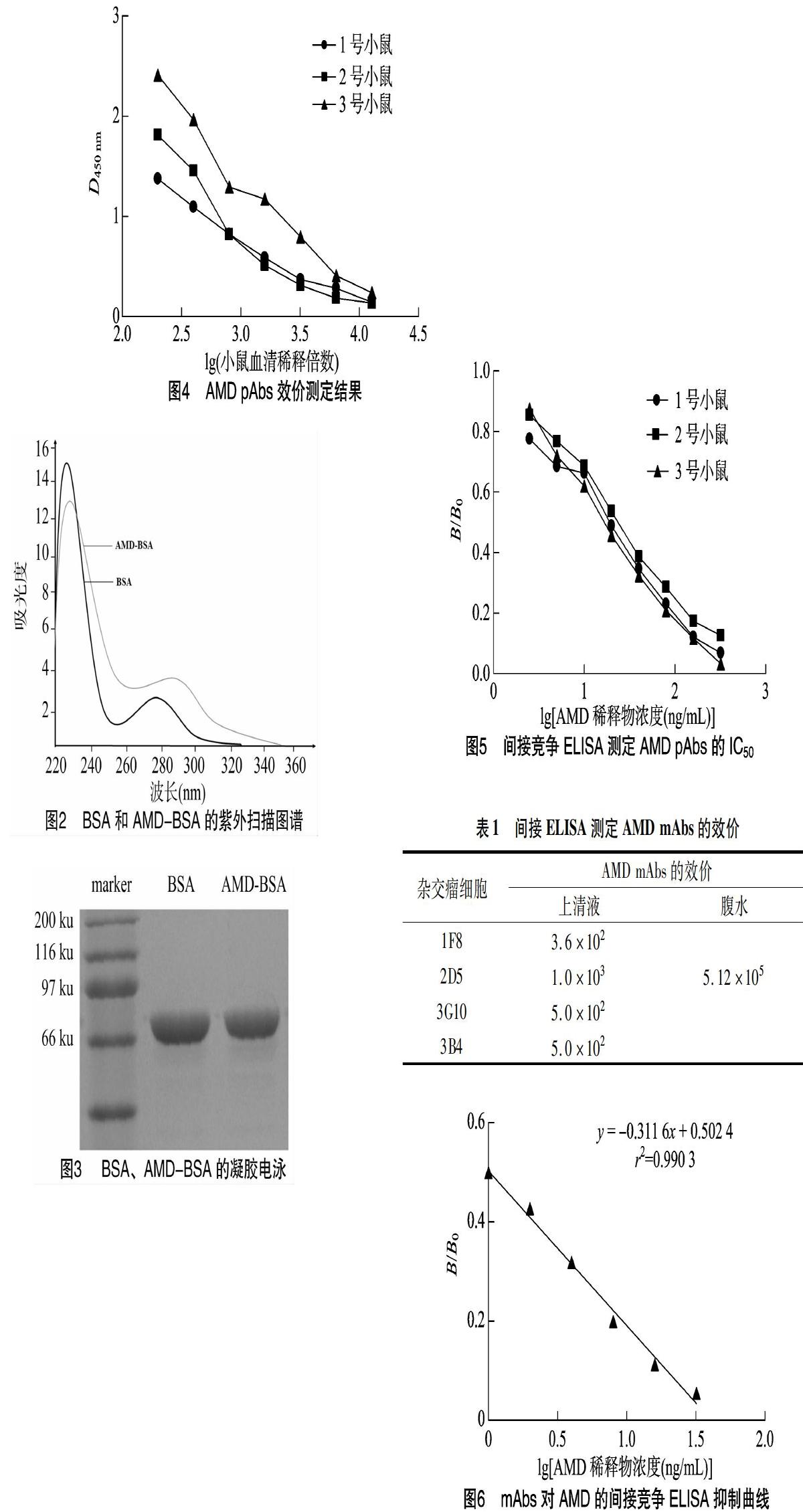
免疫原(AMD-BSA)免疫的1号和2号BABLC/c小鼠的pAbs效价都达到6.4×103以上,2号小鼠达到1.28×104(图4),表明AMD pAbs效价较高,免疫原(AMD-BSA)的免疫原性优良。3只被免小鼠的mAbs均有抑制的产生,其中以3号被免小鼠的抑制最优(图5),以AMD的稀释浓度的对数值为横坐标,标准品测定值/不加标准品测定值(B/B0)为纵坐标作图,线性回归方程:y=-0.406 1x+1.008 6,r2=0991 6,由此方程推算出AMD的IC50值为17.88 μg/L,进一步表明mAbs具有较高的敏感性。
2.2 AMD mAbs的鉴定结果
2.2.1 效价测定结果 利用ELISA筛选出4株杂交瘤细胞稳定分泌的AMD mAbs,其效价较高,其中2D5细胞株的上清液效价最优,用此株诱生抗AMD的腹水,效价为2.15×105(表1)。
2.2.2 敏感性界定结果 间接竞争LEISA测定细胞株的AMD mAbs的回归方程为y=-0.311 6x+0.502 4(r2=0.990 3)(图6),2D5对AMD的IC50为1.02 μg/L,进一步表明本研究所制得的mAbs对AMD的敏感性较好。
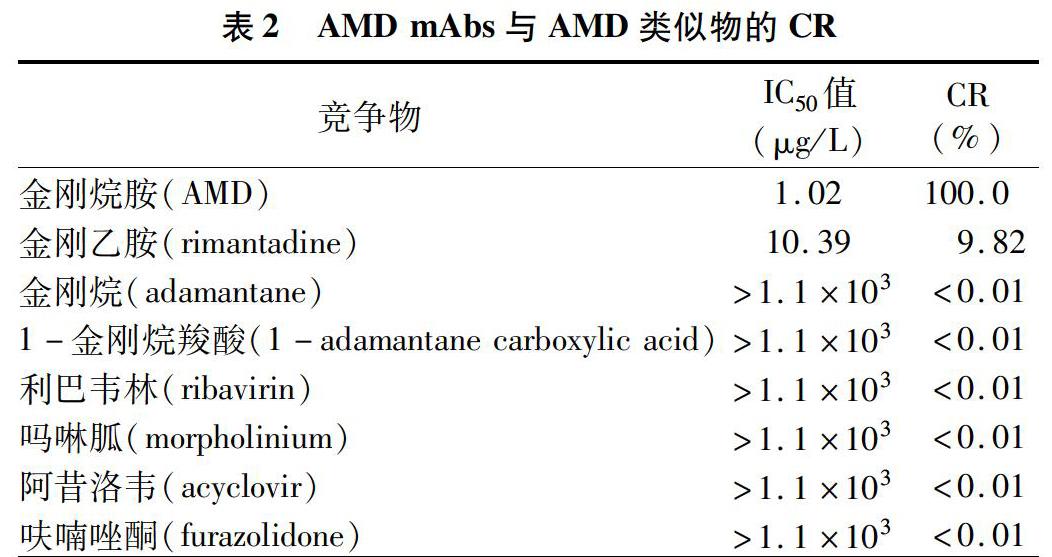
2.2.3 AMD mAbs的特异性鉴定结果 AMD mAbs与金刚乙胺的CR为9.82%,与金刚烷、1-金刚烷羧酸、利巴韦林、吗啉胍、阿昔洛韦、呋喃唑酮等类似物没有CR(表2),进一步表明AMD mAbs特异性较强。
3 讨论与结论
高质量的抗原是制备优质抗体的基础。根据文献报道,Xu等首先利用二碳酸二叔丁酯保护AMD上的氨基,然后使用6-溴乙酸乙酯在AMD上引入活性基团[—(CH2)5COOH], 运用EDC/NHS法与载体蛋白(BSA或OVA)进行连接,免疫小鼠后的AMD mAbs IC50值为 50 μg/L[22];Wu等采用EDC和乙二胺改造载体蛋白(BSA或OVA)的羧基位点使之转换为氨基,然后利用戊二醛法使AMD与载体蛋白发生偶联;制备所得多抗具备一定效价,免疫小鼠后,获得的AMD mAbs具有较高的效价(1×104以上),但对AMD的抑制率偏低(10%以下)[23]。
虽然紫外扫描、色谱法、SDS-PAGE等通常被用来鉴定免疫原的制备结果,但是紫外扫描由于半抗原和载体蛋白及偶联物的溶解基质不同,同时不用的浓度产生的波峰不尽相同,所以判定起来存在困难;色谱法存在操作繁杂、耗时长和须要不断地熟悉操作等缺点,现实应用起来较为吃力;AMD的分子质量较小(<200),与载体蛋白的偶联数目有限[1 ∶ (10~25)],使得通过SDS-PAGE来判定是否成功联结判定结果很难用肉眼区分开来。小鼠血清的IC50鉴定是判断成功偶联最可靠的手段,但是等待时间较长,一旦失败,须从头再来,使得试验周期大大增加。综上所述,寻找切实可行的免疫原的鉴定方法是广大免疫工作者须解决的问题。
本研究小鼠的效价均在6.4×103以上,利用细胞融合技术筛选出4株特异性、特异性较强的细胞株,制备出AMD mAbs,并对其效价、敏感性及特异性进行了鉴定,mAbs对AMD的IC50为1.02 μg/L,结果表明,以该抗体为基础,能够为以后AMD残留的免疫检测方法的建立提供技术支持。
参考文献:
[1]Pabbaraju K,Ho K C,Wong S,et al. Adamantane resistance in circulating human influenza A viruses from Alberta,Canada (1970—2007)[J]. Antiviral Research,2008,79(2):81-86.
[2]Monod A,Swale C,Tarus B,et al. Learning from structure-based drug design and new antivirals targeting the ri-bonucleoprotein complex for the treatment of influenza[J]. Expert Opinion on Drug,2015,10(4):345-371.
[3]Pahwa R,Tanner C M,Hauser R A,et al. Amantadine extended release for levodopa-induced dyskinesia in Parkinsons disease (EASED study)[J]. Movement Disorders,2015,30(6):788-795.
[4]Hao X,Li N,Xu Z,et al. An electrochemical sensing strategy for amantadine detection based on host-guest interaction of methylene blue/b-cyclodextrin/poly (N-acetylaniline) modified electrode[J]. Electroanalysis,2016,28(7):1489-1494.
[5]Zhang J Z,Zhao J,Zhou J H,et al. Determination of amantadine residue in honey by solid-phase extraction and high-performance liquid chromatography with pre-column derivatization and fluorometric detection[J]. Chinese Journal of Chemistry,2011,29(8):1764-1768.
[6]He G,Qiao J,Dong C,et al. Amantadine-resistance among H5N1 avian influenza viruses isolated in northern China[J]. Antiviral Research,2008,77(1):72-76.
[7]Bright R A,Shay D K,Shu B,et al. Adamantane resistance among influenza A viruses isolated early during the 2005—2006 influenza season in the United States[J]. Journal of the American Medical Association,2006,295(8):891-894.
[8]Cheung C L,Rayner J M,Smith G J,et al. Distribution of amantadine-resistant H5N1 avian influenza variants in Asia[J]. Journal of Infectious Diseases,2006,193(12):1626-1629.
[9]Arndt T,Guessregen B,Hohl A,et al. Determination of serum amantadine by liquid chromatography-tandem mass spectrometry[J]. Clinica Chimica Acta,2005,359(1/2):125-131.
[10]Morrison D,Roy S,Rayner C,et al. A randomized,crossover study to evaluate the pharmacokinetics of amantadine and oseltamivir administered alone and in combination[J]. PLoS One,2007,2(12):1694-1702.
[11]Higashi Y,Fujii Y. Liquid chromatographic determination of 1-adamantanamine and 2-adamantanamine in human plasma after pre-column derivatization with o-phthalaldehyde and 1-thio-β-d-glucose[J]. Journal of Chromatography(B,Analytical Technologies in the Biomedical and Life Sciences),2004,799(2):349-354.
[12]Higashi Y,Nakamura S,Matsumura H,et al. Simultaneous liquid chromatographic assay of amantadine and its four related compounds in phosphate-buffered saline using 4-fluoro-7-nitro-2,1,3-benzoxadiazole as a fluorescent derivatization reagent[J]. Biomedical Chromatography,2006,20(5):423-428.
[13]Duh T H,Wu H L,Pan C W,et al. Fluorimetric liquid chromatographic analysis of amantadine in urine and pharmaceutical formulation[J]. Journal of Chromatography A,2005,1088(1/2):175-181.
[14]Shuangjin C,Fang F,Han L,et al. New method for high-performance liquid chromatographic determination of amantadine and its analogues in rat plasma[J]. Journal of Pharmaceutical and Biomedical Analysis,2007,44(5):1100-1105.
[15]Higashi Y,Uemori I,Fujii Y. Simultaneous determination of amantadine and rimantadine by HPLC in rat plasma with pre-column derivatization and fluorescence detection for pharmacokinetic studies[J]. Biomedical Chromato-graphy,2005,19(9):655-662.
[16]Chen H X,Zhang X X. Antibody development to testosterone and its application in capillary electrophoresis-based immunoassay[J]. Electrophoresis,2008,29(16):3406-3413.
[17]Mahmoud A M,Khalil N Y,Darwish I A,et al. Selective spectrophotometric and spectrofluorometric methods for the determination of amantadine hydrochloride in capsules and plasma via derivatization with 1,2-naphthoquinone-4-sulphonate[J]. International Journal of Analytical Chemistry,2009,2009:810104.
[18]Farajzadeh M A,Nouri N,Alizadeh Nabil A A. Determination of amantadine in biological fluids using simultane-ous derivatization and dispersive liquidliquid microextraction followed by gas chromatography-flame ionization detection[J]. Journal of chromatography(B, Analytical Technologies in the Biomedical andLife Sciences),2013,940:142-149.
[19]Yao W,Luo X,Hu Y. Determination of amantadine sulfate in sodium chloride injection by capillary gas chroma-tography[J]. PDA Journal of Pharmaceutical Science and Technology,2006,60(3):138-143.
[20]Ho C,Wong Y T. Fast and high throughput screening of amantadine in chicken muscle by extractive derivatization with penta fluorobenzoyl chloride and gas chromatography/negative ion
chemical ionization-tandem mass spec-trometry[J]. Journal of AOAC International,2014,97(4):1220-1224.
[21]Berendsen B J,Wegh R S,Essers M L,et al. Quantitative trace analysis of a broad range of antiviral drugs in poultry muscle using column-switch liquid chromatography coupled to
tandem mass spectrometry[J]. Analytical and Bioanalytical Chemistry,2012,402(4):1611-1623.
[22]Xu L,Peng S,Liu L,et al. Development of sensitive and fast immunoassays for amantadine detection[J]. Food and Agricultural Immunology,2016,27(5):678-688.
[23]Wu S,Zhu F,Hu L,et al. Development of a competitive immunochromatographic assay for the sensitive detection of amantadine in chicken muscle[J]. Food Chemistry,2017,232:770-
776.
[24]郭堯君. 蛋白质电泳实验技术[M]. 北京:科学出版社,1999:56-60.
[25]姚静静,胡骁飞,韩俊岭,等. 伏马菌素B1单克隆抗体的制备及免疫学检测方法初步应用[J]. 畜牧兽医学报,2016,47(5):1009-1017.杨海燕,董珊珊,黄正金,等. 采后热激处理对蓝莓鲜果品质与生理的影响[J]. 江苏农业科学,2019,47(15):233-236.

