金刚烷胺模拟废水Fenton氧化及其中间产物分析
曾萍,宋永会* ,DRESELY Johanna,HOFFMANN Erhard
1.中国环境科学研究院城市水环境研究室,北京 100012
2.卡尔斯鲁厄理工大学,德国卡尔斯鲁厄 76128
金刚烷胺别名三环癸胺,是一种粉末状白色结晶体,无臭无味,微溶于水,溶于有机溶剂苯,性质稳定,不与光和空气发生反应,其分子式为C10H18N[1]。金刚烷胺是美国批准的第一种抗病毒药,并相继载入英国药典、美国药典、日本药典和中国药典[2]。中国于1971年开始生产。金刚烷胺具有多巴胺能(Dopaminergic)和抗病毒的性质,在临床上能有效地预防和治疗各种A型流感病毒的感染[3]。制药生产过程中产生的金刚烷胺废水为高浓度、难生物降解废水,如果不经有效处理直接排入水体,将破坏受纳水体的生态系统[4]。然而,国内外关于金刚烷胺废水处理的研究尚处于起步阶段。目前报道金刚烷胺废水有2种处理工艺:1)结晶法。通过投加化学药剂降低金刚烷胺在水中的溶解度,使其结晶析出。该工艺既能降低废水中金刚烷胺浓度,又能对结晶产物进行回收,实现资源的再利用[5-6]。2)Fenton法[4]。通过反应过程中产生的羟基自由基与金刚烷胺反应,打破金刚烷胺的环状碳链,将金刚烷胺完全氧化为二氧化碳和水,但已报道的Fenton试剂处理金刚烷胺废水的氧化效率低于40%[4]。因此,对金刚烷胺废水的处理技术还有待于进一步的摸索与实践。
Fenton试剂是为数不多的以人名命名的试剂,由亚铁离子和过氧化氢组成[7-8]。Fenton法为一种高级氧化技术,1894年法国人Fenton发现Fe2+作用于H2O2加快了废水中苹果酸的氧化得以应用。1964年Eisenhouser首次使用Fenton试剂处理苯酚及烷基苯废水,开创了Fenton试剂应用于工业废水处理领域的先例[9]。迄今为止,Fenton试剂已经广泛地应用于精细化工、医药化工、医药卫生、环境污染治理等方面[10-13]。Fenton试剂的氧化力极强,具有来源广且便宜无毒、均相传质、操作简便等优势,其化学反应式如下[14]:

Fenton反应的反应原理复杂,主要原理是过氧化氢在亚铁离子催化作用下分解产生羟基自由基(·OH),羟基自由基通过进攻废水中的有机物分子,使有机物的碳链发生裂变,生成小分子有机物,或完全氧化为水和二氧化碳,从而去除废水中的CODCr[15-16],且 Fenton 试剂还具有絮凝、沉淀功能,对废水CODCr去除也有贡献,因此Fenton法是一种很有效的废水处理方法。
笔者采用Fenton法处理金刚烷胺制药废水,研究不同反应条件下Fenton试剂对金刚烷胺的去除效果,确定反应的最佳条件,以期为Fenton法处理金刚烷胺制药废水工艺参数的确定提供依据。
1 材料与方法
1.1 仪器和试剂
1.1.1 装置
试验装置主要由反应器、磁力搅拌器及磁力搅拌子等组成,如图1所示,反应器容积为500 mL。

图1 试验装置Fig.1 Schematic diagram of lab scale experimental equipment
1.1.2 仪器
紫外可见分光光度计(UNIC 4802,尤尼柯仪器有限公司);pH计(OHAUS STARTER3C,奥豪斯仪器有限公司);烘箱(DHG-9246A型,上海树立仪器仪表有限公司);精密分析天平(101FAB-1,梅特勒-托利多仪器有限公司);加热板(Labtech,莱伯泰科有限公司);BOD分析仪(WTW OxiTop,德国德力隆公司);COD消解加热器(WTW,德国德力隆公司);磁力搅拌器(J27-115,北京金紫光仪器仪表公司)。
1.1.3 试剂
30%过氧化氢,硫酸亚铁(Fe2SO4·7H2O),硫酸,氢氧化钠,重铬酸钾,硫酸亚铁。均为分析纯。
1.1.4 废水
模拟废水由盐酸金刚烷胺原料药(金刚烷胺的物化性质如表1所示)溶于水配制而成,配制的金刚烷胺浓度为5000 mg/L,温度为室温(23~25℃),pH 为 6.0。
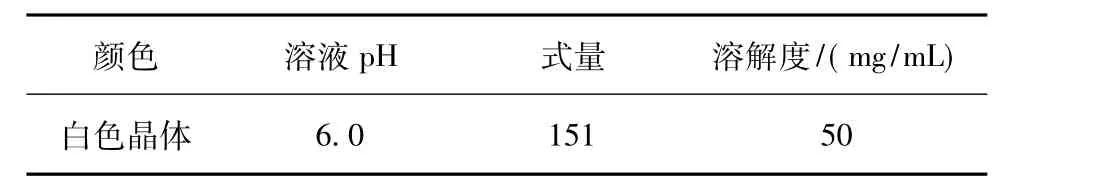
表1 金刚烷胺基本物化性质Table 1 Physical and chemical properties of amantadine
1.2 试验方法
取30 mL浓度为5000 mg/L金刚烷胺废水于反应器中,依次加入硫酸亚铁和过氧化氢溶液后,用去离子水定容至300 mL,废水 pH采用4 mol/L NaOH与2 mol/L H2SO4调节,并用pH计测定。打开磁力搅拌器开关,定时取样分析测定。
1.3 分析方法
由于模拟废水中的有机物成分为金刚烷胺,而金刚烷胺的测试鲜有标准方法可供使用[17-18],因此选择用CODCr的变化来反映金刚烷胺浓度的变化。在测试水样的CODCr和BOD5前,先调节水样的pH到7,再采用0.45μm滤纸过滤水样中的沉淀,取上清液用于CODCr和BOD5分析。CODCr的测试采用标准方法[19],BOD5采用OxiTop BOD分析仪进行分析,测试原理与标准法一致。通过BOD5/CODCr(B/C)反映废水的可生化性。
中间产物的分析采用GC-MS方法。
水样的前处理采用固相萃取方法:1)对固相萃取柱进行活化(5 mL二氯甲烷+5 mL甲醇+5 mL纯水)。2)富集(过0.45μm膜的100 mL水样过柱)。3)洗脱(C18柱,正己烷∶二氯甲烷为7∶3;HCB柱,二氯甲烷∶甲醇为9∶1)。4)脱水(过无水硫酸钠)。5)旋蒸、氮吹定容至1 mL,待GC-MS分析。
GC-MS仪器条件。气相色谱仪:载气为高纯氦气,不分流进样1μL;进样口温度280℃;检测器温度290℃。采用Fullscan模式。初始柱温50℃,稳定2 min,程序升温50~290℃ (6℃/min),恒温15 min。质谱条件:EI离子源;离子源温度230℃;四极杆温度150℃;EI电压70 eV;扫描范围35~500 u。
2 结果与分析
2.1 H2 O2与Fe2+质量比的影响
选择H2O2溶液的投加量为3000 mg/L,改变Fe2+的投加量,研究H2O2与Fe2+质量比对CODCr去除率的影响,结果如图2所示。由图2可以看出,在H2O2与Fe2+质量比小于1.28时,随着比值的增大金刚烷胺废水的CODCr去除率逐渐增大,当H2O2与Fe2+质量比为1.28时,金刚烷胺废水的CODCr去除率达到最大值,约为55%,之后继续增大H2O2与Fe2+质量比,金刚烷胺废水的CODCr去除率反而减小,这说明H2O2与Fe2+质量比对羟基自由基的产生有重要的影响。当H2O2与Fe2+质量比小于1.28时,Fe2+投加量相对过高,反应启动时 Fe2+便与H2O2产生大量羟基自由基,部分羟基自由基未来得及与有机物反应便发生了副反应:Fe2++·OH→Fe3++OH-,导致羟基自由基利用率下降,同时浪费了催化剂Fe2+;而当H2O2与Fe2+质量比高于1.28时,相当于减少了Fe2+投加量,不利于反应产生羟基自由基,而且过少的羟基自由基影响了反应的进行。因此反应存在一个最佳的H2O2与Fe2+质量比,当H2O2与Fe2+质量比为1.28时,Fenton试剂氧化金刚烷胺废水的处理效果最好,因此试验选定H2O2与Fe2+质量比为1.28。

图2 H2 O2与Fe2+质量比对金刚烷胺废水的CODCr去除率的影响Fig.2 The effect of H2 O2/Fe2+on the CODCr removal efficiency of amantadine wastewater
2.2 反应时间的影响
选择 H2O2与 Fe2+质量比为1.28,设定 H2O2投加量为2000 mg/L,研究反应时间的变化对金刚烷胺废水CODCr去除率的影响,结果如图3所示。
从图3可以看出,在氧化反应开始的15 min内,金刚烷胺废水的CODCr降低到200 mg/L左右,15 min后,反应速度明显减慢。这说明由于Fenton试剂的氧化作用较强,在15 min的时间内完成了从破坏金刚烷胺稳定的环状结构到产生小分子有机物的氧化过程。因此选择反应时间为15 min。废水的B/C随反应时间的增加而升高,反应15 min后,金刚烷胺废水的B/C增加到0.1以上。
2.3 初始pH的影响
选择H2O2与Fe2+质量比为1.28,H2O2投加量为3000 mg/L,反应时间为15 min,调节反应体系的初始pH,研究金刚烷胺废水的CODCr随pH的变化,结果如图4所示。


当废水的初始pH为4时,金刚烷胺废水的CODCr下降较快。这主要是因为羟基自由基是Fenton反应关键因素。当pH低于4时,酸性环境使H2O2稳定性增强而不利于羟基自由基的产生;且反应体系中的H+与产生的羟基自由基反应生成水:H++·OH→H2O,消耗了羟基自由基,羟基自由基的不足使金刚烷胺的去除率较低。当pH高于4时,受过高的pH的影响,H2O2分解速度过快,导致废水中没有充足的羟基自由基氧化有机物[20],同时高pH也易使反应体系中的Fe2+生成Fe(OH)+胶体或Fe2O3无定形沉淀,导致反应体系的催化性能下降,产生的羟基自由基不足以完全氧化有机物。因此试验的最佳pH选择为4。
2.4 H2 O2投加量的影响
固定 H2O2与 Fe2+质量比为1.28,研究 H2O2的投加量对CODCr变化的影响,结果如图5所示。
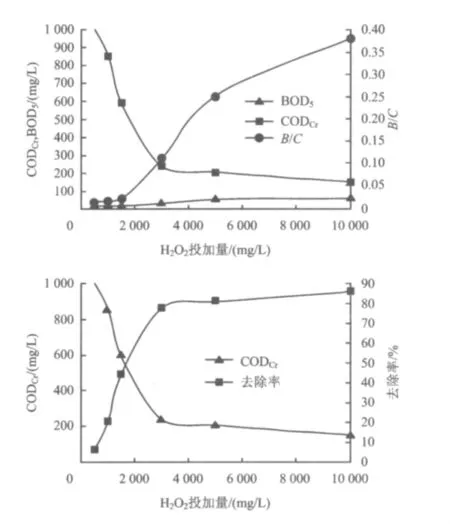
图5 H2 O2投加量对金刚烷胺废水CODCr去除率和B/C的影响Fig.5 The effect of H2 O2 on the CODCr removal efficiency and the B/C of amantadine wastewater
由图5可知,反应开始时模拟金刚烷胺废水CODCr随着 H2O2投加量的增加而不断降低,当H2O2投加量大于3000 mg/L时,尽管增加了H2O2投加量,金刚烷胺废水CODCr的降低不明显。这主要是因为当H2O2投加量低于3000 mg/L时,羟基自由基随H2O2投加量的增加而增加,这时金刚烷胺废水的CODCr随H2O2的投加量增加明显下降;当H2O2投加量高于3000 mg/L时,由于H2O2浓度较高,导致副反应·OH+H2O2→H2O+HO2·产生的HO2·进一步发生 HO2·+·OH→H2O+O2反应,从而消耗羟基自由基,使得CODCr去除率缓慢增加[21];H2O2投加量过高导致氧化反应的速率降低的另一个原因在于Fenton试剂中的Fe2+被过剩的H2O2氧化成Fe3+,降低了催化剂Fe2+的含量而影响氧化反应进行。由图5可知,H2O2投加量在3000 mg/L时,CODCr的去除率接近最大值,而增加H2O2投加量仅使CODCr的去除率少量增加,从经济性考虑,选择H2O2投加量为3000 mg/L。
2.5 Fenton试剂氧化金刚烷胺废水中间产物分析
在pH为4,H2O2投加量为3000 mg/L,H2O2与Fe2+质量比为1.28的条件下,测定不同反应时间下Fenton试剂氧化金刚烷胺废水后的中间产物。图6是在不同反应时间下Fenton氧化金刚烷胺的GC-MS总离子流图。
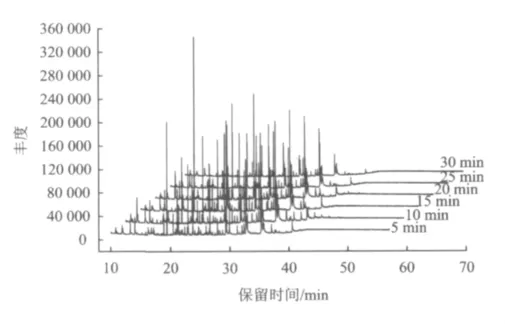
图6 不同反应时间条件下Fenton氧化金刚烷胺的GC-MS总离子流图Fig.6 The TIC profile of amantadine degradation by Fenton reaction over time
从图6可以得出,反应5 min后,金刚烷胺即发生明显降解,中间产物中没有检出金刚烷胺。5~20 min,检出的主要中间产物数保持在10种左右,但中间产物的种类随时间而改变。反应至30 min,总离子流图中仅有4个较明显的峰存在,其余中间产物均已基本完全降解。
3 结论
(1)金刚烷胺废水可以被Fenton试剂氧化,且金刚烷胺废水的CODCr去除率可达30%~80%。
(2)当金刚烷胺废水浓度为500 mg/L时,Fenton试剂氧化金刚烷胺废水的最佳反应条件:pH为4,H2O2投加量为3000 mg/L,H2O2与 Fe2+的质量比为1.28。
(3)在最佳反应条件下,Fenton试剂氧化金刚烷胺废水的反应进行到15 min时,废水的CODCr的去除率可达到80%以上,反应后废水的B/C可提高到0.1以上。
(4)在Fenton试剂的作用下,金刚烷胺得到有效降解,在最佳反应条件下,反应5 min后反应体系中没有检出金刚烷胺。
[1]刘丹,范子宸,张瑛,等.金刚烷胺及其结构类似物的研究进展[J].中国药师,2009,12:1640-1644.
[2] 互动百科:金刚烷胺[EB/OL].[2011-05-07].http://www.hudong.com/wiki/%E9%87%91%E5%88%9A%E7%83%B7%E8%83%BA.
[3]葛孝忠,应黄慧,陈晓,等.金刚烷类药物的研究进展[J].中国医药工业杂志,2003(11):49-52.
[4]邹倩,傅金祥,姜浩,等.芬顿氧化法处理含金刚烷胺废水[J].能源与环境,2010(2):60-61.
[5]伏广龙,徐国想.芬顿试剂在废水处理中的应用[J].环境科学与管理,2006,31(8):133-135.
[6]邹倩,傅金祥,姜浩.结晶法处理金刚烷胺废水[J].辽宁化工,2009,38(12):861-862.
[7]马强.Fenton试剂在处理难降解工业有机废水中的应用[J].工业用水与废水,2008,39(1):27-30.
[8]USTUN G E,SOLMAZ S K A,MORSUNBUL T,et al.Advanced oxidation and mineralization of 3-indolebutyric acid(IBA)by Fenton and Fenton-like processes[J].J Hazard Materi,2010,180(1/2/3):508-513.
[9]赵启文,刘岩.芬顿(Fenton)试剂的历史与应用[J].化学世界,2005,16(5):319-320.
[10]高建平,王建中,杨建涛,等.Fenton氧化-混凝联合处理橡胶废水研究[J].环境研究与监测,2009,22(1):19-23.
[11]张天永.光催化合成萘酚的研究[D].天津:天津大学,2009.
[12]豆子波.Fenton及类Fenton试剂深度处理制药废水的效能研究[D].哈尔滨:哈尔滨工业大学,2009.
[13]王方园,叶群峰,郭婷,等.Fenton-UASB-A/O工艺处理医药化工中间体生产废水实例[J].给水排水,2010,36(4):64-66.
[14]Annual subject index[J].International Journal of Rock Mechanics and Mining Sciences & Geomechanics Abstracts,1996,33:B1-B62.
[15]ROZAS O,CONTRERAS D,MONDACA M A,etal.Experimental design of Fenton and photo-Fenton reactions for the treatment of ampicillin solutions[J].J Hazard Materi,2010,177(1/2/3):1025-1030.
[16]刘英艳,刘勇弟.Fenton氧化法的类型及特点[J].净水技术,2005,24(3):51-54.
[17]武洁,王大为,何志强.LC-MS/MS法测定人血浆中的金刚烷胺浓度及其药动学[J].中国临床药学杂志,2008(2):109-111.
[18]张轶华,韩学静,冯砚明.非水电位滴定法测定盐酸金刚烷胺的含量[J].中国药事,2010,24(10):1008-1009.
[19]国家环境保护总局.水和废水监测分析方法[M].4版.北京:中国环境科学出版社,2002.
[20]HADDOU M,FLORENCE B M,MAURETTE M T,et al.Oxidative degradation of2,4-dihydroxybenzoic acid by the Fenton and photo-Fenton processes:kinetics,mechanisms,and evidence for the substitution of H2O2by O2[J].Helvetica Chimica Acta,2010,93:1067-1800.
[21]田依林,李明玉,马同森,等.Fenton试剂氧化水中芳香族化合物的机理[J].污染防治技术,2003,16(1):12-15. ▷

