活性氧在七氟烷致人口腔鳞状细胞癌凋亡中的作用研究
赵晨璐,高银亮,张国庆
活性氧在七氟烷致人口腔鳞状细胞癌凋亡中的作用研究
赵晨璐,高银亮,张国庆
463000 河南省驻马店市中心医院麻醉科
研究七氟烷在人口腔鳞状癌细胞中的抗癌作用及其潜在的分子机制。
MTT 实验表明七氟烷能够抑制多种人口腔鳞状癌细胞的增殖,并且通过降低线粒体膜电位,调节人口腔鳞状癌细胞中 Bcl-2 家族、caspase-3 和 PARP 蛋白的表达,最终诱导细胞凋亡。七氟烷还促进了人口腔鳞状癌细胞中活性氧的积累,并上调 JNK、p53 蛋白的磷酸化表达水平,激活 JNK/p53 信号通路。然而,在加入 NAC 之后,不但细胞凋亡情况被抑制,JNK/p53 信号通路的激活也被显著逆转。
七氟烷通过调节活性氧水平来激活人口腔鳞状癌细胞中的 JNK/p53 信号通路从而诱导细胞凋亡,因此七氟烷有成为治疗人口腔鳞状癌的备选药物的潜力。
活性氧; JNK 丝裂原活化蛋白激酶类; 肿瘤抑制蛋白 p53; 细胞凋亡; 原代口腔鳞状细胞癌细胞; 七氟烷
口腔鳞状细胞癌(oral squamous cell carcinoma,OSCC)指发生于口腔内,以鳞状细胞为主的恶性肿瘤,常发生于牙龈、硬腭、颊黏膜、嘴唇等多器官,在所有恶性肿瘤的发病率中占 2% ~ 4%,属于头颈部恶性程度最高、危害性最大的肿瘤[1-3]。目前,口腔鳞状细胞癌虽然在治疗方法上取得了很大进展,但是发病率和病死率仍然居高不下,5 年存活率小于 50%,严重威胁人类的生命健康,寻找低毒有效的抗癌药物来治疗口腔鳞状细胞癌具有十分重要的意义[4]。
七氟烷为无色透明、无刺激性的挥发性液体,是一种吸入性麻醉药,能够迅速、平稳地进行麻醉诱导和维持,已经被广泛应用于多种恶性肿瘤的手术治疗[5]。近年来,越来越多的研究表明手术中吸入性麻醉药的选择不仅仅对麻醉本身产生影响,而且对肿瘤细胞的生物学行为也有影响,继而影响恶性肿瘤的复发及预后[6]。有研究表明,七氟烷能够促进乳腺癌 MCF-7 细胞和胶质瘤干细胞的增殖[7];但是七氟烷能够在体外抑制人结肠癌细胞株Caco-2 和 SW-620 的增殖,并通过下调细胞周期调节蛋白的表达使细胞阻滞在 G2/M 期,从而抑制 A549 细胞的增殖[8]。在七氟烷对肿瘤细胞凋亡的影响方面,七氟烷可以抑制乳腺癌细胞的凋亡,促进肺癌细胞和结肠癌细胞的凋亡[9],并且能够明显抑制肺癌、结肠癌的侵袭和迁移[10-11]。综上所述,七氟烷对各类癌症细胞增殖的影响各有不同,且尚未见七氟烷对口腔鳞状细胞癌的报道,因此本文就七氟烷对口腔鳞状细胞癌的增殖、凋亡等生物学行为的影响及其机制进行研究,以期为七氟烷在临床上的应用提供一定的依据。
1 材料与方法
1.1 材料
1.1.1 口腔鳞状细胞癌细胞的获取 原代口腔鳞状细胞癌细胞标本取自河南省驻马店市中心医院收治的 1 例患者,男,52 岁,因“右舌疼痛性肿块”入院接受手术治疗,在知情同意的情况下,获取其手术标本,患者及家属均签署知情同意书,并经河南省驻马店市中心医院伦理部门审核。人口腔鳞状细胞癌 Cal27、Tca8113 细胞系,人胚肺成纤维细胞 IMR-90,人正常肝 QSG-7701 和人正常肾 293T 细胞系购自于中国科学院细胞研究所。
1.1.2 药品与试剂 七氟烷购自日本丸石制药株式会社;5-氟尿嘧啶(5-FU)、二甲基亚砜(DMSO)、DMEM 培养基、RPMI1640 培养基、胎牛血清(FBS)均购自美国 Sigma 公司;噻唑蓝(MTT)购自美国 Amresco 公司;青-链霉素青链双抗(PS)、胰蛋白酶(TE)和磷酸盐缓冲液(PBS)均购自美国 Hyclone 公司;AnnexinV/PI 试剂盒购自北京四正柏生物科技有限公司;α-tubulin、Bad、Bcl-2、caspase-3、PARP、JNK、p-JNK、p38、p-p38 抗体、HRP 标记山羊抗兔 IgG 和 HRP 标记山羊抗鼠 IgG 均购自美国 Santa 公司;2',7'-二氯荧光黄双乙酸盐(DCFH-DA)和 ECL 化学发光试剂均购自君瑞生物技术有限公司;Annexin V-FITC 细胞凋亡检测试剂盒购自上海碧云天生物技术有限公司。
1.2 方法
1.2.1 细胞培养 无菌条件下,取肿瘤标本,去除多余组织,PBS 反复冲洗,剪成 1 ~ 2 mm3小块,间距为 8 mm,平铺于培养瓶底部,倒置于37 ℃、5% CO2的培养箱中;静置 3 h 后,换液,正置于 37 ℃、5% CO2的培养箱中培养。当从组织块爬出的细胞长到覆盖瓶底 90% 以上时,按照 1:3 比例传代。细胞生长汇合后弃去培养液,用 PBS 冲洗 2 次,加入 0.25% 胰蛋白酶 1 ml。用酶消化法去除梭形成纤维细胞,随后传代培养。
社会公共资产的载体是在各级民政部门登记注册的社会团体、基金会、社会服务机构的社会组织。社会公共资产与企业国有资产、政府性资产虽然都为社会提供公共产品或准公共产品,都具有“公有”资产形式,但资产属性、管理方式、产权结构等方面并不全然相同。政府性资产以“政府公共资产”冠之更为恰当,它以社会福利最大化和政治、经济制度稳固为主要目标等。社会公共资产以社会服务、社会治理、社会资本增值、满足公民诉求、保障公民利益等为目标,是一种特殊的所有权形式。
人口腔鳞状细胞癌 Tca8113 细胞、人正常肝 QSG-7701 和人正常肾 293T 细胞用含 10% 胎牛血清、100 U/ml 青霉素及 100 μg/ml 链霉素的 RPMI1640 培养液培养;人口腔鳞状细胞癌 Cal27 和人胚肺成纤维细胞IMR-90 细胞用含 10% 胎牛血清、100 U/ml 青霉素及 100 μg/ml 链霉素的 DMEM 培养液培养,在 37 ℃、5% CO2饱和湿度的培养箱中培养。待细胞至对数生长期的时候,按照比例进行传代培养。
1.2.2 MTT 比色法检测七氟烷对口腔鳞状细胞癌细胞增殖的影响 将生长状态良好且处于对数生长期的原代人口腔鳞状细胞癌细胞(GAS)、Cal27 细胞、Tca8113 细胞和人正常肝 QSG-7701 和人正常肾 293T 细胞分别制成细胞数为 1 × 105个/ml 的细胞悬液,并接种至 96 孔板中,10 000 个/孔。处理 24 h 后用 1% FBS 的培养液饥饿 2 ~ 4 h。每孔加入 1 μl 不同浓度(1、3、10、15 及 20 μmol/L)的七氟烷,阳性对照组做同样浓度的处理,以上实验组均设定 8 个复孔并设定一个空白调零孔。加药 24 h 后将 15 μl 0.5% 的 MTT 溶液加入孔中并放入培养箱继续孵育,2 h 后将上清液吸出,加入 DMSO,利用酶标仪在 490 nm 波长下测量吸光度值,实验重复 3 次并计算细胞存活率及 IC50值。七氟烷对各个细胞增殖抑制作用以细胞存活率来进行衡量,计算式如下所示:
增殖抑制率=[1 –(实验组490– 空白调零组490)/(未加药处理组490– 空白调零组490)]× 100%。
1.2.3 Hochest/PI 双染法检测七氟烷对口腔鳞状细胞癌细胞形态的影响 将 5 × 105/ml 的原代口腔鳞状细胞癌细胞悬液 1 ml 接种于 6 孔板中,待细胞贴壁后按不同时间梯度(3、6、12、24 h)倒序加入七氟烷,药物浓度为 IC50值,待处理时间达到后,弃去 6 孔板中的培养液,加入 0.5 ml 的多聚甲醛固定液,固定半小时后,利用 PBS 洗涤,随后加入 1 ml 的 Hoechst 33258 染色液,摇床轻晃,染色 10 min 后;用 PBS 洗涤 2 次,随后在荧光显微镜下检测拍照。
1.2.4 流式细胞术检测七氟烷对口腔鳞状细胞癌细胞凋亡及线粒体膜电位的影响 取对数生长期的原代口腔鳞状细胞癌细胞,以适当密度接种于6 孔板,当细胞密度达 70% 后,按不同时间梯度(3、6、12、24 h)倒序加入七氟烷,药物浓度为 IC50值,待处理时间达到后,弃去 6 孔板中的培养液,分别收集孔中的上清至 Tube 管中,将细胞用不含 EDTA 的 TE 消化并收集到对应的 Tube 管。预冷的 PBS 洗涤 10 min,每管细胞沉淀中加 100 μl 的细胞结合液,充分吹打混匀。每管加 5 μl Annexin V-FITC 和 5 μl PI,室温避光染色 30 min,最后用细胞结合液体将流式管补至 500 ml,随后利用流式细胞仪检测细胞凋亡,并利用 CytExpert 软件进行分析。
进一步检测线粒体膜电位的变化,种板、加药、处理及收集步骤同上,PBS 重悬细胞后,室温下避光放置 5 min,随后将 JC-1 加入管中使其终浓度为 0.5 μmol/L。随后避光染色 0.5 h,随后用 PBS 洗 1 次,并用 PBS 进行重悬至 500 μl,立即上流式细胞仪检测 ΔΨm 的变化情况。利用 CytExpert 软件进行,当 ΔΨm 较高时,JC-1 聚集在线粒体基质中,形成聚合物,产生红色荧光。当 ΔΨm 较低时,JC-1 为单体,产生绿色荧光。
1.2.5 流式细胞术检测七氟烷对口腔鳞状细胞癌细胞内活性氧水平及凋亡的影响 用 IC50值为终浓度的七氟烷分别处理细胞 3、6、12 和 24 h 后,将细胞收集到 Tube 管中,离心并弃去上清,加 PBS 重悬并洗涤一次,随后将 5 μl 的 DCFH-DA加入重悬液中,放入 37 ℃恒温水浴锅,避光孵育 0.5 h,离心后用 PBS 重悬洗涤一次,最后用 500 μl PBS 重悬细胞,并转移至流式管后流式细胞仪检测细胞内活性氧水平。
进一步检测加入 N-乙酰半胱氨酸(NAC)之后七氟烷对口腔鳞状细胞癌细胞凋亡变化情况,将生长状态良好的 AGS 细胞以 1 × 105/孔的密度接种至 6 孔板培养 1 d 后。终浓度为 5 mmol/L 的 NAC 预处理 0.5 h 后,用 IC50值为终浓度的橙皮苷处理 AGS 细胞。24 h 后收集细胞并经过 PBS 清洗后,按照 Annexin V-FITC 细胞凋亡检测试剂盒的操作方法,分别加入 Annexin V-FITC 结合液,Annexin V-FITC 和 PI,常温黑暗环境下孵育15 min 后,将 300 μl PBS 加入其中,随后转移至流式管利用流式细胞仪检测细胞凋亡率。
1.2.6 Western blot 检测蛋白变化情况 取对数生长期的原代口腔鳞状细胞癌细胞,以适当密度接种于 6 孔板,当细胞密度达 70% 后,按不同时间梯度(3、6、12、24 h)倒序加入七氟烷,药物浓度为 IC50值,待达到处理时间后,弃去 6 孔板中的培养液,分别收集孔中的上清至 Tube 管中,将细胞用不含 EDTA 的 TE 消化并收集到对应的Tube 管。将含有蛋白酶抑制剂的裂解液加入 Tube 管中,冰上裂解 30 min,冷冻离心机 12 000 r/min 离心 30 min,取上清,利用考马斯亮蓝法和分光光度计对蛋白进行定量分析,随后取 20 μl 总蛋白进行 SDS-PAGE,随后转移至硝酸纤维素膜上,随后用脱脂奶粉的封闭液室温封闭 2 h,加入对应的一抗 4 ℃孵育过夜;次日用 TBST 洗 5 次,5 min/次,二抗室温孵育 2 h,TBST 洗 5 次,5 min/次。利用 ECL 显色液在化学发光图像分析系统中曝光成像。Image J 软件分析条带的灰度值,以目的蛋白和内参蛋白条带灰度值之比表示目的蛋白的相对表达水平。
1.3 统计学处理

Figure 1 Inhibition of sevoflurane on proliferation of human oral squamous cell carcinoma cells and normal cells (A: Killing effect of sevoflurane and 5-FU on three oral squamous cell carcinoma cells; B: Killing effect of sevoflurane and 5-FU on three normal cells;*< 0.05,**< 0.01,***< 0.001, compared with control group; n = 3)
2 结果
2.1 七氟烷对人口腔鳞状细胞癌细胞的增殖抑制作用
用不同浓度(1、3、10、15、20 μmol/L)的七氟烷和 5-FU(阳性对照组)分别处理原代口腔鳞状细胞癌细胞、Tca8113 及 Cal27 细胞 24 h 后,进行 MTT 实验。如图 1A 所示,随着七氟烷药物浓度的逐渐增加,四种口腔鳞状细胞癌细胞存活率明显降低并呈明显的浓度依赖性。七氟烷与阳性对照组 5-FU 相比对三种人口腔鳞状细胞癌细胞的增殖抑制作用更明显,具有显著性差异(< 0.05)。经计算,七氟烷对三种人口腔鳞状细胞癌细胞的 IC50值分别为 8.23 ± 0.9、13.56 ± 2.9 和 12.87 ± 2.5 μmol/L。如图 1B 所示,在对三种人正常细胞的 MTT 检测中,同浓度的七氟烷较 5-FU 对正常细胞的杀伤作用小。

图 2 七氟烷对原代口腔鳞状细胞癌细胞形态的影响
Figure 2 Effect of sevoflurane on cell morphology of human oral squamous cell carcinoma cells
2.2 七氟烷对原代口腔鳞状细胞癌细胞形态的影响
用终浓度为 8 μmol/L 的七氟烷和 5-FU 处理细胞 0、3、6、12 和 24 h 后,通过 Hochest/PI 双染法对细胞进行染色处理,并在荧光显微镜下观察细胞荧光强度及明场条件下的细胞形态变化。从图 2 中可以看出明场条件下,未经七氟烷处理的细胞大小均一,形态规则,细胞边缘光滑平整,单层生长,贴壁状态良好,但是随着七氟烷处理时间的不断增加,细胞边缘逐渐皱缩,细胞体积变小,细胞核体积增大,颗粒感增强,悬浮细胞增多,出现细胞凋亡的形态,其中处理时间 24 h 最为明显。在荧光条件下,细胞的红色荧光强度随着七氟烷的处理时间逐渐增强;另一方面,与阳性对照药物 5-FU 相比,七氟烷对原代口腔鳞状细胞癌细胞凋亡形态出现变化的时间更早。
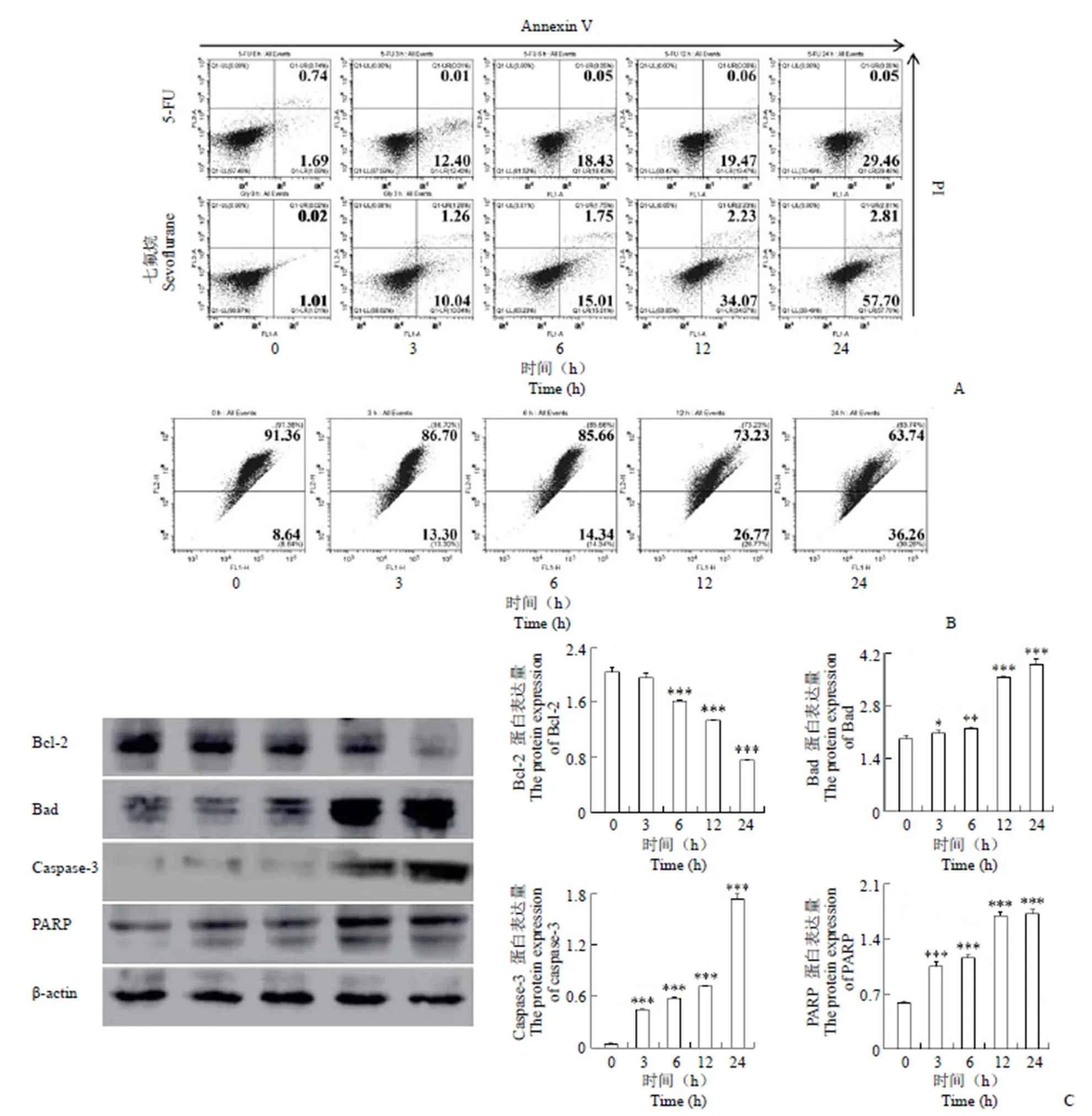
图 3 七氟烷通过线粒体依赖性途径诱导人口腔鳞状细胞癌细胞凋亡(A:流式细胞术检测细胞凋亡率;B:流式细胞术检测线粒体膜电位变化情况;C:Western blot 检测凋亡相关蛋白的变化;*P < 0.05,**P < 0.01,***P < 0.001,以0 h 为对照组;n = 3)
Figure 3 Sevoflurane induces apoptosis in human oral squamous cell carcinoma cells via a mitochondial-dependent pathway(A: Flow cytometry to detect apoptosis rate; B: Detection of mitochondrial membrane potential changes by flow cytometry; C: Western blot analysis of changes in apoptosis-related proteins;*< 0.05,**< 0.01,***< 0.001, compared with control group; n = 3)
2.3 七氟烷通过线粒体依赖性途径诱导原代口腔鳞状细胞癌凋亡
如图 3A 所示,七氟烷可显著提高凋亡细胞百分比,细胞凋亡率由(1.03 ± 0.14)% 提高到(60.51 ± 3.28)%,另外,JC-1 用于检测线粒体膜电位的变化。如图 3B 所示,随着七氟烷处理时间的增加,细胞的线粒体膜电位相应降低。随后检测了线粒体凋亡相关蛋白的表达。如图 3C 所示,七氟烷导致 Bad、cle-caspase-3 和 cle-PARP 蛋白的表达水平增加,Bcl-2 蛋白表达水平降低。
2.4 JNK/p53 信号通路参与七氟烷诱导的原代口腔鳞状细胞癌细胞凋亡
如图 4A 所示,七氟烷处理后 p-JNK 的表达水平下调。相反,p-p53 的表达水平上调。此外,为了进一步证实 JNK 和 STAT3 途径与七氟烷诱导的细胞凋亡的关系,我们用 12 μmol/L JNK 抑制剂SP600125 预处理细胞 30 min,然后用 6 μmol/L七氟烷处理细胞 24 h。如图 4B 所示,用 JNK 抑制剂处理后,p-p53 和 caspase-3 的表达水平受到抑制。这些结果表明,JNK 信号通路处在 p53 信号通路的上游,并调节 p53 信号通路,并与七氟烷诱导的细胞凋亡密切相关。
2.5 七氟烷调节原代口腔鳞状细胞癌中的活性氧水平来诱导细胞凋亡
如图 5A 和 5B 所示,七氟烷处理原代口腔鳞状细胞癌细胞后活性氧的水平显著增加,并且用 NAC 预处理引起七氟烷诱导的原代口腔鳞状细胞癌细胞凋亡被明显抑制。此外,细胞凋亡相关蛋白进一步测试验证活性氧在七氟烷诱导的细胞凋亡中的作用。如图 5C 所示,加入 NAC 后显著逆转了 p-JNK、p-p53 蛋白表达水平,同时降低了 cle-caspase-3 和 cle-PAPR 的表达水平,升高了Bcl-2 的表达水平。这些结果表明活性氧的产生参与了七氟烷诱导的原代口腔鳞状细胞癌细胞凋亡。
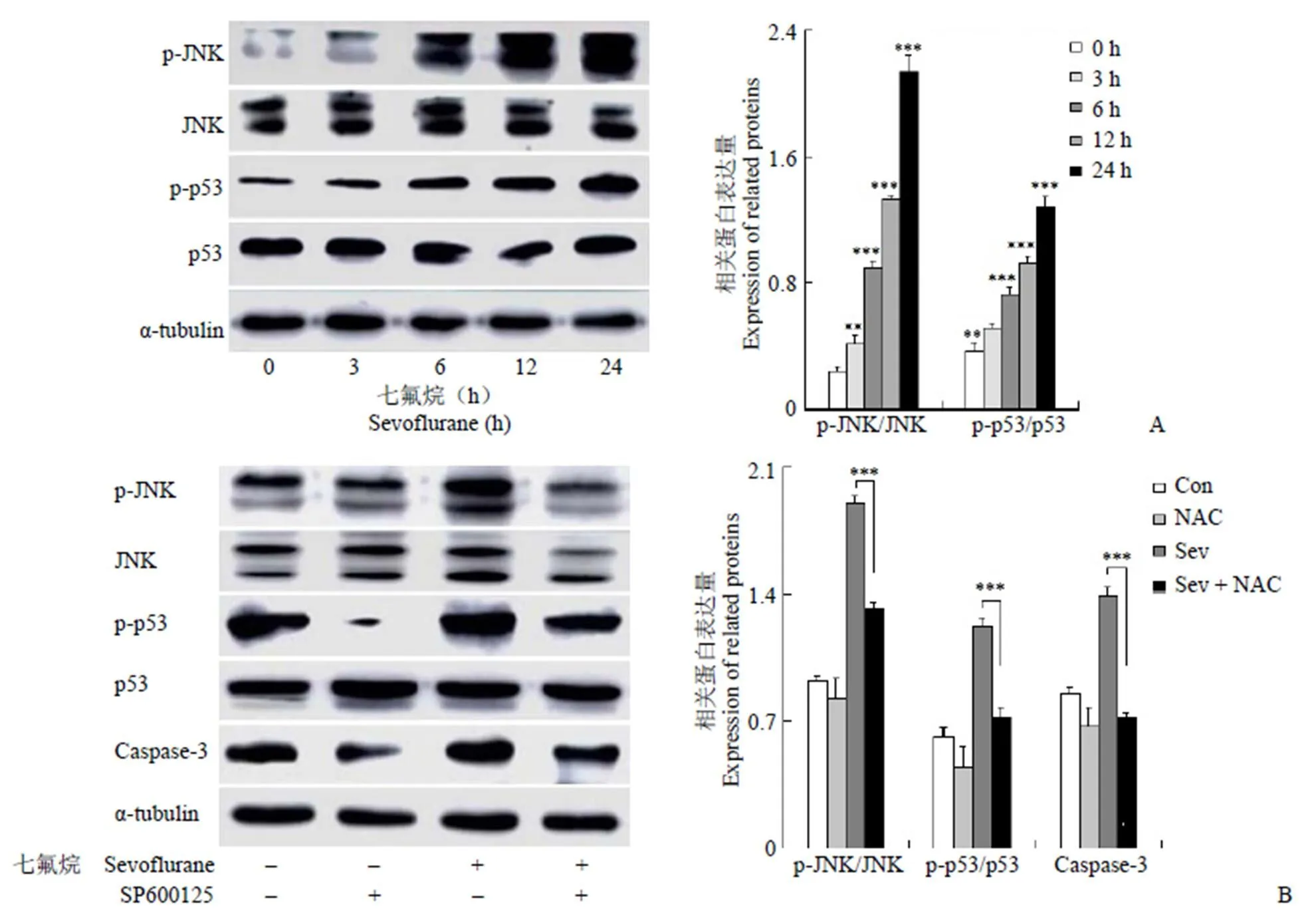
图4 JNK/p53 信号通路参与七氟烷诱导的人口腔鳞状细胞癌细胞凋亡(A:Western blot 检测 JNK/p53 信号通路相关蛋白的变化;B:Western blot 检测 JNK 和 p53 信号通路的关系;**P < 0.01,***P < 0.001,以 0 h 为对照组;n = 3)
Figure 4 JNK/p53 signaling pathway is involved in sevoflurane-induced apoptosis in human oral squamous cell carcinoma cells (A: Western blot analysis of changes in JNK/p53 signaling pathway-associated proteins; B: Western blot analysis of the relationship between JNK and p53 signaling pathway;**< 0.01,***< 0.001, compared with control group; n = 3)
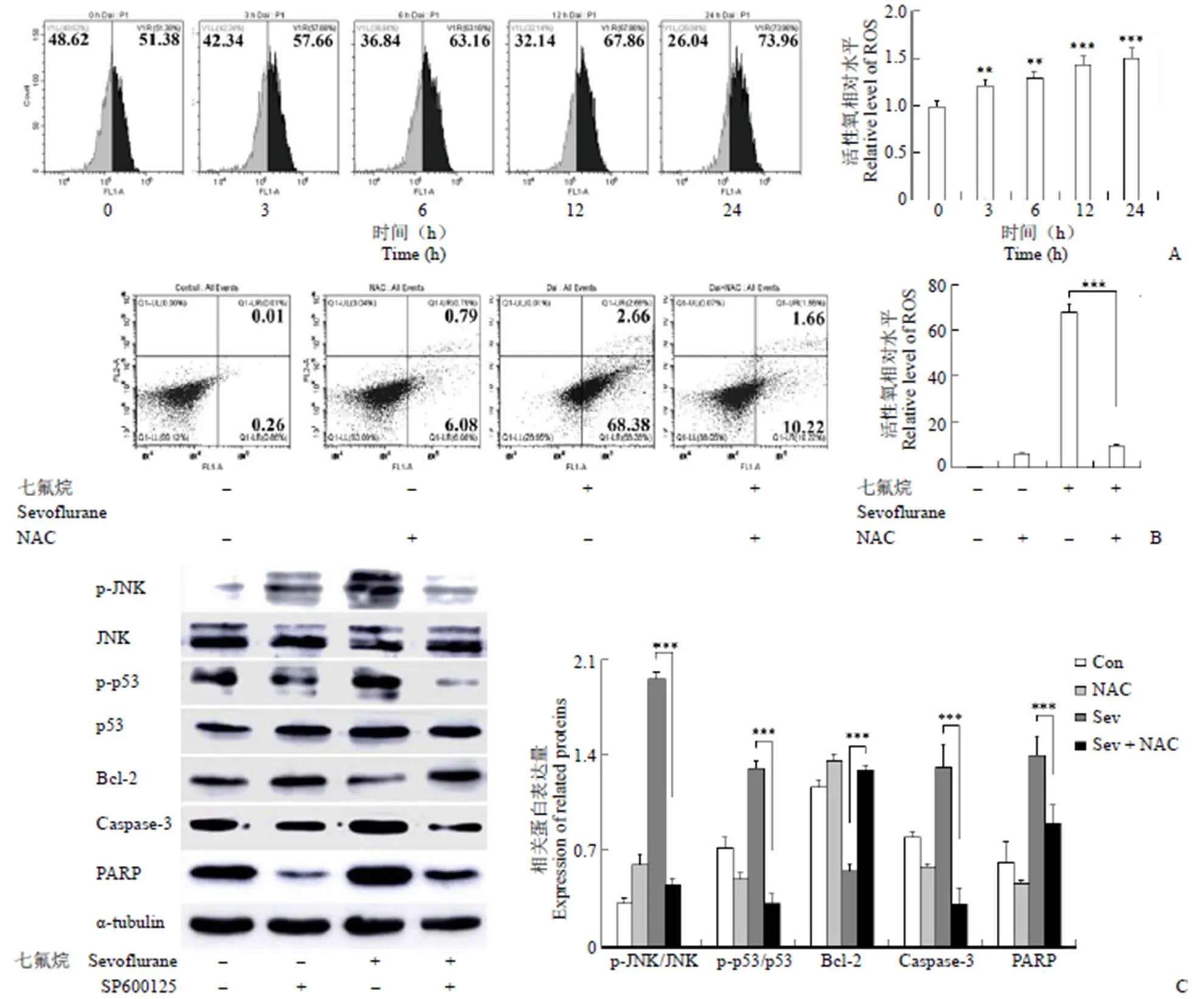
图 5 七氟烷调节人口腔鳞状细胞癌中的活性氧水平来诱导凋亡(A:流式细胞术检测细胞中活性氧水平变化情况;B:流式细胞术检测 NAC 对细胞凋亡的影响;C:Western blot 检测活性氧对 JNK/p53 信号通路的调控作用;**P < 0.01,***P < 0.001,以 0 h 为对照组;n = 3)
Figure 5 Sevoflurane regulates ROS levels in human oral squamous cell carcinoma cell to induce apoptosis (A: Flow cytometry to detect changes in reactive oxygen species in cells; B: Flow cytometry to detect the effect of NAC on apoptosis; C: Western blot analysis of the regulation of reactive oxygen species on JNK/p53 signaling pathway;**< 0.01,***< 0.001, compared with control group; n = 3)
3 讨论
目前的癌症治疗是以化疗为主,手术治疗及放射治疗为辅的多手段协同治疗,其中化疗药物的选择就成了癌症治疗的核心要素[12]。七氟烷因其丰富的生物活性和药理活性而备受关注,七氟烷在临床上被广泛应用于全身麻醉及手术麻醉,是最接近理想的吸入麻醉药[7]。有研究表明,七氟烷具有抑制多种癌细胞增殖的能力,但是目前没有报道过七氟烷对人口腔鳞状癌细胞是否具有作用,因此本实验中选取了人口腔鳞状细胞癌进行了研究。结果表明七氟烷显著抑制三种人口腔鳞状癌细胞的增殖,对人胚肺成纤维细胞 IMR-90、人正常肝 QSG-7701 和人正常肾 293T 细胞的杀伤作用小于 5-FU。为了进一步证实抑制人口腔鳞状癌发展的潜在分子机制,选取原代口腔鳞状细胞癌细胞进行了细胞凋亡、信号通路及活性氧水平检测。
细胞凋亡是人体抑制肿瘤发展的最重要途径之一。因此,通过细胞凋亡来抑制癌细胞的增殖迁移等能力是开发抗癌药物的必要条件[13]。细胞凋亡由内在线粒体途径和外源死亡受体途径激活。Bcl-2 家族是线粒体依赖性凋亡途径的关键调节因子,包括 Bad 和 Bcl-2 等蛋白分子。一些研究表明,当细胞内动态平衡略有变化时,这些 Bcl-2 家族蛋白可能抑制或促进癌细胞凋亡[14]。众所周知,caspase-3 作为细胞凋亡过程的执行者,主要引起线粒体介导的细胞凋亡或破坏线粒体膜电位。有研究报道七氟烷能够依赖于Bcl-2/Bax 调节的通路和激活裂解的 caspase-3 和 PARP 来诱导宫颈癌细胞凋亡[15]。同样,我们目前的数据表明七氟烷可以通过增加 Bad、cleaved-caspase-3 和 cleaved-PARP 的表达,同时降低 Bcl-2 的表达,从而诱导原代口腔鳞状细胞癌细胞线粒体膜电位降低并导致细胞凋亡。因此,七氟烷对人口腔鳞状癌细胞增殖抑制作用可能是通过调节线粒体凋亡途径来实现的。
JNK 信号通路能够参与各种类型癌症的细胞增殖、存活和凋亡,并已被公认为癌症治疗的潜在分子靶点,磷酸化的 JNK 能够诱导细胞周期停滞和细胞凋亡来调节各种癌症中的肿瘤发展[16];p53 是一种肿瘤调节基因,能够促进癌细胞发生细胞凋亡,在所有恶性肿瘤中,大部分都会出现 p53 基因的突变,有学者认为 p53 还可直接刺激线粒体释放高毒性的氧自由基来引发凋亡[17]。因此在诱导凋亡中检测磷酸化的 JNK 和磷酸化的 p53 的变化是非常有必要的。并且有研究指出,JNK 信号通路能够调控 p53 信号通路,磷酸化的 JNK 能够激活 p-p53 的表达,进而诱导细胞凋亡的发生。在本实验中,我们发现,随着七氟烷加药时间的增加,p-JNK 和 p-p53 的表达量升高,说明七氟烷激活了原代口腔鳞状细胞癌细胞中的 JNK 和 p53 信号通路。随后我们进一步检测了两者之间的关系,加入 JNK 信号通路抑制剂SP600125 之后,我们发现 p-p53 的表达被抑制,说明 JNK 信号通路激活 p53 信号通路进而诱导细胞凋亡的发生。
越来越多的报道表明,活性氧的产生在诱导癌细胞凋亡中起着至关重要的作用,活性氧诱导的细胞凋亡参与多种癌症的发生和发展。另外,研究表明,许多化学治疗剂通过促进各种肿瘤细胞中的活性氧生成来诱导细胞凋亡[18]。本研究的结果表明,七氟烷处理显著增加了原代口腔鳞状细胞癌细胞中的活性氧积累。随后,为了研究活性氧是否参与七氟烷诱导的细胞凋亡,我们用活性氧清除剂 NAC 预处理细胞后加入七氟烷,数据表明加入 NAC 后明显逆转了七氟烷诱导的细胞凋亡,并且在蛋白水平上抑制了 cle-caspase3 和 cle-PAPR 的表达升高,抑制了 Bcl-2 表达水平的降低。此外,之前的研究表明,各种应激刺激,如活性氧引起的氧化应激,可能导致 JNK 通路的激活;另一方面,活性氧与抗癌药物诱导的细胞凋亡有关,可能是通过调节 p53 信号通路来实现的。最近的一项研究表明活性氧产生诱导细胞凋亡并激活口腔鳞癌细胞中的 JNK 和 p53 信号通路。为了验证七氟烷诱导的活性氧水平升高在口腔鳞癌细胞中是否调节了 JNK 和 p53 信号通路,我们通过 Western blot 实验检测了加入活性氧清除剂之后 JNK 和 p53 磷酸化表达量变化情况,从实验结果中可以看出,NAC 和七氟烷共同处理组的 p-JNK 和 p-p53 的表达量较七氟烷单独处理组降低,说明 NAC 在清除了细胞中的活性氧之后又抑制了 JNK/p53 信号通路的激活,说明活性氧在七氟烷诱导的凋亡中处在最上游,调控 JNK/p53 信号通路。
在本研究中,证明了七氟烷诱导口腔鳞癌细胞凋亡的分子机制,即七氟烷促进活性氧的产生并进一步介导 JNK/p53 信号通路的激活,提供了七氟烷可作为治疗人类口腔鳞癌的潜在治疗剂的证据。
[1] Jiang S, Dong Y. Human papillomavirus and oral squamous cell carcinoma: a review of HPV-positive oral squamous cell carcinoma and possible strategies for future. Curr Probl Cancer, 2017, 41(5): 323-327.
[2] Imani R, Seyedmajidi M, Ghasemi N, et al. HLA-G expression is associated with an unfavorable prognosis of oral squamous cell carcinoma. Asian Pac J Cancer Prev, 2018, 19(9):2527-2533.
[3] De Paz D, Kao HK, Huang Y, et al. Prognostic stratification of patients with advanced oral cavity squamous cell carcinoma. Curr Oncol Rep, 2017, 19(10):65.
[4] Umstattd LA, Mills JC, Critchlow WA, et al. Shrinkage in oral squamous cell carcinoma: an analysis of tumor and margin measurements in vivo, post-resection, and post-formalin fixation. Am J Otolaryngol, 2017, 38(6):660-662.
[5] Liang H, Yang CX, Zhang B, et al. Sevoflurane suppresses hypoxia-induced growth and metastasis of lung cancer cells via inhibiting hypoxia-inducible factor-1α. J Anesth, 2015, 29(6):821-830.
[6] Wang L, Wang T, Gu JQ, et al. Volatile anesthetic sevoflurane suppresses lung cancer cells and miRNA interference in lung cancer cells. Onco Targets Ther, 2018, 11:5689-5693.
[7] Tian Y, Guo S, Guo Y, et al. Anesthetic propofol attenuates apoptosis, Aβ accumulation, and inflammation induced by sevoflurane through NF-κB pathway in human neuroglioma cells. Cell Mol Neurobiol, 2015, 35(6):891-898.
[8] Wei GH, Zhang J, Liao DQ, et al. The common anesthetic, sevoflurane, induces apoptosis in A549 lung alveolar epithelial cells. Mol Med Rep, 2014, 9(1):197-203.
[9] Xu YJ, Li SY, Cheng Q, et al. Effects of anaesthesia on proliferation, invasion and apoptosis of LoVo colon cancer cells in vitro. Anaesthesia, 2016, 71(2):147-154.
[10] Liang H, Gu MN, Yang CX, et al. Sevoflurane inhibits proliferation,induces apoptosis, and blocks cell cycle progression of lung carcinoma cells. Asian Pac J Cancer Prev, 2011, 12(12):3415-3420.
[11] Iwasaki M, Zhao H, Jaffer T, et al. Volatile anaesthetics enhance the metastasis related cellular signalling including CXCR2 of ovarian cancer cells. Oncotarget, 2016, 7(18):26042-26056.
[12] Qi F, Zhao L, Zhou A, et al. The advantages of using traditional Chinese medicine as an adjunctive therapy in the whole course of cancer treatment instead of only terminal stage of cancer. Biosci Trends, 2015, 9(1):16-34.
[13] Yuan Z, Wu SM, Wang YJ, et al. UC-MSCs affects apoptosis and proliferation of human lung adenocarcinoma A549 cells via PI3K/AKT signaling pathway. Chin J Cancer Biother, 2019, 26(3): 260-265. (in Chinese)
袁哲, 吴思梦, 王亚君, 等. UC-MSC经PI3K/AKT信号通路影响人肺腺癌A549 细胞的凋亡和增殖. 中国肿瘤生物治疗杂志, 2019, 26(3):260-265.
[14] Edlich F. BCL-2 proteins and apoptosis: Recent insights and unknowns. Biochem Biophys Res Commun, 2018, 500(1):26-34.
[15] Sanchis EG, Cristofolini AL, Fiorimanti MR, et al. Apoptosis and cell proliferation in porcine placental vascularization. Anim Reprod Sci, 2017, 184:20-28.
[16] Sui X, Kong N, Ye L, et al. p38 and JNK MAPK pathways control the balance of apoptosis and autophagy in response to chemotherapeutic agents. Cancer Lett, 2014, 344(2):174-179.
[17] Wawryk-Gawda E, Chylińska-Wrzos P, Lis-Sochocka M, et al. P53 protein in proliferation, repair and apoptosis of cells. Protoplasma, 2014, 251(3):525-533.
[18] Diwanji N, Bergmann A. An unexpected friend-ROS in apoptosis-induced compensatory proliferation: Implications for regeneration and cancer. Semin Cell Dev Biol, 2018, 80:74-82.
The role of reactive oxygen species in the apoptosis of human oral squamous cell carcinoma cells induced by sevoflurane
ZHAO Chen-lu, GAO Yin-liang, ZHANG Guo-qing
Author Affiliation: Anesthesiology Department, Zhumadian Central Hospital, Henan 463000, China
Sevoflurane is a commonly used anesthetic drug in clinical practice. It has a variety of pharmacological activities and can inhibit the proliferation of various cancer cells, but its effect on human oral squamous cell carcinoma is still unclear. In this study, we studied the anticancer effect of sevoflurane in human oral squamous cell carcinoma and its underlying molecular mechanism.
MTT colorimetric assay was used to detect the inhibitory effect of sevoflurane on human oral squamous cell carcinoma. Hochest/PI double staining and flow cytometry were used to detect the apoptosis of human oral squamous cell carcinoma cells induced by sevoflurane, the level of reactive oxygen species and apoptosis after the addition of reactive oxygen scavenger NAC. Western blot experiments were used to detect related proteins.
Sevoflurane inhibited the proliferation of human oral squamous cell carcinoma cells and regulated the expression of Bcl-2 family, caspase-3 and PARP proteins in the cells by decreasing mitochondrial membrane potential, and eventually induced apoptosis. Sevoflurane also promoted the accumulation of ROS in human oral squamous cell carcinoma cells, up-regulated the levels of JNK and p53 phosphorylation, and activated the JNK/p53 signaling pathway. However, after the addition of the ROS scavenger NAC, not only the apoptosis was inhibited, but the activation of the JNK/p53 signaling pathway was also significantly reversed.
Sevoflurane activates JNK/p53 signaling pathway in human oral squamous cell carcinoma cells by the increment of ROS levels and the induction of apoptosis. Therefore, sevoflurane can be potentially used as a treatment for human oral squamous cell carcinoma.
Reactive oxygen species; JNK mitogeu-activiater protein kinases; Tumor suppressor protein p53; Apoptosis; Primary oral squamous cell carcinoma cell; Sevoflurane
ZHANG Guo-qing, Email: zgq396650@sina.com
10.3969/j.issn.1673-713X.2019.05.006
张国庆,Email:zgq396650@sina.com
2019-06-17

