寻常型银屑病皮损中Notch1表达及对体外培养HaCaT细胞的影响
苏华振,魏明
寻常型银屑病皮损中Notch1表达及对体外培养HaCaT细胞的影响
苏华振,魏明
450052郑州大学第五附属医院药学部
研究 Notch1 在寻常型银屑病皮损中的表达及对体外培养永生化人皮肤角质形成细胞(HaCaT)增殖、凋亡的影响,探究其可能存在的发生机制。
收集 30 例寻常型银屑病患者病患处的皮肤组织和 30 名健康人的皮肤组织,应用逆转录聚合酶链式反应(RT-PCR)和蛋白印迹技术(Western)测定皮肤组织 Notch1、Jagged1 mRNA 和蛋白表达量;将HaCaT 细胞随机分为激活剂组(2 μg/ml Jagged1-Fc 融合蛋白)、抑制剂组(20 μmol/L DAPT)和空白对照组,体外培养。用细胞计数(CCK-8)法检测 HaCaT 细胞增殖,用流式细胞术测定人 HaCaT 细胞的凋亡情况,用 Western 印迹技术检测HaCaT 细胞内凋亡蛋白(Bcl-2、Bax)、involucrin、keratin1 蛋白表达。
寻常型银屑病病人病患处的表皮组织中 Jagged1、Notch1 mRNA 及蛋白表达量均高于健康人皮肤组织(值分别为 4.26、4.78 和 5.12、4.23,值均< 0.05)。激活剂组、抑制剂组和空白对照组 HaCaT 细胞增殖抑制率在 24、48 和72 h 中差异具有统计学意义(值分别为 123.45、219.67 和 289.16,值均< 0.05)。激活剂组(5.31% ± 1.21%)、抑制剂组(26.33% ± 3.57%)和空白对照组(13.17% ± 2.18%)HaCaT 细胞的凋亡率差异有统计学意义(= 13.96,< 0.05)。激活剂组、抑制剂组与空白对照组 HaCaT 细胞 Bax和 Bcl-2 蛋白表达分别为(1.28 ± 0.15、0.43 ± 0.08、0.71 ± 0.12)和(0.22 ± 0.08、1.05 ± 0.14、0.53 ± 0.09),差异具有统计学意义(值分别为 9.45 和 10.23,值均< 0.05)。较空白对照组相比,激活剂组involucrin 和keratin1 表达的蛋白量明显降低(值均< 0.05);抑制剂组 involucrin 及keratin1 表达的蛋白量明显升高(值均< 0.05)。
Notch 信号转导通路的激活可能是寻常型银屑病的起病因素之一,而 Notch 信号转导通路使角质形成细胞增殖加快、使其凋亡和分化受到抑制是其可能存在的作用机制。
寻常型,银屑病; 细胞增殖; 角质形成细胞; 细胞凋亡; Notch 信号通路
作为一种慢性的常见炎症性皮肤病,银屑病的病理生理特性大致为形成角质层的细胞过量增殖,从而致使表皮中能够自然死亡的角质层形成细胞分化错误,同时伴有皮肤的炎性包裹及异常血管的产生等[1-2]。银屑病发病过程长、难以完全治愈并极易再次发病[3]。当前并没有明确的论证可以说明银屑病的起病原由和机制,但遗传和环境是大家普遍认同的致病因素[4]。Notch 信号转导通路是由 Notch 受体(Notch1-4)、Notch 配体(Jagged1、2 和Delta、3、4)和 DNA 结合的蛋白 CSL 组成。Notch 受体中其中一个重要配体即为 Jagged1。当它与 Notch 受体结合后激活 Notch 信号转导通路,细胞外基质金属蛋白酶将 Notch 的胞外段进行切割,而 Notch 的胞内段也会被 γ-分泌酶复合体识别并进行酶切,释放出 Notch 蛋白胞内片段(NICD),NICD 可以转位到细胞核内与转录因子 CBF1、Suppressor of hairless、Lag-2(CSL)家族形成复合物,结合到特定 DNA 序列上,促使 CSL 蛋白由转录抑制状态转换为转录激活状态[5]。当前相当多的实验主要基于银屑病的发生中 Notch 信号转导通路和相应的免疫功能发挥的作用[6]。约占皮层细胞总数 80%的角质层形成细胞是表皮的重要组成细胞,许多炎性皮肤性疾病以及皮肤相关肿瘤的产生与其增殖、分化和凋亡均异常相关[7]。人 HaCaT 细胞主要来源于成年人皮层中分离出来的人类永生化角质形成细胞系,它具有传代特征稳定,增殖和分化特征与角质层形成细胞近似等特点。因此,在科学实验中大多被拿来代替角质层形成细胞[8]。此实验探究了 Notch 信号转导通路的关键性因素在寻常型银屑病患者患病处皮肤中的表达情况以及对人类 HaCaT 细胞正常生理功能的影响,探究在寻常型银屑病的发生过程中 Notch 信号转导通路可能发挥的作用。
1 材料与方法
1.1 材料
1.1.1 皮肤部位标本来源 选取看诊于郑州大学第五附属医院寻常型银屑病病患的皮肤组织标本 30 例,标本都经皮肤组织病理学检查并确诊。其中男性 20 例、女性 10 例,年龄 18 ~ 67(32.8 ± 7.1)岁。其入选标准:皮肤病患处近 2 周没有外涂抹任何药物,最近 1 个月内没有接受任何免疫抑制性或其他种类药物的治疗。排除标准:年龄小于 18 岁或大于 67 岁;伴发有皮肤性肿瘤及另外增生性的皮肤病;有肝、肾、心脑血管及血液系统等较为严重的原发性或继发性疾病以及另外情况不方便取材的患者。选择本院同时期整形外科和泌尿外科手术切除多余的健康人的皮肤组织 30 例,其中男性 19 例、女性 11 例,年龄 18 ~ 67(32.6 ± 6.9)岁。两组年龄、性别相比差异无统计学意义(> 0.05)。两部分皮肤组织中皮下的脂肪和皮下的结缔组织被刮除后,放于液氮中冷冻,–80 ℃的冰箱中放置保存。
1.1.2 细胞、试剂和仪器 人类永生化角质形成细胞系:HaCaT 细胞株由中国科学院细胞库保存。特异性 Notch 信号通路激活剂(Jagged1-Fc 融合蛋白)和特异性 Notch 信号通路抑制剂(DAPT)购自美国 R&D System公司;Trizol、逆转录实验试剂盒购自日本 Takara 公司;Jagged1、Notch1、B 淋巴细胞瘤/白血病-2(Bcl-2)、Bcl-2 相关 X 蛋白(Bax)、角蛋白 1(keratin1)和重组人外皮蛋白(involucrin)单克隆抗体购自美国Abcam 公司;辣根过氧化物标记的二抗购自北京中杉金桥生物技术有限公司;DMEM 培养基、100 μg/ml 藻红蛋白(PE)、Annexin-V-FITC、β-肌动蛋白(β-actin)和4',6-二脒基-2-苯基吲哚(DAPI)染色液均购自美国 Sigma 公司;CCK-8 实验试剂盒购自普洛麦格北京生物技术有限公司;二喹啉甲酸(BCA)蛋白定量试剂盒、胎儿牛血清(FBS)购自杭州四季青生物工程材料研究所。免疫荧光一抗为小鼠抗人 NICD 单克隆抗体,购自美国Uscnlife 公司;二抗四甲基异硫氰酸(FITC)标记的山羊抗小鼠IgG购自北京博奥森生物技术有限公司;TCS-SP5 型激光共聚焦扫描显微镜为德国 Leica 公司产品;RT-PCR 仪为瑞士 Roche 公司产品;流式细胞仪为美国 BD 公司产品。
1.2 方法
1.2.1 免疫组织化学法检测皮肤组织 Notch1 和 Jagged1 表达 用预冷 4% 多聚甲醛灌注固定,石蜡包埋,脱蜡,3% H2O2封闭其内源性的过氧化物酶,于抗原热修复之后用山羊血清对其封闭 30 min,滴加兔抗 Notch1 多克隆抗体(1:500),Jagged1 多克隆抗体(1:200),磷酸盐缓冲液(PBS)设为阴性对照替代一抗。37℃温育 1 h,4 ℃孵育一夜。用加液枪滴加 Envision 二抗(酶标羊抗鼠),每张切片滴加 50 μl,在 25 ℃下放于孵育盒内孵育 30 min。再用 PBS 液洗涤 3 次,频率为3 min/次。DAB 室温呈色后将切片浸入清水中,终止 DAB 显色,苏木素再染 4 min 后以清水再次冲洗 2 min,然后予以 1%的酒精盐酸分化处理 5 s,清水洗 15 min,碳酸锂返蓝,再次冲洗 5 min。75%、85%、95%、100%酒精梯度脱水各5 min,二甲苯透明,中性树胶封片。每个标本于光镜 100 倍镜下观察 5 个视野,显色为棕黄色或棕褐色的细胞即为阳性细胞。
1.2.2 细胞的培养及处理 取出人 HaCaT 细胞的冰冻储存管,放于 37 ℃的恒温水浴箱里融化,等冰冻的细胞完全融化后,把细胞转移至 5 ml 的灭菌收集管中,注入 3 ml 含 10% FBS 的 DMEM 培养液用来稀释冻存液中的 DMSO,1000 r/min 离心 5 min,除去上清液。再加入新鲜的营养液不断吸打洗涤细胞,最后将其接种到细胞培养皿中,置于 5% CO2培养箱中 37 ℃恒温培养。细胞进行贴壁之后换掉培养液,除去漂浮的死亡细胞,之后定期更换培养液,等细胞达到 80%以上的融合强度时,将其置于0.25% 的胰酶中分离并收集细胞,并按照 1:3 的比例对其传代培育,之后取处于对数生长期的细胞,除去细胞营养液,再用 PBS 液洗涤 2 次,0.25%的胰酶分离消化,细胞独立存活时停止消化,最后离心再次收集活细胞。用培养液不断吹打然后计数,使其浓度达到 1 × 105个/ml,接种到被紫外线杀菌的 96 孔板中,每孔 200 μl,放于 5%的 CO2培养箱中37 ℃恒温培养 24 h 后,除去营养液,将人 HaCaT 细胞随机划分为激活剂组(加入含 2 μg/ml Jagged1-Fc 融合蛋白+ DMEM 高糖培养基),抑制剂组(加入含20 μmol/LDAPT + DMEM 高糖培养基),空白对照组仅加 DMEM 高糖培养基,再按实验要求进行培养。
1.2.3 RT-PCR 技术测定皮肤组织 Notch1 和 Jagged1 mRNA 表达 用 Trizol 法提取皮肤组织的总 RNA,琼脂糖凝胶电泳测定总 RNA 的质量,紫外分光光度计测定总 RNA 的浓度;用 Prime ScriptTMRT Reagent kit 逆转录试剂盒,把 RNA进行逆转录制成 cDNA,用 RT-PCR 试剂盒来检测。根据 GenBank 数据库中公布的 Notch1 和 Jagged1 mRNA 序列,用 Primer5.0 软件设计 RT-PCR 引物,交由上海派森诺生物科技有限公司合成。目的基因 Notch1 的上游引物:5' GTCAACG CCGTAGATGACCT 3',下游引物:5' CAGGTTGTA CTCGTCCAGCA 3',扩增片段 396 bp;Jagged1 上游引物:5' GTCCCACTGGTTTCTCTGGA 3',下游引物:5' CCACAGACGTTGGAGGAAAT 3',扩增片段 285 bp;β-actin 上游引物:5' TGACGTGGAC ATCCGCAAAG 3',下游引物:5' CTGGAAGGTGG ACAGCGAGG 3',扩增片段 210 bp。RT-PCR 体系 25 μl,扩增条件:95 ℃预变性 5 min,95 ℃变性 30 s,60 ℃退火 30 s,72 ℃延伸 30 s,经 35 个循环。将 PCR 扩增的产物应用到琼脂糖凝胶电泳后,成像系统扫描进行拍照,再测定各条电泳带的灰度值,计算其与 β-actin 的比值,进而得到目标产物的含量。
1.2.4 Western 印迹法检测皮肤组织 Notch1、Jagged1 蛋白及 HaCaT 细胞内 Bax、Bcl-2、involucrin、keratin1 蛋白表达 在含有蛋白酶抑制剂的裂解液中加入剪碎的皮肤组织,用匀浆机搅拌均匀,离心后取其上清液。与 loading buffer 按体积 2:1 混匀,95 ℃水浴 5 min,取变性的蛋白样品,备用。
取 1.2.2 中分组 HaCaT 细胞,培养 48 h,用0.25% 的胰酶分离、消化细胞,提取HaCaT 细胞中的总蛋白。用 BCA 法测定蛋白浓度,分别取上述蛋白 80 μg,用湿转法将蛋白从SDS-PAGE 胶上转移到聚偏二氟乙烯膜(PVDF)上,转膜2 h。转入后的PVDF 膜放入 5%的脱脂奶粉中进行封闭,在室温下摇床 45 min。一抗(兔抗鼠 Notch1抗体1:800、Jagged1 抗体 1:400、Bcl-2 抗体 1:1000、Bax 抗体 1:1000、keratin1 抗体 1:400、involucrin 抗体 1:400),4 ℃过夜。用含 5%的脱脂奶粉洗涤液将膜条洗涤 3 次,每次 5 min,二抗孵育(羊抗兔 IgG 抗体1:1000,马抗小鼠 IgG抗体1:500),2 h,BCIP/NBT 显色。再通过凝胶成像系统显影,经由Image J V1.36 软件分析条带的灰度,β-actin 条带作为内参照。目的蛋白的相对表达量 = 目的蛋白的灰度值/ β-actin 的灰度值。
1.2.5 CCK-8 法检测 HaCaT 细胞增殖 取 1.2.2 中分组 HaCaT 细胞,置于 5%含量的 CO2培养箱中、37 ℃恒温培养,每组设置 5 个复孔,分别培养 24、48、72 h 后终止培养,弃去原培养基,将无双抗、无血清 DMEM 培养液与 CCK-8 试剂按 10:1 比例均匀混合,每孔中加入 100 μl,在培养箱中温育 2 h,用酶标仪测出 450 nm 的波长中各孔的吸光度值,重复进行实验 3 次,取平均值算出细胞的增殖和抑制率,抑制率=(1 – 处理组吸光度值/ 空白对照组吸光度值)× 100%。
1.2.6 流式细胞术测定 HaCaT 细胞凋亡情况 取 1.2.2 中分组 HaCaT 细胞培养 48 h,丢弃掉培养液,用 PBS 将细胞洗涤 2 次,加入 0.25%的胰蛋白酶用以分离、集中细胞,调整为1 × 105个/ml。取细胞悬液 1 ml 加入 1.5 ml 离心管中,1200 r/min离心 5 min,弃去上清液。于沉淀中加入binding buffer 200 μl,混和均匀后分别加入 5 μl 的 PI 和5 μl 的 Annexin V-FITC,25 ℃避光孵育 20 min,再向其中加入 binding buffer400 μl,流式细胞仪测定人 HaCaT 细胞的凋亡状况,计算凋亡率。
1.2.7 细胞免疫荧光检测 NICD 的表达 于6 孔培养板加入 HaCaT 细胞约 104个/孔,24 h 后改为含 0.5% 胎牛血清的高糖 DMEM 饥饿培养24 h,分为空白对照组(10% 胎牛血清 + DMEM + 100 U/ml 青霉素 + 100 μg/ml 链霉素),激活剂组(10% 胎牛血清 + DMEM + 100 U/ml青霉素 + 100 μg/ml 链霉素 + 2 μg/ml Notch 信号通路特异性激活剂),抑制剂组(10% 胎牛血清 + DMEM + 100 U/ml 青霉素 + 100 μg/ml 链霉素 + 20 μmol/L Notch 信号通路特异性抑制剂)。孔内放置无菌盖玻片(0.8 cm × 0.8 cm),细胞行“爬片”培养72 h,取出盖玻片,PBS 漂洗,4 ℃下用 4%的多聚甲醛固定 20 min,0.3% Triton X-100 室温作用 10 min,加入鼠抗人 NICD 单抗(1:100)4 ℃过夜,另设 PBS 液作为阴性对照替代一抗;PBS 漂洗 3 次后,加FITC 标记-羊抗鼠 IgG(1:40),37 ℃孵育 30 min,PBS 漂洗 3 次,DAPI(1:1000)复染,去离子水漂洗 5 次,95%甘油封片。用于 FITC 的激发波长为 488 nm,用于 DAPI 的激发波长为 405 nm。激光共聚焦显微镜检测。
1.3 统计学处理
2 结果
2.1 皮肤组织Notch1 和Jagged1 的表达
寻常型银屑病患者患病处皮肤组织中,Notch1 主要位于表皮角质形成细胞的胞质中,偶尔也可见细胞膜或细胞核着色,在健康人皮肤组织中,Notch1主要表达于胞核中,胞质中少量表达(图 1A、B)。Jagged1 在寻常型银屑病患者病变处表皮全层可见明显阳性表达,颗粒层、棘层、基底层都可见浓密的棕黄色颗粒,其大部分位于胞质中,胞膜中也可见少许,而胞核中则基本未见。在健康人皮肤组织中,仅在部分表皮及基底层有少量表达(图 1C、D)。
2.2 皮肤组织 Notch1、Jagged1 mRNA 及蛋白的表达
与健康人皮肤组织 Notch1、Jagged1 mRNA 的表达相比较,寻常型银屑病患者皮损组织的表达明显升高(1.00 ± 0.09、1.00 ± 0.11)(3.12 ± 0.23、2.17 ± 0.36),差异具有统计学意义(值分别为 5.12 和 4.23,均< 0.05);Notch1、Jagged1 蛋白表达明显升高(0.67 ± 0.10、0.39 ± 0.12)(1.63 ± 0.25、1.25 ± 0.23),差异具有统计学意义(值分别为4.26 和4.78,均< 0.05)(图 2)。

图 1 Notch1 和 Jagged1 在皮肤组织中的表达(EnVision 法 100 ×)(A:在寻常型银屑病患者皮损组织中 Notch1 主要表达于表皮全层;B:在正常皮肤组织中 Notch1 主要表达于表皮基底层;C:Jagged1 在正常皮肤组织仅在部分表皮及基底层有少量表达;D:Jagged1 在寻常型银屑病患者皮损组织大部分表达于表皮全层,基底层、棘层、颗粒层均可见密集的棕黄色颗粒)
Figure 1 Expressions of Notch1 and Jagged1 in skin tissue (EnVision 100 ×) (A: In skin tissue of patients with psoriasis vulgaris, Notch1 is mainly expressed in the whole epidermis; B: In normal skin tissues, Notch1 is mainly expressed in the basal layer of the epidermis; C: Jagged1 is only expressed in some epidermis and basal layer in normal skin tissues; D: Jagged1 is mostly expressed in the whole epidermis of psoriasis vulgaris, and dense brown-yellow particles can be seen in the basal layer, spinous layer and granular layer)
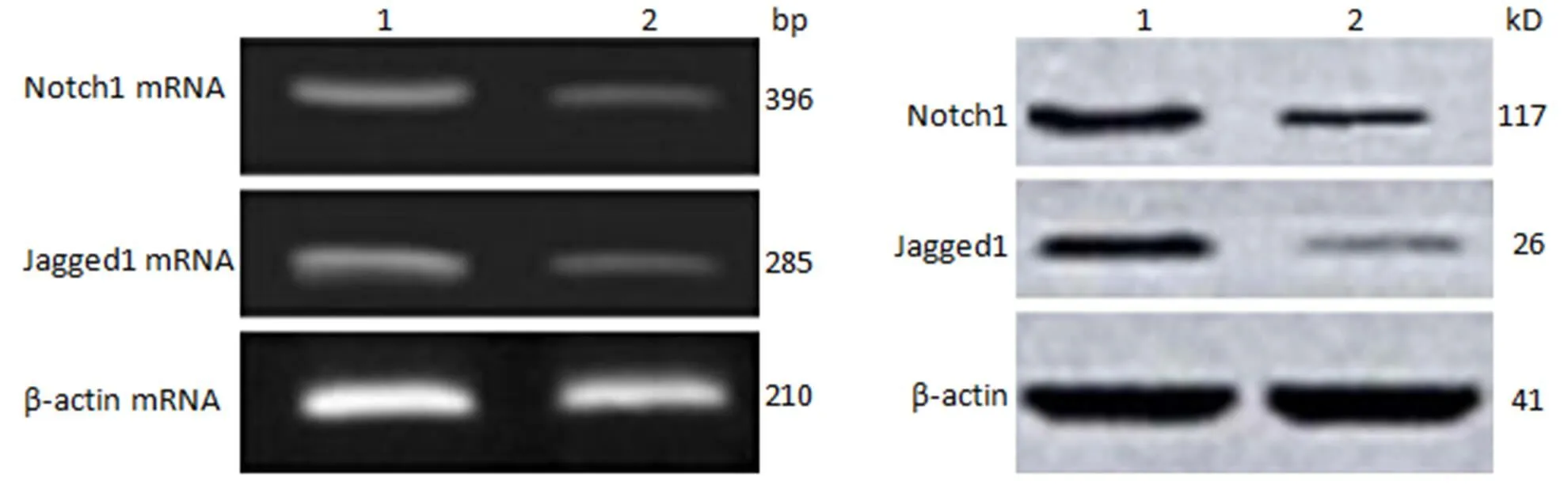
1:寻常型银屑病患者皮损组织;2:健康人皮肤组织
Figure 2 Expression of Notch1 and Jagged1 in skin tissue

表 1 激活剂和抑制剂对 HaCaT 细胞增殖的影响(n = 5,)

图 3 Notch 信号转导通路对人 HaCaT 细胞凋亡的影响
Figure 3 Effect of Notch signal transduction pathway on apoptosis of human HaCaT cells
2.3 Notch1 信号转导通路对HaCaT 细胞的增殖影响
激活剂组、抑制剂组和空白对照组 HaCaT 细胞增殖抑制率在 24、48 和 72 h 差异具有统计学意义(分别为 123.45、219.67 和 289.16,均< 0.05)。与抑制剂组比较,激活剂组 HaCaT 细胞抑制率降低(< 0.05),空白对照组与抑制剂组比较差异有统计学意义(< 0.05)(表 1)。
2.4 Notch 信号转导通路对 HaCaT 细胞凋亡的影响
激活剂组(5.31% ± 1.21%)、抑制剂组(26.33% ± 3.57%)和空白对照组(13.17% ± 2.18%)HaCaT 细胞凋亡率差异有统计学意义(= 13.96,< 0.05)。与空白对照组比较,激活剂组细胞凋亡率减低、抑制剂组升高(LSD-值分别为 5.37 和 3.84,< 0.05)(图 3)。
2.5 Notch 信号转导通路对 HaCaT 细胞凋亡相关蛋白表达的影响
激活剂组、抑制剂组与空白对照组人 HaCaT 细胞 Bcl-2 和 Bax 蛋白表达分别为(1.28 ± 0.15、0.43 ± 0.08、0.71 ± 0.12)和(0.22 ± 0.08、1.05 ± 0.14、0.53 ± 0.09),差异具有统计学意义(值分别为 9.45和 10.23,< 0.05)。较空白对照组相比,激活剂组 Bcl-2 蛋白的表达量升高,Bax 蛋白的表达量降低(LSD-值分别为 3.12 和 4.03,< 0.05);抑制剂组 Bcl-2 蛋白的表达量降低,Bax 蛋白的表达量升高(LSD-值分别为 3.27 和 3.15,< 0.05)(图 4)。

1:激活剂组;2:抑制剂组;3:空白对照组
Figure 4 Expression of apoptosis-related proteins in human HaCaT cells

1:激活剂组;2:抑制剂组;3:空白对照组
Figure 5 Effect of Notch signal transduction pathway on human HaCaT cell differentiation
2.6 Notch 信号转导通路对 HaCaT 细胞分化的影响
激活剂组、抑制剂组和空白对照组 HaCaT 细胞 keratin1 和 involucrin 蛋白表达分别为(0.34 ± 0.08、1.27 ± 0.14、0.55 ± 0.08)和(0.39 ± 0.07、1.07 ± 0.15、0.72 ± 0.13),差异有统计学意义(值分别为 7.68 和 5.89,均< 0.05)。与空白对照组比较,激活剂组 keratin1 和 involucrin 蛋白表达量有所降低(LSD-值分别为3.02 和 3.21,均< 0.05);抑制剂组 keratin1 和 involucrin 蛋白表达量升高(LSD-值分别为 3.26 和 3.07,均< 0.05)(图 5)。
2.7 细胞免疫荧光检测NICD 的荧光表达
细胞免疫荧光显示空白对照组和抑制剂组 NICD 主要表达于细胞膜、细胞质及细胞核,激活剂组 NICD 除主要表达于细胞膜、细胞质外,细胞核表达较空白对照组及抑制剂组明显增强(图 6)。
3 讨论
Notch 信号转导通路在细胞分子间互相接触传递中扮演不可或缺的角色,作用于机体多个组织和器官,可以对细胞的增殖、分化和凋亡等过程起到很大的调控作用[9]。有实验证实多类恶性病变的产生与 Notch 信号转导通路的非正常活动密切相关。刘天舒等[10]研究发现,肺部癌变中干细胞的促进性生长可以通过激活 Notch 信号转导通路得以实现。Notch 信号转导通路的激活能够促使血液系统中造血祖细胞的增殖加快,同时使其分化受到明显抑制[11]。有研究报道,在银屑病患者的外周血 T 细胞中Notch 信号转导通路中的重要分子 HES1,Notch1 和 Notch2 表达量明显增加[12]。Jagged1 作为 Notch 信号转导通路中关键一员,有实验显示其在银屑病患者的表皮中表达量有所增加[6],揭示了在银屑病的发病环节中 Notch 信号转导通路可能发挥了一定的作用。本研究结果提示,Notch1、Jagged1 mRNA 和蛋白表达量明显升高的情况也主要位于寻常型银屑病患者病变部位的皮层组织中,表明了银屑病的发生与 Notch 信号转导通路密切相关,这与其他的研究结果呈一致性[6]。

图 6 激光共聚焦免疫荧光检测(位于细胞膜、细胞质及细胞核的 NICD 被 FITC 染为绿色,位于细胞核的 NICD 被 DAPI 染为蓝色)
Figure 6 Laser confocal immunofluorescence detection(NICD in cell membrane, cytoplasm and nucleus was stained green by FITC, and NICD in nucleus was stained blue by DAPI)
在皮层结构的主要组成细胞中,角质形成细胞是很重要的一部分。作为皮层免疫功能的重要屏障性细胞,它具有极强的增殖和分化能力[13]。正常情况下,角质形成细胞的增生和凋亡相互制约,两者处于动态平衡状态中,共同控制皮层的厚薄程度进而构成皮肤角质层。多类皮肤性病变的产生和发展都与其增殖、分化、凋亡异常有密切关系[14]。目前,寻常型银屑病的发病机制并不完全明确,但是该病的关键点之一即为皮层中角质形成细胞的过量增生及错误分化,也有研究人员认同皮层中角质形成细胞的凋亡减低也和寻常型银屑病的发病相关[15]。此研究用人 HaCaT 细胞作为研究对象,将 Jagged1-Fc 融合蛋白和 DAPT 激活或阻断 Notch 信号转导通路,进行体外培养,HaCaT 细胞增殖和免疫荧光结果显示,Notch 信号转导通路的激活能够促进 HaCaT 细胞进行增殖;Notch 信号转导通路的阻断能够减少 HaCaT 细胞的增生。也有研究通过检测 Notch 下游靶基因 HES1 的表达证明了 Jagged1 可以使 Notch 活化,表明 Notch 信号转导通路可能参与了人 HaCaT 细胞的生长[16-17]。
在经过线粒体途径调节细胞的正常死亡这一过程里,Bcl-2 基因家族发挥了至关重要的作用,Bcl-2 是一种凋亡的抑制性因子[18],而 Bax 作为一种凋亡的促进性因子[19],两者可以结合组成同源或非同源的二聚物,由两者的平衡来调节细胞的凋亡,其中 Bcl-2 蛋白的表达量降低,Bax 蛋白的表达量增加,将会正面推动细胞的凋亡,反之细胞的凋亡情况则会受到抑制[20]。此研究结果提示,Notch 信号转导通路的激活可以使 HaCaT 细胞的凋亡受抑;同时使 Bcl-2 的蛋白表达量较之前有所增加,而 Bax 的蛋白表达量则会降低;同理,Notch 信号转导通路的阻断则可以使 HaCaT 细胞的凋亡得到推进,同时 Bcl-2 的蛋白表达量较之前有所减少,而 Bax 的蛋白表达量则会相应的提升,以上均显示 Bcl-2 和 Bax 在 HaCaT 细胞的凋亡过程中发挥的作用可能与 Notch 信号转导通路的调节有很大关系。
在 HaCaT 细胞分化的标志性蛋白中,表皮颗粒层特异性蛋白 keratin1[21]和棘皮层特异性蛋白 involucrin[22]两者发挥着相当重要的作用。本实验发现,用 Jagged1-Fc 融合蛋白作用于 Notch 信号转导通路,则 keratin1 和 involucrin 蛋白表达可以明显下调;用 DAPT 阻断 Notch 信号转导通路,keratin1 和 involucrin 的表达能够大幅度上调,这表明 HaCaT 细胞分化受抑和 Notch 信号转导通路的激活有关。同时,Notch 信号转导通路的阻断也可以使 HaCaT 细胞的分化程度得到有效提升。
因此,在寻常型银屑病患者皮肤患病处的皮层范围中,Notch 信号转导通路的关键性分子表达明显上调。促使角质形成细胞的增殖、降低其分化和凋亡都与 Notch 信号转导通路的激活密切相关。反之,Notch 信号转导通路的破坏在减少角质形成、细胞的增殖、推进角质形成细胞的分化和凋亡方面发挥重要的作用,因此可能成为银屑病治疗的一种新途径。
[1] Wang DH, Wang Q, Li YP, et al. Expression of telomerase activity and vascular endothelial growth factor expression in psoriasis lesions.J Clin Dermatol, 2015, 44(10):618-619. (in Chinese)
王大虎, 王卿, 李玉平, 等. 银屑病皮损中端粒酶活性、血管内皮生长因子的表达及其相关性分析. 临床皮肤科杂志, 2015, 44(10): 618-619.
[2] Lowes MA, Suárez-Fariñas M, Krueger JG. Immunology of psoriasis. Annu Rev Immunol, 2014, 32:227-255.
[3] Dong SY. The levels of interleukin-17 and interleukin-22 in patients with psoriasis and its correlation with prognosis. Chin J Gerontol, 2016, 36(5):1165-1166. (in Chinese)
董淑英. 寻常性银屑病患者血清白细胞介素-17和-22水平及其与预后的相关性. 中国老年学杂志, 2016, 36(5):1165-1166.
[4] Mustonen A, Mattila K, Leino M, et al. Psoriasis causes significant economic burden to patients. Dermatol Ther (Heidelb), 2014, 4(1): 115-124.
[5] Wang RJ, Liu FZ, Shen WW, et al. Jagged1 promotes osteoclast differentiation and inhibits proliferation by activating of Notch signaling pathway induced. Chin J Immunol, 2014, 30(7):865-869. (in Chinese)
王汝杰, 刘复州, 沈伟伟, 等. Jagged1活化Notch通路促进RAW 264.7向破骨分化但抑制增殖. 中国免疫学杂志, 2014, 30(7):865- 869.
[6] Kong Y, Bai YP. Study of the role of notch family proteins in the pathogenesis of psoriasis. J Clin Dermatol, 2015, 44(3):135-139. (in Chinese)
孔原, 白彦萍. Notch家族蛋白在银屑病发病机制中的作用研究. 临床皮肤科杂志, 2015, 44(3):135-139.
[7] van den Bogaard EH, Tjabringa GS, Joosten I, et al. Crosstalk between keratinocytes and T cells in a 3D microenvironment: a model to study inflammatory skin diseases. J Invest Dermatol, 2014, 134(3): 719-727.
[8] Sun B, Ding R, Yu W, et al. Advanced oxidative protein products induced human keratinocyte apoptosis through the NOX-MAPK pathway. Apoptosis, 2016, 21(7):825-835.
[9] Takebe N, Nguyen D, Yang SX. Targeting notch signaling pathway in cancer: clinical development advances and challenges. Pharmacol Ther, 2014, 141(2):140-149.
[10] Liu TS, Mao ZF, Liu JT, et al. Expression of Notch signaling transduction pathway in lung cancer stem cells. Chin J Exp Surg,2015, 32(1):84-87. (in Chinese)
刘天舒, 毛志福, 刘军韬, 等. Notch信号通路在肺癌干细胞中的表达及其对增殖的影响. 中华实验外科杂志, 2015, 32(1):84-87.
[11] Tian DM, Liang YM, Han H, et al. Effect of endothelial cell-targeted soluble Notch ligand hD1R protein on expansion and engraftment of cord blood hematopoietic stem/progenitor cells. Chin J Hematol, 2014, 35(10):885-890. (in Chinese)
田登梅, 梁英民, 韩骅, 等. 内皮细胞靶向的可溶性Notch配体hD1R 蛋白对脐血造血干/祖细胞增殖和植入的影响. 中华血液学杂志, 2014, 35(10):885-890.
[12] Skarmoutsou E, Trovato C, Granata M, et al. Biological therapy induces expression changes in Notch pathway in psoriasis. Arch Dermatol Res, 2015, 307(10):863-873.
[13] Pasparakis M, Haase I, Nestle FO. Mechanisms regulating skin immunity and inflammation. Nat Rev Immunol, 2014, 14(5):289-301.
[14] Hobbs RP, DePianto DJ, Jacob JT, et al. Keratin-dependent regulation of Aire and gene expression in skin tumor keratinocytes. Nat Genet, 2015, 47(8):933-938.
[15] Chamcheu JC, Pal HC, Siddiqui IA, et al. Prodifferentiation, anti-inflammatory and antiproliferative effects of delphinidin, a dietary anthocyanidin, in a full-thickness three-dimensional reconstituted human skin model of psoriasis. Skin Pharmacol Physiol, 2015, 28(4):177-188.
[16] Ma L, Gao ML, Shu CM, et al. Notch1 signaling pathway regulates Th17 cell differentiation and function in murine psoriasis model. Chin J Immunol, 2017, 33(7):986-990. (in Chinese)
马蕾, 高梅兰, 舒春梅, 等. Notch1信号通路调控银屑病模型小鼠 Th17细胞分化和功能. 中国免疫学杂志, 2017, 33(7):986-990.
[17] Li XH, An P, Li JQ, et al. Expression of genes involved in the Notch signaling pathway in peripheral blood T cells from patients with psoriasis. Chin J Dermatol, 2013, 46(3):188-190. (in Chinese)
李新华, 安鹏, 李俊琴, 等. 银屑病患者外周血T细胞Notch信号通路相关基因表达的研究. 中华皮肤科杂志, 2013, 46(3):188-190.
[18] Yang D, Okamura H, Teramachi J, et al. Histone demethylase Jmjd3 regulates osteoblast apoptosis through targeting anti-apoptotic protein Bcl-2 and pro-apoptotic protein Bim. Biochim BiophysActa, 2016, 1863(4):650-659.
[19] Grosse L, Wurm CA, Brüeser C, et al. Bax assembles into large ring-like structures remodeling the mitochondrial outer membrane in apoptosis. EMBO J, 2016, 35(4):402-413.
[20] Zhao B, He T. Chidamide, a histone deacetylase inhibitor, functions as a tumor inhibitor by modulating the ratio of Bax/Bcl-2 and P21 in pancreatic cancer. Oncol Rep, 2015, 33(1):304-310.
[21] Matsuda M, Hamada T, Numata S, et al. A three-dimensional in vitro culture model of Hailey-Hailey disease. Exp Dermatol, 2015, 24(10):788-789.
[22] Varma SR, Sivaprakasam TO, Mishra A, et al. Imiquimod-induced psoriasis-like inflammation in differentiated Human keratinocytes: Its evaluation using curcumin. Eur J Pharmacol, 2017, 813:33-41.
Expression of Notch1 in skin lesions of patients with psoriasis vulgaris and its effects on the growth of HaCaT cells
SU Hua-zhen, WEI Ming
Author Affiliation: Repartment of Pharmacy, The Fifth Affiliated Hospital of Zhengzhou University, Zhengzhou 450052, China
To investigate the expression of Notch1 in psoriasis vulgaris lesions and its effects on the proliferation of immortalized human keratinocytes (HaCaT), and to explore its possible mechanism.
The skin tissues of 30 patients with psoriasis vulgaris and 30 healthy people were collected. The level of Notch1, Jagged1 mRNA and protein expression in skin tissues was detected by fluorescence quantitative polymerase RT-PCR and Westernblot. HaCaT cells were randomly divided into the activator group (2 μg/ml Notch signal pathway specific activator) and the inhibitor group (20 μmol/L Notch signal pathway specific inhibitor) and the control group. HaCaT cells were cultured for 24, 48, and 72 h. The proliferation of HaCaT cells was detected by tetramethyl azolazolium (MTT) assay. The expression of apoptotic protein Bcl-2, Bax, keratin 1 and involucrin in HaCaT cells was examined by Western blot, and the apoptosis of HaCaT cells was detected by flow cytometry.
The expression of Notch1, Jagged1 mRNA and protein in the lesions of psoriasis vulgaris was higher than that in normal skin (< 0.05).The proliferation rate of HaCaT cells was decreased in the activator group (< 0.05), but it was increased in the inhibitor group. The apoptosis rate of HaCaT cells in the activator group was lower than that in the inhibitor group (< 0.05). Compared with the control group, the expression of Bcl-2 protein in the activator group was increased, but the expression of Bax protein was decreased (< 0.05). In the inhibitor group, the expression of Bcl-2 protein was decreased, but the expression of Bax protein was increased (< 0.05). The expression of keratin1 and involucrin protein in the activator group was lower than that in the control group (< 0.05). The expression of keratin1 and involucrin protein were increased in the inhibitor group (< 0.05).
Activation of the Notch signaling pathway may be one of the onset factors of psoriasis vulgaris, and the Notch signaling pathway accelerates the proliferation of keratinocytes, inhibits their apoptosis and differentiation.
Vulgaris, psoriasis; Proliferation; Veratinocytes; Apoptosis; Notch signal pathway
WEI Ming, Email: gushiweiming@126.com
10.3969/j.issn.1673-713X.2019.05.005
魏明,Email:gushiweiming@126.com
2019-08-01

