链霉菌CPCC 200510产生的大黄酚及其类似物的鉴定
黎林丽,李婷,江冰娅,李书芬,刘红宇,余利岩,何红伟,李玉环,武临专
链霉菌CPCC 200510产生的大黄酚及其类似物的鉴定
黎林丽,李婷,江冰娅,李书芬,刘红宇,余利岩,何红伟,李玉环,武临专
100050 北京,中国医学科学院北京协和医学院医药生物技术研究所卫计委抗生素生物工程重点实验室/中国医学科学院药物合成生物学重点实验室
链霉菌具有丰富次级代谢产物合成能力,对链霉菌CPCC 200510 产生的色素类次级代谢产物进行研究。
对该菌株的次级代谢产物进行乙酸乙酯提取、ODS色谱柱分离、半制备HPLC 分离纯化、NMR 结构解析和生物活性检测。
得到6 个黄色化合物,分别为1,8-二羟基-3-甲基蒽醌(大黄酚,1)、2-乙酰-1,8-二羟基-3-甲基蒽醌(2)、2-乙酰-1,8-二羟基-3-羧甲基蒽醌(3)、1,2,8-三羟基-3-甲基蒽醌(4)、1-(7-乙酰-8-羟基苯并[]色烯-2-基)-2-丙酮(5)和1-(8-羟基-2-甲基苯并[]色烯-7-基)乙酮(6),为一组生物合成相关的芳香聚酮类化合物。其中,1 ~ 3为链霉菌CPCC 200510 产生的主要组分。生物活性测定表明,1 ~ 3具有抗肿瘤细胞或抗病毒活性。
链霉菌CPCC 200510 有望作为大黄酚类化合物的微生物产生菌。
大黄酚; 链霉菌CPCC 200510; 芳香聚酮
芳香聚酮类化合物是一类重要的天然产物,其中由链霉菌产生的四环素和阿霉素等是临床上重要的抗菌和抗肿瘤药物。
链霉菌()CPCC 200510 具有产生丰富的色素类化合物特性。对该菌株产生的脂溶性色素类化合物进行了分离纯化和鉴定,确定为大黄酚(chrysophanol)及其类似物。
1 材料和方法
1.1 材料
酵母提取物和麦芽提取物均为英国 Oxoid 公司产品;高氏 1 号培养基为广州环凯生物科技有限公司产品;乙腈为美国 Fisher 公司产品;乙酸乙酯等有机试剂为国产分析纯试剂;制备型硅胶板为烟台江友硅胶开发有限公司产品;ODS 填料和HPLC 半制备色谱柱 YMC-Pack ODS-A(250 mm × 10 mm,S-5 μm,12 nm)为日本 YMC 公司产品;HPLC 分析色谱柱 Diamonsil C18(4.6 mm × 150 mm,5 μm)为北京迪马科技有限公司产品;EYELAN-1100 型旋转蒸发仪为日本东京理化公司产品;1260 型高效液相色谱仪为美国安捷伦公司产品;LC-20A 型高效液相色谱仪为日本岛津公司产品;LTQ XL 质谱分析仪为美国 Thermo Fisher Scientific 公司产品;AVIII HD核磁共振仪(600 MHz,TMS 为内标)为德国 Bruker 公司产品。大黄酚对照品为合肥博美生物科技有限责任公司产品。
链霉菌 CPCC 200510 由中国药学微生物菌种保藏中心提供;人结肠癌细胞系 HCT116 和单纯疱疹病毒 1 型(HSV-1)由本所肿瘤室和药理室分别保藏并提供。
培养基:ISP2(葡萄糖 4.0 g/L、酵母提取物4.0 g/L、麦芽提取物 10.0 g/L、琼脂粉 15.0 g/L,pH 自然);高氏 1 号培养基(可溶性淀粉 20 g/L、氯化钠 0.5 g/L、硫酸亚铁 0.01 g/L、硝酸钾 1.0 g/L、磷酸氢二钾 0.5 g/L、硫酸镁 0.5 g/L、琼脂粉 15 g/L,pH 7.3)。
1.2 方法
1.2.1 链霉菌CPCC 200510 培养与发酵 将保藏的孢子悬液接种于 ISP2 平板,28 ℃培养 7 ~ 10 d,出现灰色的成熟孢子层,用适量无菌水洗涤并收集,获得新鲜孢子悬液,涂布于高氏 1 号培养基平板,28 ℃发酵培养 10 d,收集发酵培养物,用于分离纯化目标次级代谢产物。
1.2.2 链霉菌CPCC 200510 产生的脂溶性色素类化合物化学分析 发酵培养物用乙酸乙酯等体积提取 3 次;收集黄色的乙酸乙酯提取液,减压浓缩得粗提物。对粗提物进行硅胶板 TLC 分析(展开剂:二氯甲烷:甲醇 = 9:1)和 HPLC 分析(含 0.1% 冰醋酸的 15% ~ 100% 甲醇-水系统梯度洗脱,60 min,流速 1.0 ml/min;检测波长 254 和 430 nm)。
1.2.3 脂溶性色素类化合物的分离纯化 30 L 发酵培养物经乙酸乙酯提取并旋干后得粗提物 12 g,上 ODS 反相柱(长度 460 mm,内径 33 mm),甲醇-水(含 0.1% 冰醋酸)线性梯度洗脱(流速20 ml/min):15% ~ 78% 甲醇洗脱 110 min,78% ~ 100% 甲醇洗脱 90 min,100% 甲醇洗脱 60 min。获得 6 个洗脱合并组分(I ~ VI)。对 6 个组分浓缩后分别进行 HPLC 半制备纯化(等度洗脱,流动相均含 0.1% 冰乙酸,流速 1.5 ~ 2.0 ml/min),得到 6 个黄色化合物纯品(1~6);所使用的流动相分别为:1和2,85% 乙腈-水;3,70% 甲醇-水;4,75% 乙腈-水;5,60% 乙腈-水;6,90% 乙腈-水。1~6纯品用于 NMR 测定,1~3纯品用于生物活性测定。
1.2.4 抗肿瘤细胞活性测定 对主要组分1~3进行抗人结肠癌细胞系HCT116 活性测定。化合物1、2和3用 DMSO 溶解后,用培养液稀释,细胞加药培养 48 h 后,取出培养板,于每孔加入 50 μl 预冷的 50% 三氯醋酸,静置 5 min 后移入4 ℃冰箱中静置 1 h,取出用去离子水洗 5 遍,空气中干燥,待完全干燥后每孔加入 1% 的乙酸配制的 0.4% 的 SRB 100 μl,染色 20 min 后倒掉染液,用 1% 乙酸洗 5 次,去除未结合的染料。空气中干燥后用 pH 10.5 的 10 mmol/L 的非缓冲 Tris 碱液 150 μl 溶解,在平板振荡器上振荡 5 min,在 BioRad 酶标仪上测定各孔在 490 nm 的光吸收,测定对肿瘤细胞系 HCT116 的 IC50值。
1.2.5 抗 HSV-1 活性测定 对主要组分1~2进行抗 HSV-1 活性测定。化合物1~2用 DMSO 溶解后用培养液稀释,以无环鸟苷(ACV)作阳性对照药。Vero 细胞种 96 孔板,24 h 后感染HSV-1 10-4,吸附 2 h,弃病毒液,加入含稀释化合物及阳性对照药的维持液,同时设细胞对照孔和病毒对照孔,待病毒对照组病变程度(CPE)达 4+ 时观察各组细胞病变程度,用 Reed-Muench 法分别计算化合物1~2对 HSV-1 的半数抑制浓度(IC50)。
2 结果
2.1 链霉菌CPCC 200510 产生脂溶性黄色化合物
链霉菌CPCC 200510 的乙酸乙酯提取液呈黄色。硅胶板 TLC 分析出现 2 个黄色条带;HPLC 分析出现 3 个主要洗脱峰,其紫外-可见吸收光谱基本相同(图 1),提示是一组结构类似物。经 LC-MS 分析,确定 3 个主要洗脱峰中的化合物分子量分别为 254、296 和 340。

图 1 链霉菌 CPCC 200510 乙酸乙酯提取物的 TLC(A)和 HPLC(B)分析结果
Figure 1 TLC (A) and HPLC (B) analysis of ethyl acetate extract ofsp. CPCC 200510
2.2 从链霉菌CPCC 200510 中分离得到 6 个黄色化合物
通过乙酸乙酯提取、ODS 色谱柱和 HPLC 半制备分离纯化,从链霉菌CPCC 200510 发酵培养物中分离得到编号1~6的 6 个黄色化合物,分别来自 ODS 柱分离的合并组分 II、IV、V、VI、I 和 III。其中,1~3为链霉菌CPCC 200510 产生的主要组分,4~6为次要组分。采用高氏 1 号培养基,主要组分1、2和3的产量分别约为 22、18 和76 mg/L。
2.3 黄色化合物属于大黄酚及其类似物
化合物1~6经 NMR 解析,确定其均属于文献报道过的芳香聚酮类化合物。
化合物1为黄色粉末,分子量 254,NMR(600 MHz,CDCl3)解析并结合SciFinder 数据库分析,确定其为 1,8-二羟基-3-甲基蒽醌(图 2),分子式 C15H10O4,即大黄酚。核磁数据如下:1H-NMR,(ppm),2.47(s,3H,CH3-3),7.10(s,2H,H-2),7.29(d,1H,= 1.2 Hz,H-7),7.67(t,2H,= 8.4 Hz,H-6),7.82(dd,1H,= 1.2,6.6 Hz,H-5),12.02(s,1H,1-OH),12.13(s,1H,8-OH);13C-NMR,(ppm),193.4(C-9),183.1(C-10),117.0(C-8a),163.5(C-8),150.5(C-3),138.0(C-4a),134.7(C-10a),134.3(C-6),125.6(C-5),125.4(C-7),122.4(C-4),121.0(C-2),163.8(C-1),114.7(C-9a),23.6(CH3-3)。
化合物2为黄色粉末,分子量 296,NMR(600 MHz,CDCl3)解析并结合SciFinder 数据库分析,确定其为 2-乙酰-1,8-二羟基-3-甲基蒽醌(图 2),分子式C17H12O5。核磁数据如下:1H-NMR,(ppm),2.41(s,3H,H-2'),2.62(s,3H,CH3-3),7.31(d,1H,= 1.2 Hz,H-7),7.70(t,1H,= 8.4 Hz,H-6),7.84(d,1H,= 0.6 Hz,H-5),11.95(s,1H,8-OH),12.36(s,1H,1-OH);13C-NMR,(ppm),31.9(C-2'),202.3(C-1'),137.4(C-2),162.6(C-1),114.1(C-9a),192.3(C-9),115.7(C-8a),159.4(C-8),124.9(C-7),133.1(C-10a),122.2(C-5),133.1(C-6),181.4(C-10),136.2(C-4a),120.2(C-4),145.5(C-3),20.2(CH3-3)。
化合物3为黄色粉末,分子量 340,NMR(600 MHz,CDCl3)解析并结合SciFinder 数据库分析,确定其为 2-乙酰-1,8-二羟基-3-羧甲基蒽醌(图 2),分子式C18H12O7。核磁数据如下:1H-NMR,(ppm),2.64(s,3H,H-2'),3.79(s,1H,H-4),3.81(s,2H,H-1''),7.31(d,=6.0 Hz,1H,H-7),7.71(dd,= 6.0,12.0 Hz,1H,H-6),7.80(d,= 6.0 Hz,1H,H-5),11.91(s,1OH,H-1),12.39(s,1OH,H-2'');13C-NMR,δ(ppm),31.28(C-2'),203.61(C-1'),135.88(C-2),159.54(C-1),115.18(C-9a),192.53(C-9),115.68(C-8a),163.34(C-8),124.83(C-7),137.51(C-6),120.09(C-5),133.5(C-10a),181.22(C-10),133.2(C-4a),122.26(C-4),142.01(C-3),38.4(C-1''),171.1(C-2'')。
化合物4为橘黄色粉末,分子量 270,NMR(600 MHz,CDCl3)解析并结合 SciFinder 数据库分析,确定其为 1,2,8-三羟基-3-甲基蒽醌(图 2),分子式C15H10O5,即 2-羟基大黄酚。核磁数据如下:1H-NMR,δ(ppm),2.38(s,3H,3-CH3),7.16(s,1H,H-4),7.29(dd,1H,= 1.2,8.4 Hz,H-7),7.68(t,1H,= 7.8 Hz,H-6),7.88(dd,1H,= 1.2,7.8 Hz,1.5,H-5),12.28(s,1H,2-OH),12.32(s,1H,1-OH),13.48(s,1H,8-OH);13C-NMR,(ppm),157.7(C-2),162.5(C-1),111.6(C-9a),190.4(C-9),116.2(C-8a),157.8(C-8),110.7(C-7),136.8(C-6),119.3(C-5),141.8(C-10a),186.5(C-10),129.0(C-4a),124.5(C-4),133.6(C-3),16.6(3-CH3)。
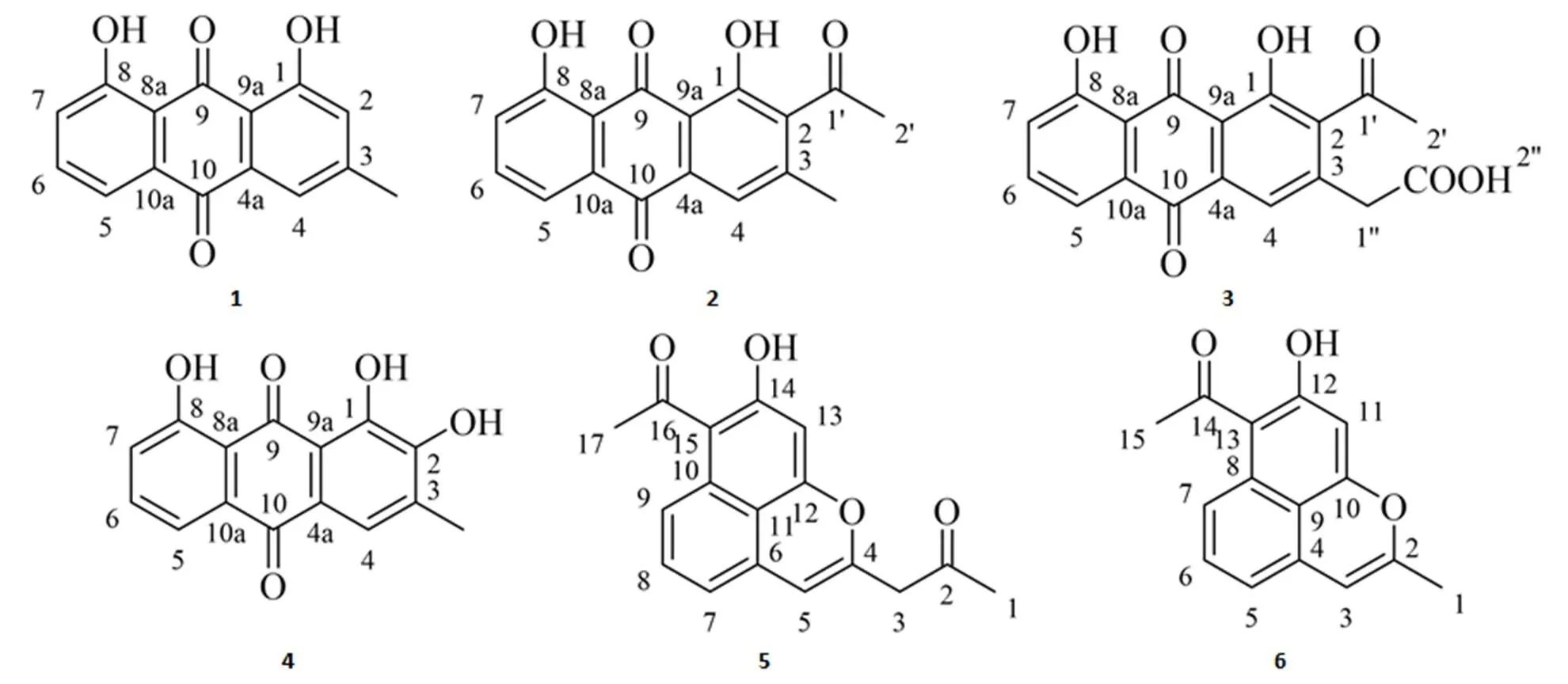
图 2 化合物1 ~ 6化学结构
Figure 2 Chemical structure of 1 - 6
化合物5为淡黄色粉末,分子量为 282,NMR(600 MHz,DMSO-6)解析并结合 SciFinder 数据库分析,确定其与文献报道的代号为 RM18 化合物相同[系统命名为1-(7-乙酰-8-羟基苯并[]色烯-2-基)-2-丙酮,分子式 C17H14O4,结构见图 2]。核磁数据如下:1H-NMR,(ppm),1.2(s,1OH,H-15),2.16(s,3H,H-1),2.45(s,3H,H-17),3.55(s,2H,H-3),6.11(s,1H,H-5),6.36(s,1H,H-14),6.67(d,= 6.6 Hz,1H,H-7),7.23(t,= 7.2 Hz,1H,H-8),7.57(d,= 8.4 Hz,1H,H-9);13C-NMR,(ppm),29.6(C-1),204.0(C-2),47.2(C-3),149.7(C-4),106.8(C-5),129.2(C-6),114.4(C-7),130.1(C-8),120.7(C-9),133.0(C-10),116.7(C-11),155.7(C-12),98.7(C-13),159.5(C-14),113.8(C-15),201.8(C-16),32.6(C-17)。
化合物6为淡黄色粉末,分子量240,NMR(600 MHz,DMSO-6)解析并结合 SciFinder 数据库分析,确定其与文献报道的代号为 RM18b 化合物相同[系统命名为1-(8-羟基-2-甲基苯并[]色烯-7-基)乙酮,分子式 C15H12O3,结构见图 2]。核磁数据如下:1H-NMR,(ppm),2.14(s,3H,H-1),2.75(s,3H,H-15),5.97(s,1H,H-3),6.39(s,1H,H-12),6.76(d,= 7.2 Hz,1H,H-5),7.40(dd,= 7.2,7.2 Hz,1H,H-6),7.63(d,= 8.4 Hz,1H,H-7),14.49(s,1OH,H-12);13C-NMR,(ppm),18.8(C-1),156.3(C-2),104.0(C-3),130.0(C-4),113.5(C-5),129.2(C-6),120.1(C-7),132.8(C-8),116.6(C-9),155.7(C-10),98.7(C-11),159.5(C-12),113.8(C-13),201.8(C-14),32.6(C-15)。
2.4 化合物 1 ~ 3 的抗肿瘤细胞和抗病毒活性
化合物1、2和3对人结肠癌细胞 HCT116 的 IC50值分别为 57.59、16.46和 43.39 μmol/L,表明它们对肿瘤细胞具有较弱的体外抑制活性。
化合物1对 HSV-1 的 IC50和 TC50分别为大于 11.11 和 48.07 μg/ml,化合物2对 HSV-1 的 IC50和 TC50分别为 2.81 ~ 7.70 和 23.11 μg/ml;阳性对照药物 ACV 对 HSV-1 的 IC50和 TC50分别为 0.34 ~ 0.41 和大于 100 μg/ml。因此,化合物1和2具有微弱的抗 HSV-1 病毒活性。
3 讨论
化合物1~4属于蒽醌类。蒽醌类化合物是多种植物的次生代谢产物,在掌叶大黄()中含量比较高,其中的主要成分为大黄酚(1)和大黄素(emodin,1,3,8-三羟基-6-甲基蒽醌)。此外,Li 和 McLaughlin[1]从药用植物铁仔()中发现4。
微生物也产生蒽醌类次级代谢产物。例如,Fotso 等[2]从一株链霉菌中发现了1;Abdelfattah[3]从另外一株链霉菌中发现了2;McDaniel 等[4-5]通过基因工程技术将富伦菌素(frenolicin)与放线紫红素(actinorhodin)的生物合成基因在天蓝色链霉菌()中进行组合,产生了多个芳香聚酮类化合物,包括 SEK26(3),以及 RM18(5)和 RM18b(6)。
化合物1~6可能是在链霉菌 CPCC 200510 中相同的芳香聚酮合酶催化下,将 8 个或 9 个二碳单位(乙酰 CoA)聚合生成线性的八酮体或九酮体,再经一系列不同的修饰反应(还原、氧化、脱水和脱羧等),生成主要组分1~3和次要组分4~6(图 3)。其中,5~6是聚酮链芳香环化过程中的支路产物(shunt product)[6],4是1的羟基化衍生物,2是3的脱羧产物[7]。化合物3在乙腈等溶剂中发生缓慢的自发脱羧反应生成2;化合物1和4~6在其生物合成过程中也发生过脱羧反应,但没有检测到未脱羧的前体物。
蒽醌类主要有致泻、抗菌和抗肿瘤等作用或活性。对分离得到的主要组分进行初步的生物活性测定表明:1~3具有中等的抗肿瘤细胞活性,1~2具有微弱的抗病毒活性。此外,还检测到1~2具有抗革兰氏阳性菌活性。
文献[8]报道一株诺卡氏菌()产生大黄酚,产量约 30 mg/L。链霉菌CPCC 200510 与该菌株的大黄酚产量基本相当。预期通过发酵条件优化可以进一步提高链霉菌CPCC 200510 的大黄酚及类似物的产量,使该菌株有望成为大黄酚及其类似物的微生物生产菌株。
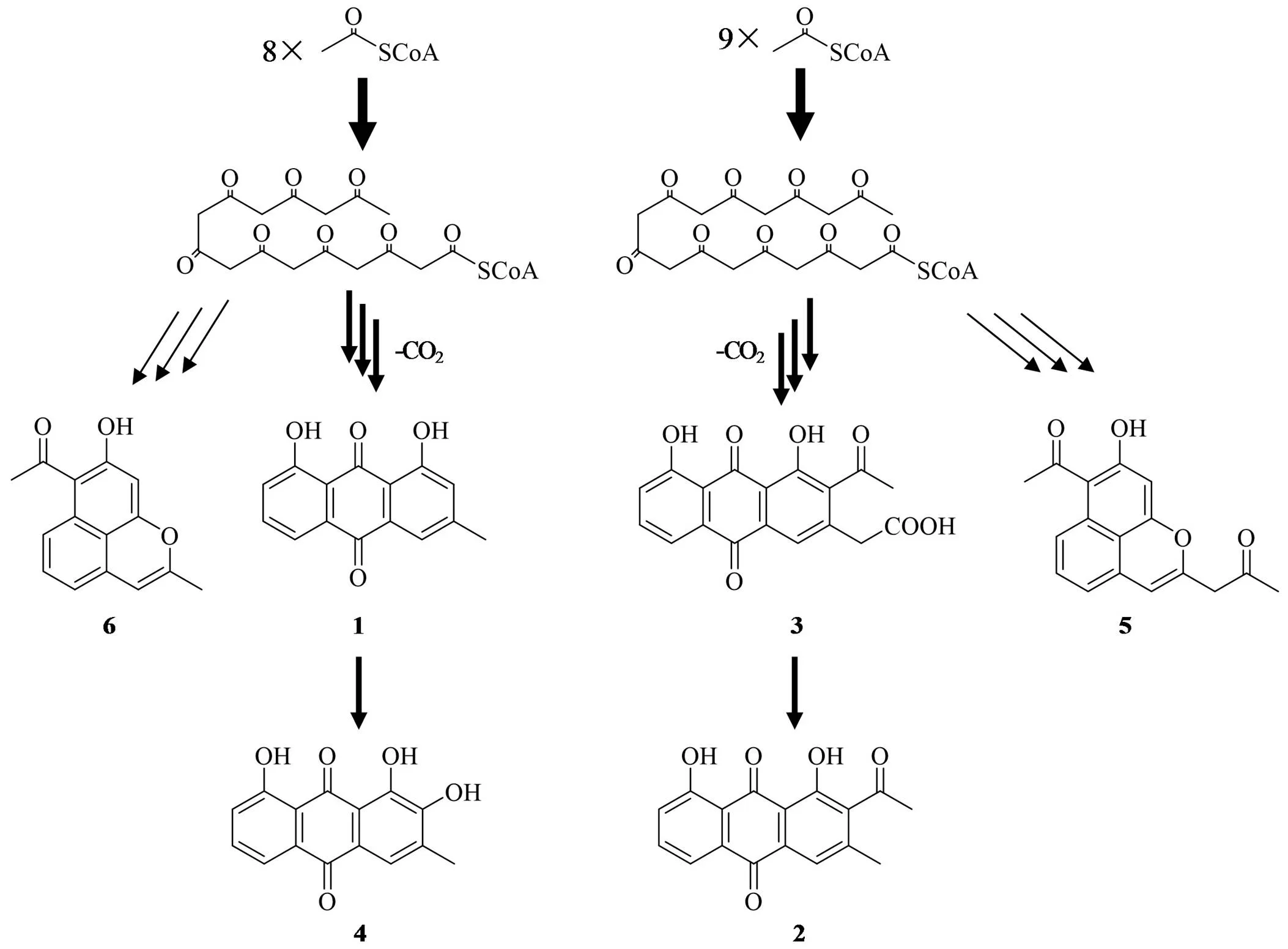
图 3 推测的1 ~ 6生物合成相关性
Figure 3 The speculated biosynthetic relationship of 1 ~ 6
[1] Li XH, McLaughlin JL. Bioactive compounds from the root of Myrsine Africana. J Nat Prod, 1989, 52(3):660-662.
[2] Fotso S, Maskey RP, Grün-Wollny I, et al. Bhimamycin A to approximately E and bhimanone: isolation, structure elucidation and biological activity of novel quinone antibiotics from a terrestrial Streptomycete. J Antibiot (Tokyo), 2003, 56(11):931-941.
[3] Abdelfattah MS. Mansoquinone: isolation and structure elucidation of new antibacterial aromatic polyketides from terrestrial Streptomyces Sp. Eg5. Nat Prod Res, 2009, 23(3):212-218.
[4] McDaniel R, Ebert-Khosla S, Hopwood DA, et al. Engineered biosynthesis of novel polyketides: manipulation and analysis of an aromatic polyketide synthase with unproven catalytic specificities.J Am Chem Soc, 1993, 115(25):11671-11675.
[5] McDaniel R, Ebert-Khosla S, Hopwood DA, et al. Rational design of aromatic polyketide natural products by recombinant assembly of enzymatic subunits. Nature, 1995, 375(6532):549-554.
[6] Fu H, Alvarez MA, Khosla C, et al. Engineered biosynthesis of novel polyketides: regiospecific methylation of an unnatural substrate by the tcmO O-methyltransferase. Biochemistry, 1996, 35(21):6527-6532.
[7] Zhang W, Li Y, Tang Y. Engineered biosynthesis of bacterial aromatic polyketides in Escherichia coli. Proc Natl Acad Sci U S A, 2008, 105(52):20683-20688.
[8] Bringmann G, Noll TF, Gulder TA, et al. Different polyketide folding modes converge to an identical molecular architecture. Nat Chem Biol, 2006, 2(8):429-433.
Identification of chrysophenol and its congeners fromsp. CPCC 200510
LI Lin-li, LI Ting, JIANG Bing-ya, LI Shu-fen, LIU Hong-yu, YU Li-yan, HE Hong-wei, LI Yu-huan, WU Lin-zhuan
Author Affiliation: NHC Key Laboratory of Biotechnology of Antibiotics, CAMS Key Laboratory of Synthetic Biology for Drug Innovation, Institute of Medicinal Biotechnology, Chinese Academy of Medical Sciences & Peking Union Medical College, Beijing 100050, China
To identify secondary metabolite(s) produced bysp.CPCC 200510.
TLC and LC-MS were used to analyze the EtOAc extract of fermentation culture ofsp.CPCC 200510.EtOAc extraction, ODS column chromatography and preparative HPLC were employed to purify secondary metabolites fromsp.CPCC 200510. Chemical structures of the purified metabolites were assayed by NMR.
Six yellow compounds (1 - 6) were purified fromsp.CPCC 200510, with 1 - 3 as main components. The structures of 1 - 6 were determined as 1,8-dihydroxy-3-methyl-9,10-anthraquinone (1, chrysophenol), 2-acetyl-1,8-dihydroxy-3- methyl-9,10-anthraquinone (2), 2-acetyl-1,8-dihydroxy-3-carboxymethyl-9,10-anthraquinone (3), 1,2,8-trihydroxy-3-methyl-9,10- anthraquinone (4), 1-(7-acetyl-8-hydroxybenzo[]chromen-2-yl) propan-2-one (5) and 1-(8-hydroxy-2-methylbenzo[]chromen- 7-yl)ethanone (6), respectively. 1 - 3 showed moderate cytotoxicity against cancer cell line HCT116, and 1 - 2 displayed some activity against HSV-1. 1 - 6 are a group of biosynthetically related aromatic polyketides.
sp.CPCC 200510 is a promising microbial producer for chrysophenol or its congeners.
CHRYSOPHANOL;sp.CPCC 200510; Aromatic polyketides
WU Lin-zhuan, Email: wulinzhuan@imb.pumc.edu.cn
10.3969/j.issn.1673-713X.2019.05.002
中国医学科学院医学与健康科技创新工程(CAMS-I2M- 3-012);国家微生物资源基础平台(NIMR-2018-3);国家自然科学基金(81573328)
武临专,Email:wulinzhuan@imb.pumc.edu.cn
2019-05-08

