UDP-3-O-(R-羟基十四酰)-N-乙酰氨基葡萄糖脱乙酰基酶的表达、纯化及与ACHN-975复合物的X-射线衍射分析
李丹阳,樊帅,金媛媛,杨兆勇
UDP-3--(-羟基十四酰)--乙酰氨基葡萄糖脱乙酰基酶的表达、纯化及与ACHN-975复合物的X-射线衍射分析
李丹阳,樊帅,金媛媛,杨兆勇
100050 北京,中国医学科学院北京协和医学院医药生物技术研究所微生物代谢工程研究室
以UDP-3--(-羟基十四酰)--乙酰氨基葡萄糖脱乙酰基酶(LpxC)-ACHN-975 晶体复合物结构为基础,研究小分子与靶蛋白的结合位点与方式,进而依据复合物结构设计该化合物,以获得活性强、毒性低的药物小分子。
运用大肠杆菌表达系统对超嗜热菌()来源的AaLpxC 进行异源表达,采用 Zn2+-NTA 亲和层析、Q-HP 强阴离子交换色谱和 Superose 12分子排阻色谱对重组蛋白进行分离纯化,对 AaLpxC 进行结构生物学研究,采用蒸汽扩散-悬滴法进行结晶条件筛选以及优化。
获得纯度在 90% 以上的超嗜热菌来源的 AaLpxC,经过结晶条件的优化获得分辨率为 1.21 Å(1 Å = 1 × 10-10m)的 AaLpxC 与 ACHN-975 的复合物晶体的衍射数据,其晶胞参数为 a = 65.569 Å,b = 65.569 Å,c = 131.595 Å,α = 90.000°,β = 90.000°,γ = 120.000°。
ACHN-975 与 AaLpxC 复合物晶体结构的获得有望对 ACHN-975 小分子结构优化及设计提供指导方向及重要依据。
LpxC; ACHN-975; 蛋白纯化; 结晶,X-射线衍射
每年由致病菌引起的人类感染导致数百万人死亡,根据世界卫生组织报道,肺结核、腹泻以及下呼吸道感染均排在全球十大死亡原因之列[1]。此外,由细菌感染引起的严重脓毒症,每年影响全球多达 1800 万人,死亡率在28% ~ 50% 不等[2-3]。目前,大部分细菌感染都能用现有的抗生素治疗。然而,由于多重耐药细菌的广泛出现,抗生素治疗的效果在不断下降。因此,迫切需要研发具有新的抗菌机制的新型抗生素。
ACHN-975 是 Achaogen 公司开发的第一个进入临床研究的 UDP-3--(-羟基十四酰)--乙酰氨基葡萄糖脱乙酰基酶(LpxC)抑制剂。ACHN-975 对来源的 LpxC(PaLpxC)的 IC50值为 0.02 nmol/L,同时对 998 种绿脓杆菌分离菌株具有抑制活性,98.6% 的 MIC 值均≤ 1 μg/ml[4]。同样,ACHN-975 对120 种分离到的革兰氏阴性菌具有抗菌活性,98.3% MIC 值均≤ 4 μg/ml,其中大肠杆菌()ATCC25922 的MIC 值为0.125 μg/ml,肺炎克雷伯氏菌ATCC43816 的MIC 值为0.5 μg/ml,小肠耶尔森氏菌的MIC 值为 2 μg/ml。ACHN-975 对绿脓杆菌的抑制呈浓度依赖性,而对大肠杆菌与肺炎克雷伯氏菌的抑制呈时间依赖性。专利 WO2012154204 表明,哺乳动物对其有良好耐受性,并且在小鼠大腿中性粒细胞减少模型中,与万古霉素具有协同作用[5]。然而在临床I 期研究中,由于在注射部位的不良反应——炎症反应,ACHN-975 撤下了临床研究。但ACHN-975 具有的良好活性与其巨大的潜在应用价值仍值得进一步研究。
目前,已有、、和来源的 LpxC 采用蛋白结晶或 NMR 的方法获得结构信息[6-10]。2003 年,Whittington 等[11]首次对嗜热菌来源的 LpxC 的晶体结构进行报道之后,其余菌种来源的 LpxC 结构也相继被报道。
本研究主要对来源的 LpxC(AaLpxC)与 ACHN-975 的复合物结构进行研究,采用基因分子生物学技术构建蛋白表达载体,利用原核表达方式进行 LpxC 蛋白的大量表达,对AaLpxC 进行晶体培养获得 AaLpxC 与 ACHN-975的复合物晶体,应用生物大分子 X-ray 衍射技术获得复合物的晶体结构数据并进行解析,为 ACHN-975 小分子的理性设计与结构优化提供理论依据,指导开发新的具有更好活性的抗菌药物。
1 材料与方法
1.1 材料
1.1.1 菌株与试剂 AaLpxC 表达菌株BL21(DE3) 和表达质粒 pET-21a(+) 购自美国Novagen 公司;超滤浓缩管购自美国Millipore 公司;HiTrap Q HP 和 Superose 12 10/300GL 购自美国GE Healthcare Life 公司;其余试剂均为国产分析纯。
1.1.2 主要仪器 AKTApurifierTM-UPC10 蛋白纯化仪购自美国 GE Healthcare Life 公司;ZXSD-R1270 晶体生长恒温培养箱购自上海智城公司;5804R 冷冻离心机购自德国 Eppendorf 公司。
1.2 方法
1.2.1 表达质粒构建 以 AaLpxC 基因序列(WP_010881151.1)为模板,引入突变 C181A 并优化密码子使其适于大肠杆菌表达,人工合成经密码子优化的 AaLpxC 基因序列。利用其基因序列为模板,用 Primer 5.0 分别设计 PCR 引物,分别为:NdeI-AaLpxC-F(5' GGAATTCGGCCT GGAAAAAACCGTGAAGG 3')(下划线部分为加入的I 酶切位点),XhoI-AaLpxC-R(5' CCGGCGGGTCAGTTTCTGTTTTTTAGCC 3')(下划线部分为加入的I 酶切位点),经 PCR 和双酶切后连入 pET-21a(+) 构建表达质粒 pET-21AaLpxC,进行I 和I 双酶切验证。挑选酶切后片段大小正确的质粒送往华大公司进行测序,确认序列准确无误。
1.2.2 AaLpxC 表达与纯化 将构建好的pET-21aAaLpxC 质粒转化至BL21(DE3) 表达菌株,接种于 50 ml 含 100 μg/ml Amp 的 LB 培养基中。37 ℃摇床过夜培养。次日再按 2.0% 的接种量转接到 1 L 的含 100 μg/ml Amp 的 LB 培养基中,200 r/min、37 ℃恒温摇床振荡培养,当600达到 0.6 左右时,加入终浓度为 0.2 mmol/L IPTG,200 r/min、30 ℃继续振荡培养 5 h。收集诱导培养的菌体 4000 r/min,4 ℃离心 10 min,倒掉上清后用 lysis buffer(20 mmol/L 磷酸缓冲液、500 mmol/L NaCl、10 mmol/L 咪唑,pH 7.4)重悬,利用高压均质机破碎两遍,18 000 r/min、4 ℃离心 30 min,收集上清备用。由于 pET-21a(+) 带有 His6标签,因此可选用 Zn2+-NTA 柱进行目的蛋白的纯化。首先将收集的上清用 0.45 μm 滤膜过滤,与经 lysis buffer 平衡后的基质在 4 ℃下结合 1 h,然后用 washing buffer(20 mmol/L 磷酸缓冲液、500 mmol/L NaCl、20 mmol/L 咪唑,pH 7.4)5 倍柱体积冲洗,最后用 elution buffer(20 mmol/L 磷酸缓冲液、500 mmol/L NaCl、500 mmol/L 咪唑,pH 7.4)洗脱目的蛋白,经SDS-PAGE 检测后将目的蛋白用 30 K 超滤浓缩管进行脱盐浓缩后备用。离子交换层次采用强阴离子交换柱 HiTrap Q HP,利用洗脱液(20 mmol/L Tris 和 2 mol/L NaCl,pH 8.0)进行梯度洗脱,收集出峰样品经 SDS-PAGE 检测后将目的蛋白用 30 K 超滤浓缩管进行脱盐浓缩后备用。分子排阻层析利用 Superose 12 10/300GL,流速为 0.5 ml/min,收集出峰样品经 SDS-PAGE 检测后将目的蛋白用 30 K 超滤浓缩管脱盐浓缩后备用。
1.2.3 AaLpxC 结晶初筛与优化 将 AaLpxC 浓度调至 8 mg/ml,小分子 ACHN-975 浓度 1.3 mmol/L,缓冲液置换为 20 mmol/L HEPES,100 mmol/L KCl 用 Crystal ScreenTM-HR2-110 Scoring Sheet、Crystal ScreenTM-HR2-112 Scoring Sheet、Wizard CRYO 1 Tubes 和 Wizard CRYO 2 Tube 进行结晶池液条件初筛,样品放于 20 ℃恒温培养箱。对初筛获得的晶体生长池液条件中的pH(6.0 ~ 8.0)、蛋白浓度(8、14 mg/ml)、结晶温度(10、15 和20 ℃)和沉淀剂浓度(PEG3350 8% ~ 20 %、PEG60008% ~ 20% 和 PEG8000 4% ~ 10%)进行梯度优化,最终获得高质量的 X-射线衍射数据。
1.2.4 X-射线晶体衍射与数据收集 经冻存的晶体在上海同步辐射光源BL17U1 线站上收集数据,衍射数据使用 HKL3000 软件包进行处理,选择检测器 SSRF-BL17U1-Q315r,利用 Phenix 进行分子置换解决相位问题,最后用 Phenix 和 Coot 进行结构精修。

图 1 适于大肠杆菌表达的LpxC 序列密码子优化前后比对(AaLpxC-before:优化前序列;AaLpxC-after:优化后序列)
Figure 1 Comparison of wild-type and optimized LpxC gene sequence forexpression (AaLpxC-before: wild-type LpxC gene sequence; AaLpxC-after: optimized LpxC gene sequence forexpression)
2 结果
2.1 AaLpxC 目的基因的克隆
对 AaLpxC 基因序列进行密码子优化,保持氨基酸序列不变的情况下,优化核苷酸序列使其适于大肠杆菌表达,改造完成后的基因序列由华大基因进行全基因合成,密码子优化前后的基因序列对比如图 1 所示。
将密码子优化后的 AaLpxC 作为模板(以下出现的 AaLpxC 均为密码子优化后的序列),以I-AaLpxC-F&I-AaLpxC-R、I-EcLpxC- F&I-EcLpxC-R、I-PaLpxC-F&I-PaLpxC- R 为引物,分别进行 PCR 克隆目的基因,PCR 产物进行琼脂糖凝胶电泳检测,的基因序列理论长度为 813 bp,结果如图 2 所示,在约 800 bp 处有特异性条带,均与基因序列理论长度相符。
2.2 AaLpxC 异源表达与纯化
通过重组质粒转化,成功表达全长的 AaLpxC 重组细菌。在 37 ℃,200 r/min 的条件下,培养至600达到 0.8 ~ 1.0 之间,加入终浓度为0.2 mmol/L 的 IPTG,在 20 ℃、12 h 条件下诱导目的蛋白表达。诱导完成的细菌,经高压破碎,Zn2+-NTA 亲和树脂填料纯化后,采用强阴离子交换柱 HiTrap Q HP 进行纯化,AaLpxC 蛋白在洗脱液(20 mmol/L Tris、2 mol/L NaCl、pH 8.0)浓度为 14% 开始出峰,收集出峰样品进行 SDS-PAGE分析,结果如图 3 所示。经离子交换纯化后,AaLpxC 纯度较高,已达 90% 以上,为保证蛋白的均一性,取峰尖的 2、3 管进行浓缩备用。
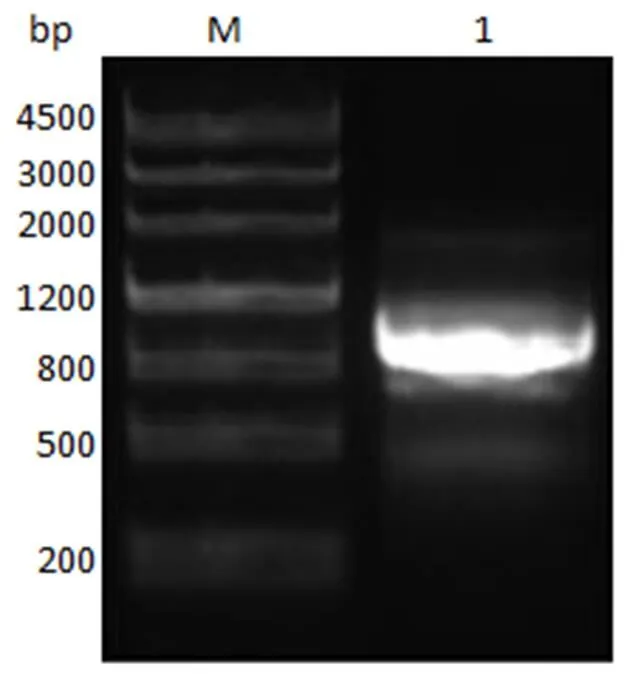
M:核酸标准品;1:aalpxc 基因
Figure 2 PCR amplification results ofgene
采用分子排阻色谱 Superose 12 10/300GL,将经离子交换纯化的 AaLpxC 蛋白进行进一步纯化,AaLpxC 蛋白在进样 14 min 后开始出峰,收集出峰样品进行 SDS-PAGE 分析,结果如图 4 所示。分子排阻色谱纯化后,AaLpxC 纯度进一步提高,收集均一性较好的峰尖管,浓缩后备用。
2.3 初筛
将 AaLpxC 浓度调至 8 mg/ml,缓冲液置换为 20 mmol/L HEPES,100 mmol/L KCl 用 Crystal ScreenTM-HR2-110 Scoring Sheet、Crystal ScreenTM- HR2-112 Scoring Sheet、Wizard CRYO 1 Tubes 和Wizard CRYO 2 Tube 进行结晶池液条件初筛,样品放于 20 ℃恒温培养箱。观察到 3 个条件出现微晶。条件 1:100 mmol/L HEPES pH 7.5,180 mmol/L NaCl,16%(w/v)PEG3350;条件 2:100 mmol/L HEPES pH 7.5,16%(w/v)PEG6000,5% MPD;条件 3:30%(v/v)PEG400,100 mmol/L HEPES pH7.5,5%(w/v)PEG3000,10% Glycerol。其中,条件 1 和条件 2 均出现“麦芒状”晶体(图5),有望通过复筛优化获得可以进行衍射的单晶。

M:蛋白标准品;1 ~ 4:AaLpxC
Figure 3 SDS-PAGE analysis of recombinant AaLpxC purified by DEAE ion-exchange chromatography (A: Peak of AaLpxC purified by DEAE ion-exchange chromatography; B: SDS-PAGE analysis of peak)
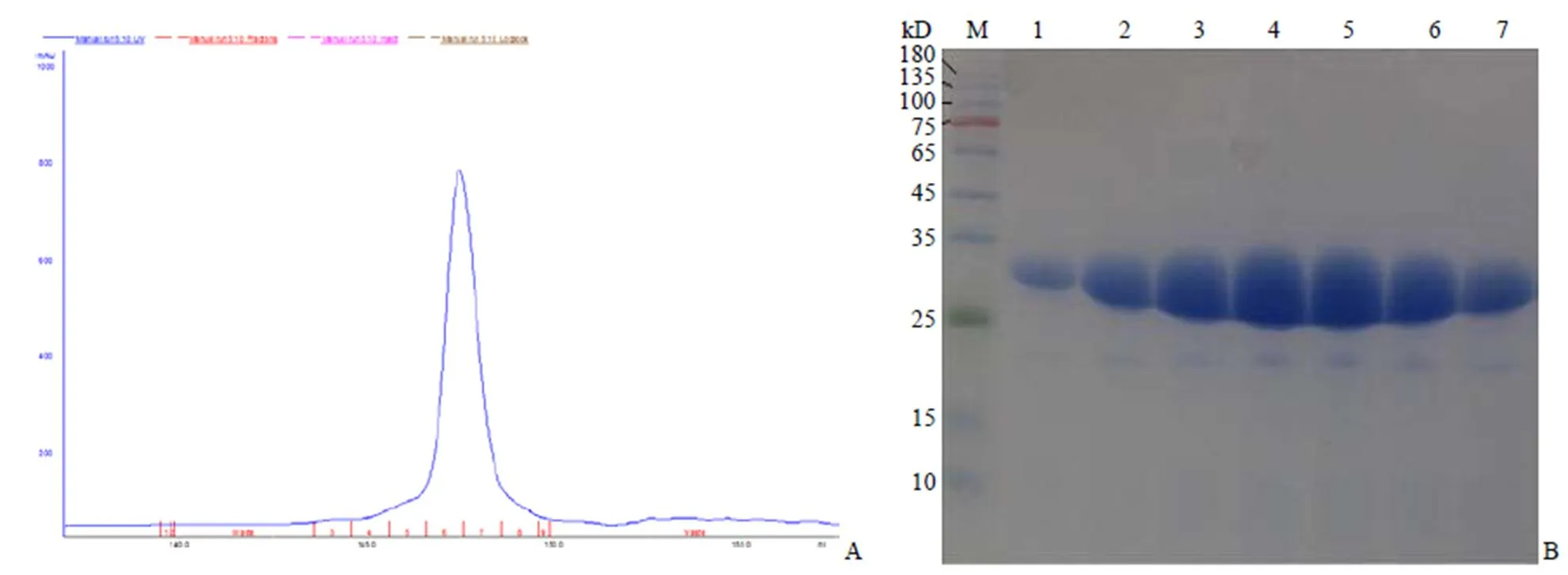
M:蛋白标准品;1 ~ 7:AaLpxC
Figure 4 SDS-PAGE analysis of recombinant AaLpxC purified by Superose12 size exclusion chromatography (A: Peak of AaLpxC purified by Superose12 size exclusion chromatography; B: SDS-PAGE analysis of peak)
对初筛条件中的 pH、蛋白浓度、沉淀剂种类和浓度、结晶温度进行优化,最终在蛋白浓度为 14 mg/ml,池液条件为:100 mmol/L HEPES,pH 7.0,6% PEG8000,10% 乙二醇,AaLpxC 与 ACHN-975 的摩尔比为 1:5,结晶温度为 15 ℃时结晶条件最优,晶体如图 6 所示。
将优化后的晶体液氮冻存,用 X 射线衍射仪筛选,得到一批衍射分辨率较高的晶体,最高分辨率可达 2.3 Å,如图 7 所示。
筛选得到的晶体运送至上海光源(SSRF)BL17U1线站采集数据,并使用HKL3000 进行数据处理,Phenix、Coot 等软件解析结构信息。AaLpxC 与 ACHN-975 复合物晶体结构空间群为 P61,最终结构的分辨率为 1.21 Å,晶胞参数为:a = 65.569 Å,b = 65.569 Å,c = 131.595 Å,α = 90.000°,β = 90.000°,γ = 120.000°。

图 5 AaLpxC 结晶条件初筛结果[A:AaLpxC 浓度:8 mg/ml,池液条件:100 mmol/L HEPES pH 7.5,180 mmol/L NaCl,16%(w/v)PEG3350;B:AaLpxC 浓度:8 mg/ml,池液条件:100 mmol/L HEPES pH 7.5,16%(w/v)PEG6000,5% MPD]
Figure 5 Crystallization-condition screening of AaLpxC [A: AaLpxC concentration: 8 mg/ml, reservoir condition: 100 mmol/L HEPES pH 7.5, 180 mmol/L NaCl, 16% (w/v) PEG3350; B: AaLpxC concentration: 8 mg/ml, reservoir condition: 100 mmol/L HEPES pH 7.5, 16% (w/v) PEG6000, 5% MPD]
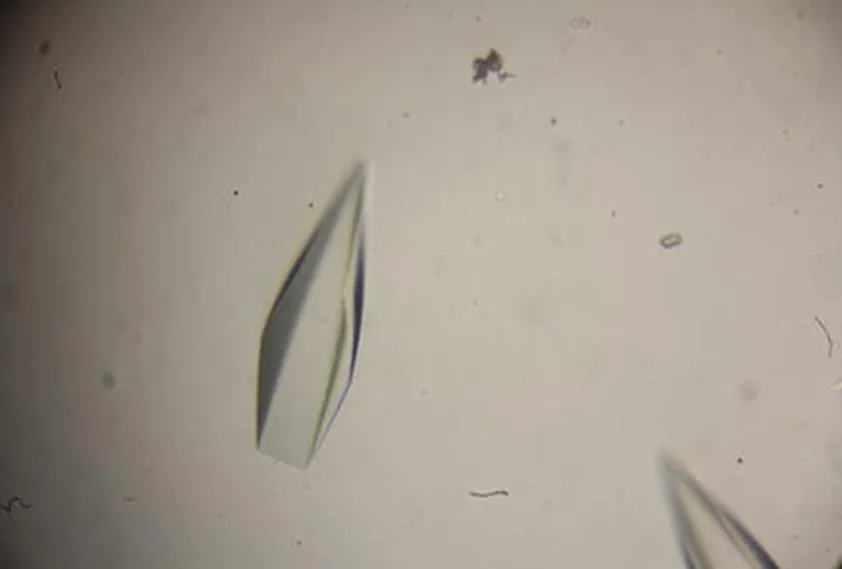
图 6 优化后 AaLpxC 晶体
Figure 6 The optimized AaLpxC crystals

图 7 AaLpxC 与ACHN-975 复合物晶体X 射线衍射图(分辨率为2.3 Å)
Figure 7 Crystal X-ray diffraction pattern of AaLpxC- ACHN-975 complex with resolution at 2.3 Å
3 讨论
目前,已有多种来源的 LpxC 的晶体结构报道。整体属于“β-α-α-β 三明治式”折叠,其三级结构分为 2 个结构域,中间由 16 个氨基酸残基的 linker 连接;每个结构域具有相似的拓扑结构,都包含 5 个 β 片层和 2 个 α 螺旋,两部分 β 片层将 α 螺旋夹在中央,呈“三明治”状,并将两个结构域整合为整体。其中结构域I 的 β 片层稍有弯曲,而结构域II 的 β 片层相对平直。
本文利用 X 射线衍射晶体法解析了来自超嗜热菌的 AaLpxC-ACHN-975 的复合物晶体结构。首先利用大肠杆菌表达系统异源高效表达目的蛋白,再采用亲和层析、离子交换和分子排阻色谱进行纯化得到纯度达 90% 以上的 AaLpxC,接着通过结晶筛选试剂盒进行初筛,筛选获得了三个具有碎晶的结晶池液条件。经过 pH、蛋白浓度、结晶温度和沉淀剂浓度的优化得到最优结晶条件,在中国科学院生物物理所进行衍射的筛选后,经上海同步辐射光源 BL17U1 线站收集得到分辨率为1.21 Å 的 X -射线衍射数据,通过分子置换和结构精修最终获得了 AaLpxC-ACHN-975 复合物的空间结构,为下一步解析抑菌机制和理性设计药物先导物打下了坚实的基础。
[1] World Health Organization. Global antimicrobial resistance surveillance system (GLASS) report -- Early implementation 2016-2017. Geneva: World Health Organization, 2018.
[2] Perman SM, Goyal M, Gaieski DF. Initial emergency department diagnosis and management of adult patients with severe sepsis and septic shock. Scand J Trauma Resusc Emerg Med, 2012, 20:41.
[3] Slade E, Tamber PS, Vincent JL. The surviving sepsis campaign: raising awareness to reduce mortality. Crit Care, 2003, 7(1):1-2.
[4] Kasar R, Linsell MS, Aggen JB, et al. Hydroxamic acid derivatives and their use in the treatment of bacterial infections: European, 11849908. 2013-09-18.
[5] Moffatt JH, Harper M, Harrison P, et al. Colistin resistance in Acinetobacter baumannii is mediated by complete loss of lipopolysaccharide production. Antimicrob Agents Chemother, 2010, 54(12):4971-4977.
[6] Mansoor UF, Vitharana D, Reddy PA, et al. Design and synthesis of potent Gram-negative specific LpxC inhibitors. Bioorg Med Chem Lett, 2011, 21(4):1155-1161.
[7] Lee CJ, Liang X, Gopalaswamy R, et al. Structural basis of thepromiscuous inhibitor susceptibility of Escherichia coli LpxC. ACS Chem Biol, 2014, 9(1):237-246.
[8] Shin H, Gennadios HA, Whittington DA, et al. Amphipathic benzoic acid derivatives: synthesis and binding in the hydrophobic tunnel of the zinc deacetylase LpxC. Bioorg Med Chem, 2007, 15(7):2617- 2623.
[9] Cole KE, Gattis SG, Angell HD, et al. Structure of the metal-dependent deacetylase LpxC from Yersinia enterocolitica complexed with the
potent inhibitor CHIR-090. Biochemistry, 2011, 50(2):258-265.
[10] Piizzi G, Parker DT, Peng Y, et al. Design, synthesis, and properties of a potent inhibitor of pseudomonas aeruginosa deacetylase lpxC. J Med Chem, 2017, 60(12):5002-5014.
[11] Whittington DA, Rusche KM, Shin H, et al. Crystal structure of LpxC, a zinc-dependent deacetylase essential for endotoxin biosynthesis. Proc Natl Acad Sci U S A, 2003, 100(14):8146-8150.
Prokaryotic expression and purification of UDP-3--(-hydroxymyristoyl)--acetylglucosamine deacetylase fromand the preliminary crystallographic study on its complex with ACHN-975
LI Dan-yang, FAN Shuai, JIN Yuan-yuan, YANG Zhao-yong
Author Affiliations: Department of Microbial Pathway Engineering,Institute of Medicinal Biotechnology, Chinese Academy of Medical Sciences & Peking Union Medical College, Beijing 100050, China
Based on the complex structure of ACHN-975 with LpxC and the study on the corresponding binding site and binding model. It is promising to design and optimize ACHN-975 analogues to obtain optimized molecules with strong activity and low toxicity.
The heterogeneous expression system ofwas used to express AaLpxC from. The recombinant protein was purified by Zn2+-NTA affinity chromatography, Q-HP strong anion exchange and Superpose 12 exclusion, with the final purity being over 90%. The crystallization condition was screened and optimized by hanging-drop vapor diffusion method, and the crystal structure of AaLpxC with ACHN-975 was studied.
The complex crystals of AaLpxC and ACHN-975 were obtained at optimum conditions (14 mg/ml, 100 mmol/L HEPES, pH 7.0, 6% PEG8000, 10 % glycol, 15 ℃), and the resolution of diffraction data was up to 1.21 Å (1 Å = 1 × 10-10m). The lattice parameters of crystal (a = 65.569 Å, b = 65.569 Å, c = 131.595 Å, α = 90.000°, β = 90.000°, γ = 120.000°) was obtained.
The obtained crystal structure of LpxC with ACHN-975 is expected to provide guidance and basis for the optimization and design of small molecular analogues of ACHN-975.
LpxC; ACHN-975; Purification; Crystallography, X-ray
YANG Zhao-yong, Email: zhaoyongy@imb.pumc.edu.cn
10.3969/j.issn.1673-713X.2019.05.004
国家自然科学基金面上项目(81872782);中国医学科学院医学与健康科技创新工程项目(2016-I2M-3-022)
杨兆勇,Email:zhaoyongy@imb.pumc.edu.cn
2019-05-20

