间充质干细胞治疗类风湿关节炎基础与临床研究进展
刘广洋,王皓,郑力搏,张晨亮,李欣,米一,刘拥军
间充质干细胞治疗类风湿关节炎基础与临床研究进展
刘广洋,王皓,郑力搏,张晨亮,李欣,米一,刘拥军
100176 北京贝来生物科技有限公司/北京亦创生物技术产业研究院干细胞与再生医学研究所
类风湿关节炎(rheumatoid arthritis,RA)是一类慢性自身免疫性疾病,其发病机制尚未完全阐明,主流观点认为外周免疫耐受缺陷及免疫反应异常导致免疫细胞及抗体进入关节滑膜,是 RA 发生和发展的关键因素。近年来,间充质干细胞(mesenchymal stem cells,MSCs)因其具有的免疫调节和损伤修复功能,在 RA 等疾病治疗过程中显示出良好的临床前景。本文将重点探讨 RA 的发病机制、治疗现状以及 MSCs 治疗 RA 的可能途径,对该领域的临床研究现状进行总结。
1 类风湿关节炎发病机制及治疗现状
RA 是一类以慢性对称性多滑膜关节炎和关节外病变(皮下结节、心包炎、胸膜炎、肺炎、周围神经炎等)为主要临床表现的自身免疫性疾病[1],可引起关节损伤、躯体残疾、心血管疾病等合并症[2],其特征是病程慢、反复发作。由于长期的疾病并发症,类风湿关节炎也与预期寿命降低有关[1]。类风湿关节炎的全球发病率为 0.24%[3],在欧美发达国家占 0.5% ~ 1%,其中美国大约有 150 万类风湿关节炎病人[2]。类风湿性关节炎的发病机制涉及多方面因素,其中,免疫异常可能是主要因素。受遗传因素影响的机体反应性在体内外致病因素的作用下,造成免疫功能平衡失调,导致体液免疫反应过度亢进,产生大量自身抗体,激活关节细胞产生致炎性的生物活性物质,引起炎症,继而造成软骨和骨质等组织损伤。已知在病变关节内有大量免疫细胞积聚,可以分泌细胞因子导致滑膜细胞内的信号转导异常,特别是 MAPK 转导系统活跃,使转录因子 NF-κB、AP-1 活化,使炎症性、骨吸收性的细胞因子(如 IL-1、IL-6、TNF-α)和增殖因子(如 FGF-2、PDGF)产生亢进,使基质金属蛋白酶(MMP)产生增加,从而可引起滑膜细胞凋亡、破骨细胞激活、基质破坏。当前,针对 RA 的治疗药物有皮质类固醇/非甾体抗炎药(NSAIDs)、传统合成抗风湿药物(csDMARDs)和生物制剂(bDMARDs)等[2-3],具体如表 1 所示。
1.1 皮质类固醇/非甾体抗炎药(NSAIDs)
NSAIDs 类药物主要包括阿司匹林、水杨酸钠、吲哚美辛等,该类药物为一线抗风湿药,主要通过抑制环氧化酶(COX)的活性及花生四烯酸的产生,从而减少血栓素、前列腺素等炎性介质的合成,发挥消肿、止痛、抗炎等功效,但不能影响急性反应性物质、类风湿因子等;并且上述药物均有不同程度的消化道损害和肾损害等副作用[4-5]。
1.2 传统合成抗风湿药物(csDMARDs)
csDMARDs 具有抑制骨软骨的进行性破坏及抑制炎症等作用,常用的 csDMARDs 包括抗疟药(氯喹和羟氯喹)、金制剂(注射的和口服的金诺芬)、青霉胺、柳氮磺胺吡啶以及细胞毒性药物如甲氨蝶呤、硫唑嘌呤、环磷酰胺、环孢素A 等;csDMARDs 可延缓病情进展,但起效慢(1 ~ 6 个月),且对每位患者的疗效不确定。RA 确诊后应立即开始 DMARD 治疗,所有患者的治疗均应以达到缓解或降低疾病活动度为目标,活动性疾病应密切(每 1 ~ 3 个月)监控,如开始治疗后最多 3 个月未见改善或 6 个月未达标则应调整治疗方案。
1.3 生物制剂(bDMARDs)
生物制剂(bDMARDs)主要是抗体类药物。肿瘤坏死因子抑制剂类生物制剂(TNFi bDMARDs)是以 TNF-a 为靶点的抗体药,在改善 RA 临床症状方面显示出一些好的效果[6]。然而,由于 csDMARDs 和 bDMARDs 需反复用药,且用药间隔时间短,常常导致严重的副作用,例如由于非特异的免疫抑制效应可导致严重感染,而许多病人应用一段时间后会出现治疗无效[7-8]。应用 TNFi bDMARDs 药物后 30% ~ 40% 的 RA 患者会成为难治性的患者。当前,在美国大约有 60 万难治性的 RA 患者[7]。难治性的 RA 病人常常有严重的临床症状,例如进行性的关节破坏,严重时导致残疾。对这类 TNFi bDMARDs 难治性的 RA 病人通常启动非 TNF 生物制剂的应用,这类制剂包括:细胞毒 T 淋巴细胞相关融合蛋白(CTLA-4 融合蛋白)、白介素-6 受体(IL-6R)和 CD20 抗体,或是以 JAK 为靶点的合成小分子药物,然而,根据 2015 年美国风湿学会指南,应用这类非 TNF 生物制剂或以 JAK 为靶点的小分子药物临床效果证据不足,同时应用上述生物制剂也会引发中度到重度的副作用[2]。最终,类风湿关节炎病人在当前的药物治疗下,会有 10% ~ 20% 的病人成为难治性的患者。所以,亟待有新的治疗难治性类风湿关节炎的治疗策略。
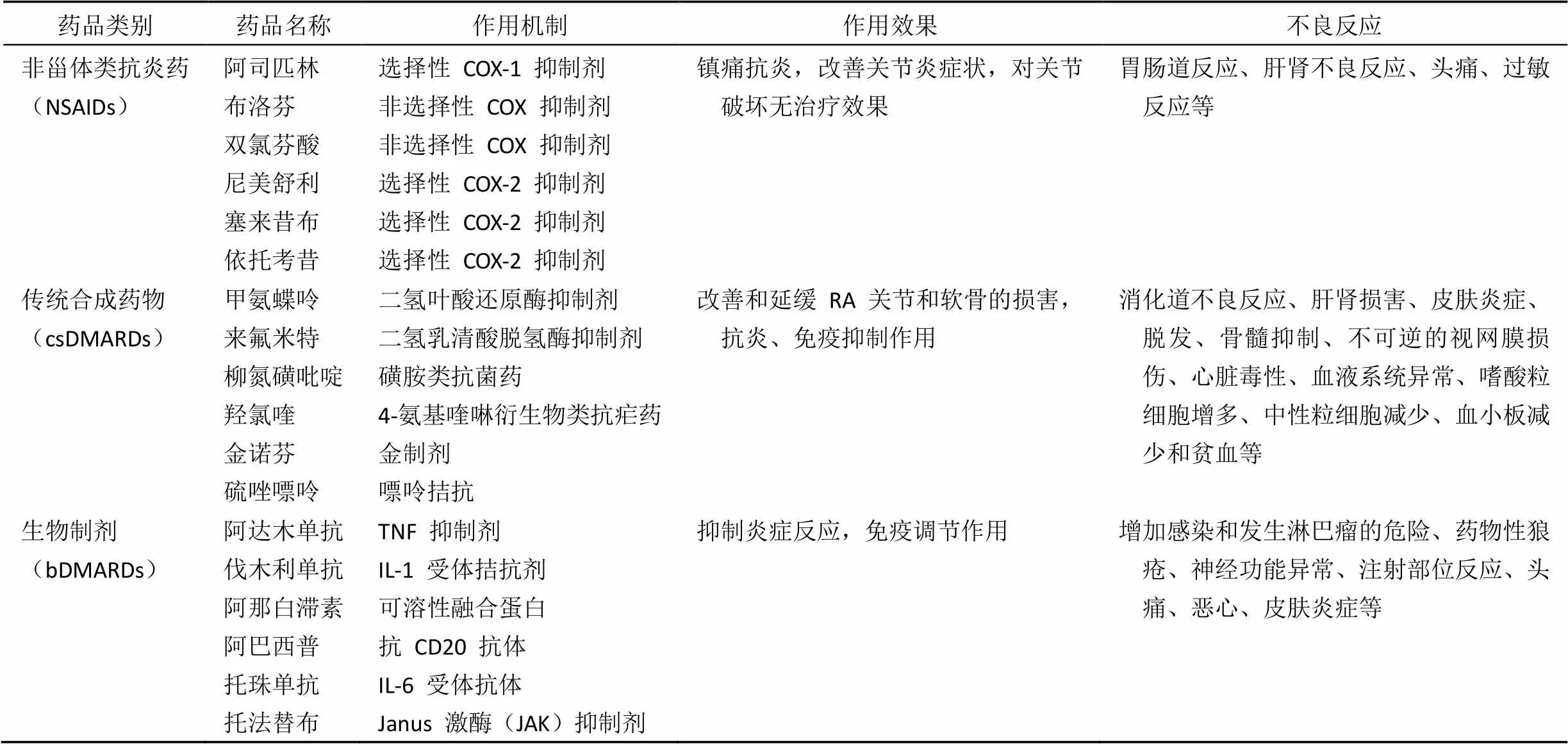
表 1 临床治疗类风湿关节炎常用药物
2 间充质干细胞治疗类风湿关节炎研究基础
间充质干细胞(mesenchymal stem cells,MSCs)是干细胞家族的重要成员,来源于早期的中胚层和外胚层,最初在骨髓中发现,具有多向分化潜能、造血支持和促进干细胞植入、免疫调控和自我复制等特点[9-11]。大量研究证实,间充质干细胞具有强烈的抗炎和免疫调节功能,同时具有修复关节和成骨损伤的作用,因此在类风湿关节炎等疾病治疗过程中显示出良好临床前景。
2.1 间充质干细胞的免疫调节作用
间充质干细胞对几乎所有固有免疫细胞和获得性免疫细胞具有调节作用[11-12]。研究表明,间充质干细胞可以通过一系列机制调节炎症,包括适应性和先天免疫反应。这些包括抑制 T 细胞增殖和功能,诱导 CD4+CD25+FoxP3+调节性 T 细胞亚群,抑制 B 细胞增殖、分化和免疫球蛋白产生,抑制树突状细胞成熟,促进巨噬细胞向抗炎表型极化,抑制自然杀伤细胞[13]。间充质干细胞的免疫调节是通过细胞与细胞的直接接触和在干扰素 IFNγ 的刺激下从活化的免疫细胞中释放的可溶性因子的分泌来介导的,包括前列腺素 E2、吲哚胺 2,3-双加氧酶(IDO)、一氧化氮和白细胞介素-10 等[13]。所有这些机制都可能有助于类风湿性关节炎炎症的解决。
不同的组织来源影响间充质干细胞的效力。来自多个组织的间充质干细胞均具有免疫调节特性,但这也使得 MSC 的效力和临床疗效的等效性与多样性成为了一个关键问题。间充质干细胞的效力似乎除其他因素外,还取决于通过胚胎组织形成的个体遗传途径和间充质干细胞在出生后所驻留的成人组织。例如,与来自骨髓、骨膜和脂肪组织[14]的间充质干细胞相比,滑膜间充质干细胞在体外表现出更强的软骨形成能力,而在体内,滑膜间充质干细胞的成骨能力不如骨膜间充质干细胞[15]。同样,组织来源似乎也会影响间充质干细胞的免疫抑制作用。例如,与骨髓间充质干细胞相比,Ad-MSCs 对 T 细胞和单核细胞具有更强的免疫抑制能力[16]。除了“有限”成体间充质干细胞,MSC 可以从胚胎干细胞中分化,其被认为是一种潜在的“无限”且更容易标准化的间充质干细胞来源。
2.2 间充质干细胞治疗类风湿关节炎
2.2.1 间充质干细胞通过免疫调节作用治疗类风湿关节炎 近年来,以间充质干细胞(MSC)为基础的治疗方法因其能有效调节免疫反应而成为治疗 RA 的一个治疗机会。RA 是一种慢性自身免疫性炎症性疾病,其病因尚不完全清楚。然而,已证实周围耐受缺陷以及随后不同的免疫细胞异常浸润到滑膜并被激活对 RA 的发展和进展至关重要。此外,促炎细胞和抗炎细胞免疫反应的不平衡,特别是记忆 Th17 和记忆调节T 细胞(Treg)之间的不平衡,被公认与 RA 的免疫发病机制有关。在这种情况下,MSC 能改变记忆淋巴细胞的频率和功能包括 Th17,卵泡辅助 T 细胞(Tfh)和 γδ T 细胞而促进 Treg 细胞生成,从而使其成为 RA 细胞疗法的候选。的确,考虑到记忆 CD4+T 细胞的可塑性,我们有理由认为 MSC 可以恢复 RA 中促炎和抗炎记忆 T 细胞群失调之间的平衡,从而促进它们的治疗功能[17]。
调节 T 细胞功能主要包括抑制 T 细胞增殖和活化 Tregs,最近的研究也更加证实了间充质干细胞对炎性关节炎的免疫调节作用。Lopez-Santalla 等[18]研究表明,静脉注射 CIA 小鼠脂肪间充质干细胞(Ad-MSCs)可减少血液和脾脏中 GM-CSF 表达的 CD4+T 细胞,它是 RA 病理生理学关键的效应细胞[19]。炎症反应时,调节性 T 细胞,包括经典的 Treg 亚群和 IL10+IL17-CD4+Tr1 细胞在脾脏减少,向引流淋巴结增多,并动员至炎症组织。此外,在 CIA 模型鼠体内注射 MSC 后,更多的 Th17 细胞表达抗炎细胞因子 IL-10,表明 MSC 能够诱导 Th17 细胞产生[20]。Tfh 细胞在次级淋巴组织[21]中向 B 细胞提供增殖信号,也参与了间充质干细胞的免疫抑制作用。脐带间充质干细胞(UC-MSCs)在体外抑制 Tfh 细胞的分化,CIA 发病的小鼠体内注射人 UC-MSCs 可降低脾脏中 Tfh 细胞的数量,并在体外共培养实验中抑制其支持 B 淋巴细胞分化的能力[22]。近年来研究表明,间充质干细胞对 B 细胞的抑制作用依赖于间充质干细胞与 T 细胞之间的相互作用[23],对 Tfh 细胞的影响可能介导间充质干细胞对 B 细胞的间接抑制作用。
破骨细胞介导的过度骨吸收导致局部和全身骨丢失,MSCs 对这个过程的保护作用可能是通过抑制促进破骨细胞形成的炎性细胞因子[24]和促进 Tregs 的升高介导的[25-26]。MSCs 对破骨细胞形成的直接抑制作用是通过产生核因子 kappa-B 配体诱饵受体骨保护蛋白[27],或通过 CD200/CD200R 依赖的与破骨细胞前体[28]的相对抑制作用。另一项研究表明,MSC 可在体外和体内部分通过 CD39-CD73-腺苷信号抑制破骨细胞的形成[29]。此外,最近的一项研究显示向 CIA 小鼠注射同基因 Ad-MSCs 细胞能够阻止局部和全身的骨损伤,这与骨髓中 CD11b+cfms+的破骨细胞前体减少有关[30],尽管机制还有待阐明。在最近的概念验证 I/II 期临床试验中,关节内注射自体 Ad-MSCs 到骨关节炎的膝关节,改善了功能和疼痛,没有引起不良事件,并减少了 MRI 确定的软骨缺损,组织学证据显示修复了透明软骨[31]。
细胞外囊泡(EVs)是细胞间交流的重要媒介,可表达多种表面受体,并携带生物活性蛋白、信使 RNAs、RNAs 和脂质等。所有细胞均可分泌 EVs,其参与各种生物学过程,包括组织稳态平衡的调节和疾病的病理生理过程等。而间充质干细胞来源的 EVs 重现了亲代细胞的主要功能,其通过免疫调节、促进组织细胞修复及再生作用等发挥治疗作用[32-34]。MSC-EVs 治疗实验性自身免疫性脑脊髓炎的研究显示,MSC-EVs 具有免疫抑制作用,其可以减少 T 细胞的增殖,增加 IL-10、转化生长因子-β1 的产生,促进细胞凋亡[35]。MSC- EVs 也可以减少 B 细胞增殖和分化,使免疫球蛋白的分泌减少[36]。利用 MSC 衍生的细胞外囊泡已被证明在介导组织再生和免疫调节中发挥作用,这是一个很有前景的发现[37-38]。有趣的是,细胞外囊泡的有益特性可能不仅仅依赖于干细胞。最近的一项研究表明,输送到血清的转移性关节炎小鼠膝关节的中性粒细胞来源的细胞外囊泡能够通过穿透无血管软骨细胞外基质向软骨细胞传递生物活性分子,显示出抗炎特性,阻止软骨降解,有利于软骨合成代谢的作用[39]。因此,细胞外囊泡,直接或负载治疗,可以作为一种 RA 的治疗策略,但目前其在 RA 的研究还处于实验室研究阶段,未来需进一步的临床试验证实。
为了提高治疗效果,研究了许多增强间充质干细胞免疫调节能力的策略。例如,与单细胞治疗相比,在 CIA 模型中,同时输注 MSC 和 Tr1 细胞在减少炎症、血管翳形成和软骨损伤方面更有效,这可能是通过 Tr1 细胞产生的 IFN-β 和 IL-10 诱导 MSC 表达 IDO 增加[40]。MSCs 具有免疫抑制作用,可能用于 RA 的治疗。同样,白细胞介素-4 也被证明是一种潜在的类风湿关节炎治疗方法。在最新的一项研究表明,MSCs 联合 IL-4 治疗胶原诱导的 RA 小鼠展现了良好的治疗效果,模型鼠软骨低聚物基质蛋白(Comp)、组织抑制物金属蛋白酶-1(Timp1)、基质金属蛋白酶 1(Mmp-1)和 IL-1 受体(IL-1r)基因表达水平分别下降了 60%、75%、70% 和 78%[41]。另一个方法是对间充质干细胞进行微颗粒的工程研究,微颗粒载有糖皮质激素布地奈德。与布地奈德预处理和未处理的间充质干细胞相比,这种间充质干细胞显示出更强的 IDO 活性,从而增强其体外的免疫抑制作用[42]。
2.2.2 间充质干细胞通过损伤修复功能治疗类风湿关节炎 间充质干细胞的修复潜能在临床前已被广泛研究,并在关节表面缺损和骨关节炎患者中进行了试验,取得了可喜的结果[43]。间充质干细胞的再生能力能够调节骨关节炎中关节合成代谢和分解代谢过程的失衡。关节内移植间充质干细胞诱导软骨替代物研究表明修复组织的主要来源是内源性的细胞。因此,推测在受损宿主体内移植细胞的旁分泌效应主要负责刺激软骨再生。此外,分化的间充质干细胞可分泌软骨组织必需成分蛋白聚糖和 II 型胶原[13, 44]。间充质干细胞释放的胞外小泡也被证明能够影响软骨再生[45-46]。干细胞胞外小泡介导的软骨修复相关研究甚少。间充质干细胞-胞外小泡促进新生软骨的形成与 II 型胶原蛋白和糖胺聚糖的沉积[47],过表达 miR-140-5P 的间充质干细胞-胞外小泡能够促进软骨细胞的迁移和增殖[37]。间充质干细胞分泌透明质酸包被的胞外小泡通过 CD44 受体向软骨缺损部位归巢[48]。
间充质干细胞在 RA 中的应用主要集中在免疫调节方面,目前流行的观点是间充质干细胞主要通过免疫抑制和抗炎活性来防止关节损伤,还没有证据表明注射的间充质干细胞能直接促进关节组织修复。在蛋白多糖诱导的关节炎小鼠关节内注射后,利用生物荧光成像技术追踪转染了荧光素酶的间充质干细胞,结果显示间充质干细胞在注射关节被保留了数周后,增加了注射的间充质干细胞直接或间接调节局部间质室从而促进组织修复的可能性[49]。最近对活体 MSC 群体的鉴定和谱系追踪模型的发展将有助于解决这一知识缺口。
2.2.3 间充质干细胞治疗类风湿关节炎的临床前研究 临床前研究表明 MSC 治疗 RA 样炎症性关节炎模型具有良好的疗效[50-51]。腹腔注射从人类胚胎干细胞中分化的间充质干细胞可改善胶原性关节炎(CIA)。注射的间充质干细胞被发现归巢到引流淋巴结并上调宿主 IDO 表达[52]。腹腔注射小鼠间充质干细胞治疗 CIA 关节破坏的研究发现在给药关节未能检测到间充质干细胞,表明 MSC 阻止关节损伤主要是由于抑制了免疫系统[51]。在最近的一项研究中提到,骨髓来源的 MSCs(BMSCs)、脐带来源的MSCs(UCs)以及人乳牙脱落干细胞对小鼠 CIA 都有显著的治疗作用,其中 UCs 展现出更加良好的治疗效果[53]。
值得注意的是,有几项研究未能证明间充质干细胞治疗能够改善 CIA,有些结果甚至更糟[50]。在一项综合研究中,Schurgers 等[54]报道无论是静脉还是腹腔内途径注射同源或异源间充质干细胞,都没有发现 MSC 治疗 CIA 的任何益处。相反,发病前或发病后注射 Treg 可显著改善关节炎[54]。MSCs 来源、组织来源、MSC 培养条件、治疗时间、注射细胞数量、注射途径和治疗方案[55]等变量可能会导致相互矛盾的结果。尽管 MSC 具有低免疫原性、低水平的 MHC-I 和缺乏 MHC-II 和共刺激分子,但是 MSC 在培养扩增和分化为成熟细胞类型可以增加 MHC-I 和 MHC-II 类分子的表达[56],和同种异体 MSC 可能在体内引起体液和细胞反应[57-59]。因此,这些细胞可能不是完全免疫赦免。供体变异也可能是一个混淆因素,许多研究未能证明使用来自不同人类供体的间充质干细胞的研究结果是否可重复。
3 间充质干细胞治疗类风湿关节炎的临床研究现状
在过去的 20 年间,广泛的研究已经表明了间充质干细胞介导治疗的潜力。MSC 具有来源广泛、易于分离和扩增、免疫原性低等特点,同时拥有旁分泌和免疫调节的作用。基于以上间充质干细胞的特性,有大量的研究将其作为免疫调节、损伤修复甚至是肿瘤治疗的临床用药进行深入研究。MSC 参与构成骨髓造血微环境,对造血干细胞的增殖与分化具有明显的支持作用。临床上将其与造血干细胞联合移植以促进移植后造血恢复。随后发现,MSC 不仅能预防移植物抗宿主病(graft versus host disease,GVHD)的发生,也可以作为 GVHD 的有效治疗手段。近期一项随机对照、双盲临床研究发现,半相合造血干细胞移植中联合 MSC 输注可显著降低 cGVHD 的发生率,提示 MSC 在 cGVHD 预防中的应用前景[60]。目前,转基因 MSC,如表达α-IFN、β-IFN、TRAIL、IL-2 等的 MSC 用于肿瘤治疗得到了广泛的研究。MSC 和抗肿瘤药物直接孵育后可有效摄取药物,实现药物的负载。与肿瘤细胞比较,MSC 对抗肿瘤药物的敏感度较低,可在相对较大的浓度范围内表现出对化疗药物较好的耐受性[61]。MSC 直接负载抗肿瘤药物系统释放药物的机制主要有两种:①通过被动扩散和 MSC 高表达的 P 糖蛋白(P-gp)排出细胞外[62];②通过 MSC 分泌的外泌体排出细胞外[63]。外泌体作为 MSC 向胞外分泌内源性生物活性分子的载体,近年来倍受关注。直接对外泌体进行载药或表面修饰已成为目前靶向递药的研究方向。MSC 还广泛用于自身免疫病的临床治疗中,目前,MSC 治疗克罗恩病的临床试验主要涉及管腔型或瘘管型克罗恩病。Panés 等[64]报道了利用同种异体脂肪来源的 MSC 治疗复杂性肛瘘的 III 期随机、双盲、平行组、安慰剂对照研究,共入组 212 例患者,MSC 组 107 例,对照组 105 例。研究发现,MSC 组有 53 例(50%)、对照组有 36 例(34%)患者达到肛瘘愈合标准,证实了 MSC 对瘘管的愈合作用显著。另一项多中心、随机、安慰剂对照、双盲的 III 期研究正在进行,旨在研究 MSC 治疗炎症性肠病的安全性和有效性[65]。不过,一项针对狼疮肾的随机双盲、安慰剂对照试验,共入组患者 18 例(试验组 12 例,对照组 6 例),研究发现,两组患者疾病缓解无明显差异,提示除了标准免疫抑制外,MSC 没有明显的治疗作用[66]。MSCs 治疗 RA 具有潜在的疗效,但也存在一定的问题。基于患者自体 MSCs 的数量和功能的缺陷,同种异体的 MSCs 治疗方案表现出来更大的优势。将同种异体骨髓间充质干细胞或脐带间充质干细胞静脉输注于 4 例对 DMARDs 且至少有一种抗肿瘤坏死因子-α 制剂耐药的 RA 患者,结果证实是安全的,并可带来部分和短暂的临床改善[67]。在 136 例对传统药物治疗反应不充分的活动期 RA 患者中,与对照组 36 例相比,静脉注射 UC-MSCs 可显著改善临床症状,治疗效果可维持 3 ~ 6 个月,且与外周血中 Treg 比例增加有关[68]。人脐带血来源的间充质干细胞(hUCB-MSCs)治疗 RA 的 I 期临床试验对使用甲氨蝶呤治疗但病情活动中等的 RA 患者进行了短期的安全性评估,9 例患者接受单次静脉输注2.5 × 107、5 × 107或 1 × 108细胞的 hUCB-MSCs,输注后 4 周内血清红细胞沉降率变化(n = 9)为 7.9 ± 10.4(= 0.0517),DAS28 变化为–1.60 ± 1.57(= 0.0159)。在注入 1 × 108MSCs 的集群中,24 h IL-1β、IL-6、IL-8 和 TNF-α 水平降低。针对确诊 RA 患者的 I 期 hUCB-MSC 输注试验显示没有短期安全性问题[69]。在最近的一项多中心、剂量递增、随机、单盲(疗效双盲)、安慰剂对照、Ib/IIa 期临床试验[70]中,46 例活动性难治性 RA 患者(至少两种生物制剂失败)静脉注射了异基因 Ad-MSCs 一般耐受良好,3 个月以上无明显毒性。有一种临床获益的趋势,但在 3 个月后不会持续,这表明 RA 细胞治疗需要反复给药。然而,在一些患者中,检测到对异基因细胞的敏化作用[70],这就提示在多次细胞输注时要谨慎。
综上所述,人体实验的初步数据表明同种异体间充质干细胞可以有效地治疗 RA,但是需要更大的、多中心的临床研究来获得可靠的证据。到目前为止,间充质干细胞在临床研究中的应用仅限于难治性的严重 RA 患者。如果在 RA 早期给予 MSC 治疗,通过诱导调控网络来“重置”免疫系统,MSC 治疗可能会更有效。临床研究中 RA 患者的选择标准至关重要。
MSC 治疗 RA 的作用机制研究已经取得了很大进展,MSC 将自身免疫过程重新连接到一个更原始、更耐受的状态是一个令人兴奋的观点。研究联合微环境及与所输注细胞群的相互作用将是最大限度地发挥 MSC 治疗潜力的关键。MSC 治疗作用机制的不断扩展将有助于我们理解 RA 的分子分类,将为患者分层提供信息,并将阐明我们在精确风湿病学中药理学干预的更多的问题。
[1] Yap HY, Tee SZ, Wong MM, et al. Pathogenic role of immune cells in rheumatoid arthritis: implications in clinical treatment and biomarker development. Cells, 2018, 7(10):E161.
[2] Singh JA, Saag KG, Bridges SL Jr, et al. 2015 American college of rheumatology guideline for the treatment of rheumatoid arthritis. Arthritis Care Res (Hoboken), 2016, 68(1):1-25.
[3] Rheumatoid arthritis: new guidelines open new doors. Lancet, 2010, 376(9741):566.
[4] McInnes IB, Schett G. The pathogenesis of rheumatoid arthritis.N Engl J Med, 2011, 365(23):2205-2219.
[5] Azizi G, Boghozian R, Mirshafiey A. The potential role of angiogenic factors in rheumatoid arthritis. Int J Rheum Dis, 2014, 17(4):369-383.
[6] McInnes IB, Buckley CD, Isaacs JD. Cytokines in rheumatoid arthritis - shaping the immunological landscape. Nat Rev Rheumatol, 2016, 12(1):63-68.
[7] Vander Cruyssen B, Van Looy S, Wyns B, et al. Four-year follow-up of infliximab therapy in rheumatoid arthritis patients with long-standing refractory disease: attrition and long-term evolution of disease activity. Arthritis Res Ther, 2006, 8(4):R112.
[8] Rubbert-Roth A, Finckh A. Treatment options in patients with rheumatoid arthritis failing initial TNF inhibitor therapy: a critical review. Arthritis Res Ther, 2009, 11 Suppl 1:S1.
[9] Le Blanc K, Pittenger M. Mesenchymal stem cells: progress toward promise. Cytotherapy, 2005, 7(1):36-45.
[10] Pittenger MF, Mackay AM, Beck SC, et al. Multilineage potential of adult human mesenchymal stem cells. Science, 1999, 284(5411): 143-147.
[11] Uccelli A, Moretta L, Pistoia V. Mesenchymal stem cells in health and disease. Nat Rev Immunol, 2008, 8(9):726-736.
[12] Nauta AJ, Fibbe WE. Immunomodulatory properties of mesenchymal stromal cells. Blood, 2007, 110(10):3499-3506.
[13] Uccelli A, de Rosbo NK. The immunomodulatory function of mesenchymal stem cells: mode of action and pathways. Ann N Y Acad Sci, 2015, 1351:114-126.
[14] Sakaguchi Y, Sekiya I, Yagishita K, et al. Comparison of human stem cells derived from various mesenchymal tissues: superiority of synovium as a cell source. Arthritis Rheum, 2005, 52(8):2521-2529.
[15] De Bari C, Dell'Accio F, Karystinou A, et al. A biomarker-based mathematical model to predict bone-forming potency of human synovial and periosteal mesenchymal stem cells. Arthritis Rheum, 2008, 58(1):240-250.
[16] Melief SM, Zwaginga JJ, Fibbe WE, et al. Adipose tissue-derived multipotent stromal cells have a higher immunomodulatory capacity than their bone marrow-derived counterparts. Stem Cells Transl Med, 2013, 2(6):455-463.
[17] Luque-Campos N, Contreras-López RA, Jose Paredes-Martínez M, et al. Mesenchymal stem cells improve rheumatoid arthritis progression by controlling memory T cell response. Front Immunol, 2019, 10:798.
[18] Lopez-Santalla M, Mancheño-Corvo P, Menta R, et al. Human adipose-derived mesenchymal stem cells modulate experimental autoimmune arthritis by modifying early adaptive T cell responses. Stem Cells, 2015, 33(12):3493-3503.
[19] Cornish AL, Campbell IK, McKenzie BS, et al. G-CSF and GM-CSF as therapeutic targets in rheumatoid arthritis. Nat Rev Rheumatol, 2009, 5(10):554-559.
[20] Ghannam S, Pène J, Moquet-Torcy G, et al. Mesenchymal stem cells inhibit human Th17 cell differentiation and function and induce a T regulatory cell phenotype. J Immunol, 2010, 185(1):302-312.
[21] Ma CS, Deenick EK. Human T follicular helper (Tfh) cells and disease. Immunol Cell Biol, 2014, 92(1):64-71.
[22] Liu R, Li X, Zhang Z, et al. Allogeneic mesenchymal stem cells inhibited T follicular helper cell generation in rheumatoid arthritis. Sci Rep, 2015, 5:12777.
[23] Rosado MM, Bernardo ME, Scarsella M, et al. Inhibition of B-cell proliferation and antibody production by mesenchymal stromal cells is mediated by T cells. Stem Cells Dev, 2015, 24(1):93-103.
[24] Schett G, Teitelbaum SL. Osteoclasts and arthritis. J Bone Miner Res, 2009, 24(7):1142-1146.
[25] Kelchtermans H, Geboes L, Mitera T, et al. Activated CD4+CD25+ regulatory T cells inhibit osteoclastogenesis and collagen-induced arthritis. Ann Rheum Dis, 2009, 68(5):744-750.
[26] Zaiss MM, Frey B, Hess A, et al. Regulatory T cells protect from local and systemic bone destruction in arthritis. J Immunol, 2010, 184(12): 7238-7246.
[27] Oshita K, Yamaoka K, Udagawa N, et al. Human mesenchymal stem cells inhibit osteoclastogenesis through osteoprotegerin production. Arthritis Rheum, 2011, 63(6):1658-1667.
[28] Varin A, Pontikoglou C, Labat E, et al. CD200R/CD200 inhibits osteoclastogenesis: new mechanism of osteoclast control by mesenchymal stem cells in human. PLoS One, 2013, 8(8):e72831.
[29] Luo Y, Wu W, Gu J, et al. Human gingival tissue-derived MSC suppress osteoclastogenesis and bone erosion via CD39-adenosine signal pathway in autoimmune arthritis. EBioMedicine, 2019, 43:620- 631.
[30] Garimella MG, Kour S, Piprode V, et al. Adipose-derived mesenchymal stem cells prevent systemic bone loss in collagen-induced arthritis. J Immunol, 2015, 195(11):5136-5148.
[31] Jo CH, Lee YG, Shin WH, et al. Intra-articular injection of mesenchymal stem cells for the treatment of osteoarthritis of the knee: a proof-of-concept clinical trial. Stem Cells, 2014, 32(5):1254-1266.
[32] Maumus M, Jorgensen C, Noël D. Mesenchymal stem cells in regenerative medicine applied to rheumatic diseases: role of secretome and exosomes. Biochimie, 2013, 95(12):2229-2234.
[33] Sabin K, Kikyo N. Microvesicles as mediators of tissue regeneration. Transl Res, 2014, 163(4):286-295.
[34] Lindoso RS, Collino F, Bruno S, et al. Extracellular vesicles released from mesenchymal stromal cells modulate miRNA in renal tubular cells and inhibit ATP depletion injury. Stem Cells Dev, 2014, 23(15): 1809-1819.
[35] Mokarizadeh A, Delirezh N, Morshedi A, et al. Microvesicles derived from mesenchymal stem cells: potent organelles for induction of tolerogenic signaling. Immunol Lett, 2012, 147(1-2):47-54.
[36] Monguió-Tortajada M, Roura S, Gálvez-Montón C, et al. Nanosized UCMSC-derived extracellular vesicles but not conditioned medium exclusively inhibit the inflammatory response of stimulated T cells: implications for nanomedicine. Theranostics, 2017, 7(2):270-284.
[37] Zhang S, Chu WC, Lai RC, et al. Exosomes derived from human embryonic mesenchymal stem cells promote osteochondral regeneration. Osteoarthritis Cartilage, 2016, 24(12):2135-2140.
[38] Blazquez R, Sanchez-Margallo FM, de la Rosa O, et al. Immunomodulatory potential of human adipose mesenchymal stem cells derived exosomes on in vitro stimulated T cells. Front Immunol, 2014, 5:556.
[39] Headland SE, Jones HR, Norling LV, et al. Neutrophil-derived microvesicles enter cartilage and protect the joint in inflammatory arthritis. Sci Transl Med, 2015, 7(315):315ra190.
[40] Lim JY, Im KI, Lee ES, et al. Enhanced immunoregulation of mesenchymal stem cells by IL-10-producing type 1 regulatory T cells in collagen-induced arthritis. Sci Rep, 2016, 6:26851.
[41] Haikal SM, Abdeltawab NF, Rashed LA, et al. Combination therapy of mesenchymal stromal cells and interleukin-4 attenuates rheumatoid arthritis in a collagen-induced murine model. Cells, 2019, 8(8):E823.
[42] Ankrum JA, Dastidar RG, Ong JF, et al. Performance-enhanced mesenchymal stem cells via intracellular delivery of steroids. Sci Rep, 2014, 4:4645.
[43] Roelofs AJ, Rocke JP, De Bari C. Cell-based approaches to joint surface repair: a research perspective. Osteoarthritis Cartilage, 2013, 21(7):892-900.
[44] Nam Y, Rim YA, Jung SM, et al. Cord blood cell-derived iPSCs as a new candidate for chondrogenic differentiation and cartilage regeneration. Stem Cell Res Ther, 2017, 8(1):16.
[45] Zhu Y, Wu X, Liang Y, et al. Repair of cartilage defects in osteoarthritis rats with induced pluripotent stem cell derived chondrocytes. BMC Biotechnol, 2016, 16(1):78.
[46] Richardson SM, Kalamegam G, Pushparaj PN, et al. Mesenchymal stem cells in regenerative medicine: Focus on articular cartilage and intervertebral disc regeneration. Methods, 2016, 99:69-80.
[47] Spees JL, Lee RH, Gregory CA. Mechanisms of mesenchymal stem/stromal cell function. Stem Cell Res Ther, 2016, 7(1):125.
[48] Tao SC, Yuan T, Zhang YL, et al. Exosomes derived from miR-140-5p-overexpressing human synovial mesenchymal stem cells enhance cartilage tissue regeneration and prevent osteoarthritis of the knee in a rat model. Theranostics, 2017, 7(1):180-195.
[49] Swart JF, de Roock S, Hofhuis FM, et al. Mesenchymal stem cell therapy in proteoglycan induced arthritis. Ann Rheum Dis, 2015, 74(4):769-777.
[50] MacDonald GI, Augello A, De Bari C. et al. Role of mesenchymal stem cells in reestablishing immunologic tolerance in autoimmune rheumatic diseases. Arthritis Rheum, 2011, 63(9):2547-2557.
[51] Augello A, Tasso R, Negrini SM, et al. Cell therapy using allogeneic bone marrow mesenchymal stem cells prevents tissue damage in collagen-induced arthritis. Arthritis Rheum, 2007, 56(4):1175-1186.
[52] Gonzalo-Gil E, Pérez-Lorenzo MJ, Galindo M, et al. Human embryonic stem cell-derived mesenchymal stromal cells ameliorate collagen-induced arthritis by inducing host-derived indoleamine 2,3 dioxygenase. Arthritis Res Ther, 2016, 18:77.
[53] Zhang Q, Li Q, Zhu J, et al. Comparison of therapeutic effects of different mesenchymal stem cells on rheumatoid arthritis in mice. PeerJ, 2019, 7:e7023.
[54] Schurgers E, Kelchtermans H, Mitera T, et al. Discrepancy between the in vitro and in vivo effects of murine mesenchymal stem cells on T-cell proliferation and collagen-induced arthritis. Arthritis Res Ther, 2010, 12(1):R31.
[55] Wang HS, Hung SC, Peng ST, et al. Mesenchymal stem cells in the Wharton's jelly of the human umbilical cord. Stem Cells, 2004, 22(7): 1330-1337.
[56] Le Blanc K, Tammik C, Rosendahl K, et al. HLA expression and immunologic properties of differentiated and undifferentiated mesenchymal stem cells. Exp Hematol, 2003, 31(10):890-896.
[57] Zangi L, Margalit R, Reich-Zeliger S, et al. Direct imaging of immune rejection and memory induction by allogeneic mesenchymal stromal cells. Stem Cells, 2009, 27(11):2865-2874.
[58] Nauta AJ, Westerhuis G, Kruisselbrink AB, et al. Donor-derived mesenchymal stem cells are immunogenic in an allogeneic host and stimulate donor graft rejection in a nonmyeloablative setting. Blood, 2006, 108(6):2114-2120.
[59] Griffin MD, Ryan AE, Alagesan S, et al. Anti-donor immune responses elicited by allogeneic mesenchymal stem cells: what have we learned so far? Immunol Cell Biol, 2013, 91(1):40-51.
[60] Gao L, Zhang Y, Hu B, et al. Phase II multicenter, randomized, double-blind controlled study of efficacy and safety of umbilical cord-derived mesenchymal stromal cells in the prophylaxis of chronic graft-versus-host disease after hla-haploidentical stem-cell transplantation. J Clin Oncol, 2016, 34(24):2843-2850.
[61] Nicolay NH, Lopez Perez R, Rühle A, et al. Mesenchymal stem cells maintain their defining stem cell characteristics after treatment with cisplatin. Sci Rep, 2016, 6:20035.
[62] Yao S, Li X, Liu J, et al. Maximized nanodrug-loaded mesenchymal stem cells by a dual drug-loaded mode for the systemic treatment of metastatic lung cancer. Drug Deliv, 2017, 24(1):1372-1383.
[63] Cosenza S, Ruiz M, Maumus M, et al. Pathogenic or therapeutic extracellular vesicles in rheumatic diseases: role of mesenchymal stem cell-derived vesicles. Int J Mol Sci, 2017, 18(4):E889.
[64] Panés J, García-Olmo D, Van Assche G, et al. Expanded allogeneic adipose-derived mesenchymal stem cells (Cx601) for complex perianal fistulas in Crohn's disease: a phase 3 randomised, double-blind controlled trial. Lancet, 2016, 388(10051):1281-1290.
[65] Salem GA, Selby GB. Stem cell transplant in inflammatory bowel disease: a promising modality of treatment for a complicated disease course. Stem Cell Investig, 2017, 4:95.
[66] Deng D, Zhang P, Guo Y, et al. A randomised double-blind, placebo-controlled trial of allogeneic umbilical cord-derived mesenchymal stem cell for lupus nephritis. Ann Rheum Dis, 2017, 76(8):1436-1439.
[67] Liang J, Li X, Zhang H, et al. Allogeneic mesenchymal stem cells transplantation in patients with refractory RA. Clin Rheumatol, 2012, 31(1):157-161.
[68] Wang L, Wang L, Cong X, et al. Human umbilical cord mesenchymal stem cell therapy for patients with active rheumatoid arthritis: safety and efficacy. Stem Cells Dev, 2013, 22(24):3192-3202.
[69] Park EH, Lim HS, Lee S, et al. Intravenous infusion of umbilical cord blood-derived mesenchymal stem cells in rheumatoid arthritis: a phase Ia clinical trial. Stem Cells Transl Med, 2018, 7(9):636-642.
[70] Álvaro-Gracia JM, Jover JA, García-Vicuña R, et al. Intravenous administration of expanded allogeneic adipose-derived mesenchymal stem cells in refractory rheumatoid arthritis (Cx611): results of a multicentre, dose escalation, randomised, single-blind, placebo-controlled phase Ib/IIa clinical trial. Ann Rheum Dis, 2017, 76(1):196-202.
10.3969/j.issn.1673-713X.2019.05.014
北京市科技型中小企业促进专项(Z17010101061)
刘拥军,Email:andyliuliu2001@aliyun.com
2019-07-22

